单纯性肥胖小鼠动物模型的构建及评价*
2020-02-11朱梦梦张泽家范瑞瑞葛少钦
朱梦梦 张泽家 赵 琳 范瑞瑞 葛少钦,
1 河北大学医学院,河北省保定市 071002; 2 河北大学中医学院
随着人们生活水平、饮食结构的改变,肥胖显然已经成为全世界共同面临的公共卫生问题[1]。肥胖症在临床上根据病因可分为单纯性和继发性肥胖,单纯性肥胖是指没有明显神经、内分泌系统形态及功能改变,但伴有脂质、糖代谢调整过程障碍,是临床中为主导的肥胖类型[2]。为了更好地研究肥胖的病理机制,为治疗提供基础依据,本研究用高脂饮食喂养建立单纯性肥胖小鼠模型,通过其Lee’s指数、肝功能酶、血糖血脂的变化以及脂肪体积及分布情况等验证模型的可重复性,为进一步研究提供实验依据。
1 材料与方法
1.1 实验动物及饲料 3周龄的100只SPF级的雄性C57BL/6N小鼠,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006;高脂饲料25kg,购自北京杰美生物科技有限公司;维持饲料10kg,购自北京科澳协力饲料有限公司。
1.2 主要试剂与仪器 全自动生化仪(7600-110)(日本日立有限公司),QuantumFX microCT (PerkinElmer),50%葡萄糖注射液(石家庄四药有限公司),胰岛素注射液(江苏万邦生化医药集团有限责任公司),血糖试纸、血糖仪(三诺生物传感股份有限公司)。
1.3 方法
1.3.1 造模及分组:将100只雄性小鼠随机分为正常组(20只)和模型组(80只)。共造模10周,每周称量两组小鼠的体重,造模10周后测量小鼠体长、腰围,根据公式计算Lee’s指数[Lee’s指数=体重1/3(g)/体长(cm)×103]。
1.3.2 葡萄糖耐量实验(Glucose tolerance test, GTT)和胰岛素抵抗实验(Intraperitoneal insulin tolerance test,ITT):GTT:将小鼠禁食不禁水12h之后,按每只小鼠体重给药(4μl/g)腹腔注射浓度为50%的葡萄糖溶液;ITT:将小鼠禁食不禁水6h之后,按每只小鼠体重给药(0.75IU/g)腹腔注射胰岛素溶液,都分别于第 0、15、30、60、90、120min 时剪小鼠尾尖的一部分获得静脉血,随即用血糖试纸测量血糖值,并记录数据。
1.3.3 小动物CT成像(micro-CT):麻醉小鼠并将其固定于鼠床上进行扫描,将扫描所得的投影数据进行重建并导入分析软件进行分析,选取参照点,调整密度区间,检测小鼠皮下、腹部和内脏脂肪的分布,然后根据各个层面进行叠加计算得出总的脂肪体积。
1.3.4 血清生化指标的测定:采用全自动生化仪检测血清中ALT、AST、GGT、GLU、TC 、TG、HDL、LDL和VLDL的水平。
1.4 统计学方法 所有数据均用SPSS19.0软件进行统计,定量资料以均数±标准差表示,数据采用直观分析法和独立样本t检验相结合进行统计。以α=0.05作为检验统计量。P<0.05时差异有统计学意义。
2 结果
2.1 造模期间小鼠的体重变化 表1中显示,喂养高脂饲料前,两组小鼠间体重无差异(P>0.05),造模10周后,模型组小鼠体重比正常组高出37.2%(P<0.01),说明单纯性肥胖模型造模成功。80只模型组小鼠中,共有71只小鼠建立为单纯性肥胖模型,造模成功率为88.75%。
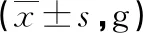
表1 造模期间小鼠体重变化
2.2 小鼠体长、腰围及Lee’s指数的比较 表2结果显示,模型组小鼠的体长、腰围、Lee’s指数均大于正常组(P<0.01)。

表2 两组小鼠体长、腰围及Lee’s指数的比较
2.3 两组小鼠的脂肪体积以及分布情况 表3所示,模型组小鼠的脂肪总体积高于正常小鼠(P<0.01),从图1中可以看出模型组小鼠的皮下、腹部脂肪和内脏脂肪分布明显多于正常组小鼠。

表3 两组小鼠脂肪总体积的比较

图1两组小鼠的脂肪分布图
A为正常组,B为模型组 A4、B4是合成的立体图 A1、B1为小鼠上切面图 A2、B2为小鼠正切面图 A3、B3为小鼠侧切面图
2.4 两组小鼠肝功能酶水平的比较 表4所示,肥胖小鼠的AST、ALT水平均高于正常饮食小鼠(P<0.01),而GGT水平无差异(P>0.05)。
2.5 两组小鼠的血糖、血脂水平 表5所示,模型组小鼠血糖水平高于正常组小鼠(P<0.01)。模型组小鼠血清TC、HDL、LDL、VLDL含量高于正常组(P<0.01),TG含量低于正常组小鼠(P<0.01)。
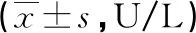
表4 两组小鼠肝功能酶水平的比较
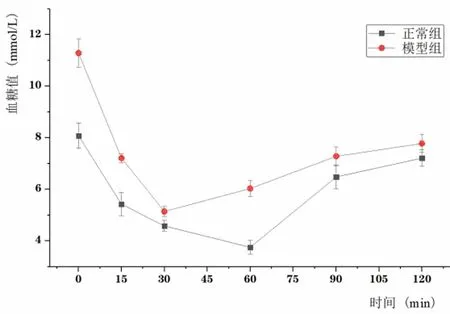
2.6 两组小鼠的GTT、ITT比较 图2显示,GTT实验中两组小鼠血糖在15min时升到最高,之后正常组开始均匀下降, 模型组在30min时仍然很高,而且模型组小鼠在每个检测的时间节点血糖值都高于正常组(P<0.01)。ITT实验结果表明,正常组小鼠血糖在60min时降到最低,而模型组小鼠血糖浓度在30min时降到最低,并且模型组小鼠在每个检测的时间节点血糖值都高于正常组(P<0.01),表明模型组小鼠出了葡萄糖耐量异常和胰岛素抵抗的现象。
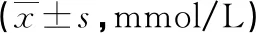
表5 两组小鼠血糖血脂水平的比较
ITT血糖变化图
3 讨论
研究证实,肥胖不仅是引发糖尿病、高血压、动脉粥样硬化等代谢性疾病的独立危险因素,也与癌症等疾病密切相关,已成为人类健康的绊脚石[3]。而单纯性肥胖是指无其他疾病诱发,纯粹是能量摄入超过消耗引起的肥胖[4]。想要更好地研究单纯性肥胖的作用机制及治疗方法,首先建立适宜的动物模型是研究的重要基础,是揭示单纯性肥胖的发生机制以及药物治疗机理的必要条件。
制备动物肥胖模型的方法较多, 如谷氨酸单钠选择性损伤下丘脑[5]、电刺激损伤[6]等均可制作成实验性肥胖动物模型,但这些方法操作复杂且均是下丘脑性肥胖模型,为模仿单纯性肥胖,本实验采用高脂饮食诱导方式建立单纯性肥胖小鼠动物模型,方法简便易行。高脂喂养1周后,模型组小鼠的体重明显增长,并持续至实验末,与对照组比平均增长 37.2%。若以体重增加20.0%作为肥胖标准,单纯性肥胖小鼠造模成功率为88.75%。有研究表明肥胖会导致体内血糖、血脂、肝功能指标以及内分泌激素水平发生一定的变化[7],因此小鼠肥胖的衡量标准除体重、Lee’s指数外,血清中AST、ALT、GGT、GLU、TC、TG、HDL、LDL和VLDL的水平均是评价单纯性肥胖动物模型是否成功的重要指标。实验结果显示,模型组小鼠血清GLU、TC、HDL、LDL、VLDL水平高于正常组并与体重呈明显正相关,血清中AST、ALT水平高于正常组小鼠,出现轻度肝损伤现象,而GGT水平无明显变化,说明没有严重的肝损伤情况,通常ALT和AST升高程度与肝细胞受损程度相一致。此外,采用micro-CT对小鼠进行扫描,能更直观地分析肥胖小鼠的脂肪分布情况,从图1中可以看出模型组小鼠腹部、皮下脂肪增加较多,脂肪总体积明显高于正常组小鼠。从图2中的GTT与ITT血糖变化图显示出模型组小鼠出现了葡萄糖耐量异常及胰岛素抵抗现象,但空腹血糖水平仍在正常范围之内(7.0~11.5mmol/L)。以上均说明了单纯性肥胖小鼠模型构建成功。
综上所述,本研究建立的单纯性肥胖小鼠模型操作简单,造模条件量化、可控、造模周期相对较短、模型基本稳定。可作为开展单纯性肥胖基础研究的动物模型,为开发治疗单纯性肥胖的有效药物提供基础实验依据。
