复发缓解型多发性硬化患者扣带束白质完整性与扣带皮质灌注研究
2020-02-10郑桥李咏梅谢敏曾春韩永良陈晓娅
郑桥,李咏梅,谢敏,曾春,韩永良,陈晓娅
重庆医科大学附属第一医院放射科,重庆 400016; *通讯作者 李咏梅 lymzhang70@aliyun.com
多发性硬化症(multiple sclerosis,MS)是一种常见的中枢神经系统慢性自身免疫性炎性脱髓鞘疾病,多见于青壮年女性,以复发缓解型多发性硬化(relapsing remitting multiple sclerosis,RRMS)最为常见[1]。其病理改变以脱髓鞘、轴索损伤、炎症、神经胶质增生及神经元丢失为特征[2]。扣带皮层是边缘系统的主要部分,在经典Papez 环路中作为关键神经部位参与情绪活动。扣带皮层具有多方面的生理心理功能,不仅与情绪有关,还涉及感知觉、运动、注意、记忆以及其他高级认知过程。扣带束是扣带回与其他脑结构之间的联系纤维,其完整性可能与MS 患者的认知功能、精神等改变直接相关。既往研究表明,扣带回在MS 病程进展中最先出现萎缩[3]。边缘系统中扣带皮层与认知功能障碍及抑郁的相关性较强,且扣带束的改变也与MS 患者的认知改变紧密联系[4-6]。因此,扣带回和扣带束在MS 病程进展中易受损害,且与患者认知功能下降以及抑郁有关。本研究使用扩散张量成像(diffusion tensor imaging,DTI)和三维伪连续动脉自旋标记( three-dimensional pseudo continuous arterial spin labeling,3D-pCASL)技术探讨扣带束白质完整性和扣带皮质灌注改变及其与认知及抑郁的相关性。
1 资料与方法
1.1 研究对象 连续纳入2017 年1 月—2018 年12 月重庆医科大学附属第一医院神经内科诊断明确并行MRI 检查的RRMS 患者24 例(MS 组),年龄20~59岁,男6例、女18例,扩展残疾状态量表(expanded disability status scale,EDSS)评分0.5~7.5 分,病程1~13 年。纳入标准:①RRMS 诊断基于2017 年修订的McDonald 标准,即脱髓鞘症状发作具备空间多发和时间多发的客观证据[7];②常规MRI 检查显示脑组织存在符合MS 的诊断病灶,无脑缺血灶、脑梗死、肿瘤和脑萎缩;③既往无脑血管病、脑肿瘤等神经系统疾病史。排除标准:①近3 个月内有静脉注射糖皮质激素史或有复发;②既往有大量抗抑郁药物服用史、大量酗酒史;③图像质量欠佳、头动伪影较大;④有MRI 检查禁忌证,如带有心脏起搏器及其他金属异物、幽闭恐惧症等。同期招募26 名健康体检者作为对照组,年龄22~53 岁,男10 例、女16 例。纳入标准:既往无神经精神、神经系统疾病史,无神经系统症状,体检无明确神经系统阳性体征,常规MRI检查无异常。所有受试者均为右利手。MRI 扫描前对受试者进行临床资料采集及神经心理学量表评分,包括EDSS 量表、汉密顿抑郁量表(Hamilton depression scale,HAMD)和符号数字转换测验(symbol digit modalities test,SDMT)。两组受试者年龄、性别及受教育年限差异均无统计学意义(P均>0.05),SDMT评分、HAMD 评分差异有统计学意义(P=0.005、P=0.01)。本研究经医院伦理委员会批准,所有受试者及(或)家属均签署知情同意书。
1.2 仪器与方法 采用GE Signa HDxt 3.0T MR 扫描仪,使用8 通道相控阵标准头部线圈。扫描过程中嘱受试者安静平躺,闭目,保持清醒。采集常规轴位T1WI(TR 250 ms、TE 2.86 ms)、轴位T2WI(TR 3600 ms、TE 120 ms)、液体衰减反转恢复(fluidattenuated inversion recovery,FLAIR)序列(TR 8000 ms、TE 120 ms),层厚5 mm,层数20;3D-pCASL 灌注扫描参数:PLD 1525 ms,FOV 24 cm×24 cm,矩阵512×8,层数60;轴位3D-T1WI 扫描参数:TR 8.3 ms,TE 3.3 ms,翻转角12°,矩阵256×256,层厚1.0 mm,层数156;轴位DTI 采用单次激发自旋回波平面回波(spin echo-echo planar imaging,SE-EPI)序列扫描参数:TR 15 000 ms,TE 86.8ms,FOV 24 cm×24 cm,矩阵128×128,层厚2.4 mm,无间隔,层数53,b 值分别为0、1000 s/mm2,30 个扩散方向。
1.3 数据处理 ASL 数据处理采用GE AW 4.6 工作站,使用Function Tool 软件自带的3D-pCASL 后处理软件,生成脑血流量(cerebral blood flow,CBF)图。使用SPM8 软件,将CBF 图与3DT1 图像进行配准,以蒙特利尔标准脑空间(Montreal neurological institute,MNI)152 模板为标准进行空间标准化,然后进行空间平滑。最后使用MNI152 标准空间大脑亚区模板中扣带模板提取扣带亚区灌注值。3D-T1 数据处理采用Freesurfer 软件(http://surfer.nMR.mgh.harvard.edu),预处理步骤包括去除头动、标准化、去除非脑结构、表面平滑及图像重建。使用MNI152 标准空间大脑亚区模板提取各扣带亚区皮层体积值。单侧扣带皮层的平均灌注计算为单侧大脑半球以下灰质(前扣带皮层头部和尾部,后扣带皮层和扣带皮层峡部)ROI 的平均值,每个区域对平均值的贡献由该区域的体积加权[8]。
使用扩散磁共振处理软件PANDA 进行数据处理。预处理步骤包括去除非脑组织和涡流校正,再通过拟合扩散数据的张量模型计算每名患者部分各向异性分数(fractional anisotropy,FA)和平均扩散率(mean diffusivity,MD)图。参照软件自带的约翰霍普金斯的分区图谱将扣带束分为2 部分,分别为沿胼胝体走行的扣带回部(cingulum-cingulate gyrus,CGC ) 和沿海马走行的海马部( cingulumhippocampus,CGH),并获得扣带束的FA 值和MD值(图1)。

图1 扣带皮层与扣带束在标准大脑矢状位图示。扣带皮层从前到后分别为前扣带皮层喙部(紫色)、前扣带皮层尾部(浅蓝色)、后扣带皮层(黄色)、扣带皮层峡部(深蓝色);扣带束从前到后为扣带束扣带回部(红色)、扣带束海马部(绿色)
1.4 统计学方法 采用SPSS 22.0 软件,首先对各项数据进行K-S 正态性检验。计量资料以±s表示,正态分布数据采用独立样本t检验,非正态分布数据采用Mann-WhitneyU检验;性别分布比较行X2检验。采用Pearson 相关、Spearman 相关以及偏相关分析评估RRMS 患者MRI 参数值与临床资料及神经心理学量表评分的相关性,以及确定扣带皮层的CBF 与扣带束的WM 显微结构完整性之间的关系。P<0.05 表示有统计学意义。
2 结果
2.1 RRMS 患者扣带束微观结构及扣带皮层灌注的改变 与对照组相比,MS 组患者双侧CGC 部FA 值明显降低,MD 值明显升高;右侧CGH 部FA 值明显降低,双侧CGH 部MD 值明显升高,差异有统计学意义(P<0.01),见表1。MS 组左侧前扣带皮层尾部、右侧后扣带皮层及扣带皮层峡部CBF 值显著减低,差异有统计学意义(P<0.05)。右侧扣带皮层平均CBF 值显著低于对照组,差异有统计学意义(P<0.05),见表2。
2.2 相关性分析 SDMT 评分与年龄(r=-0.699、P=0.000)及EDSS 评分(r=-0.443、P=0.030)呈负相关,与受教育年限呈正相关(r=0.746、P=0.000),与 性别及病程无显著相关性(P>0.05)。HAMD 评分与年龄、性别、受教育年限、EDSS 评分及病程均无显著相关性(P>0.05)。
表1 MS 组与对照组扣带束FA 值及MD 值比较(±s)

表1 MS 组与对照组扣带束FA 值及MD 值比较(±s)
FA 值 左侧CGC 0.41±0.05 0.46±0.03 -5.122 <0.001 右侧CGC 0.35±0.05 0.42±0.03 -5.924 <0.001 左侧CGH 0.30±0.04 0.32±0.03 -1.174 0.248 右侧CGH 0.28±0.04 0.31±0.03 -2.991 0.004 MD 值(×10-3 mm2/s) 左侧CGC 0.82±0.05 0.77±0.02 5.064 <0.001 右侧CGC 0.80±0.05 0.76±0.02 4.067 <0.001 左侧CGH 0.86±0.07 0.80±0.03 3.594 0.001 右侧CGH 0.92±0.09 0.83±0.03 4.433 <0.001
表2 MS 组与对照组扣带亚区CBF 值比较(±s)

表2 MS 组与对照组扣带亚区CBF 值比较(±s)
左侧 前扣带皮层喙部 57.65 ±14.37 59.72 ±12.45 -0.584 0.586 前扣带皮层尾部 55.38 ±11.51 61.47 ±9.34 -2.058 0.045 后扣带皮层 64.59 ±10.21 68.80 ±11.71 -1.352 0.183 扣带皮层峡部 59.73 ±9.90 66.08 ±12.36 -1.994 0.052 平均CBF 59.86 ±10.34 64.51 ±10.79 -1.552 0.127 右侧 前扣带皮层喙部 57.85 ±11.44 61.80 ±8.32 -1.226 0.226 前扣带皮层尾部 55.90 ±7.99 67.78 ±12.58 -1.670 0.103 后扣带皮层 61.61 ±8.32 69.64 ±14.06 -2.480 0.017 扣带皮层峡部 59.70 ±11.20 67.78 ±12.58 -2.390 0.021 平均CBF 59.12 ±8.27 65.98 ±12.24 -2.302 0.026
神经心理学量表评分与ASL 及DTI 参数的相关性显示,SDMT 评分与扣带皮层CBF 值及扣带束FA值和MD 值相关性见表3。其余EDSS 评分及SDMT、HAMD 评分与MRI 测量值间无显著相关性。RRMS患者扣带皮层右侧总CBF 值与右侧CGC 部FA (r=0.300、P=0.035)及MD 值(r=-0.357、P=0.011),及右侧CGH 部MD 值(r=-0.336、P=0.017)间具有显著相关性。偏相关分析结果显示,SDMT 评分与双侧扣带束CGC 部分FA 值仍有显著相关性(左侧:r=0.385,P=0.008,右侧:r=0.493,P=0.000);且其与扣带束CGH 部分右侧FA 值呈正相关(r=-0.363,P=0.012),双侧MD 值呈负相关(左侧:r=-0.350,P=0.016,右侧:r=-0.429,P=0.003)。
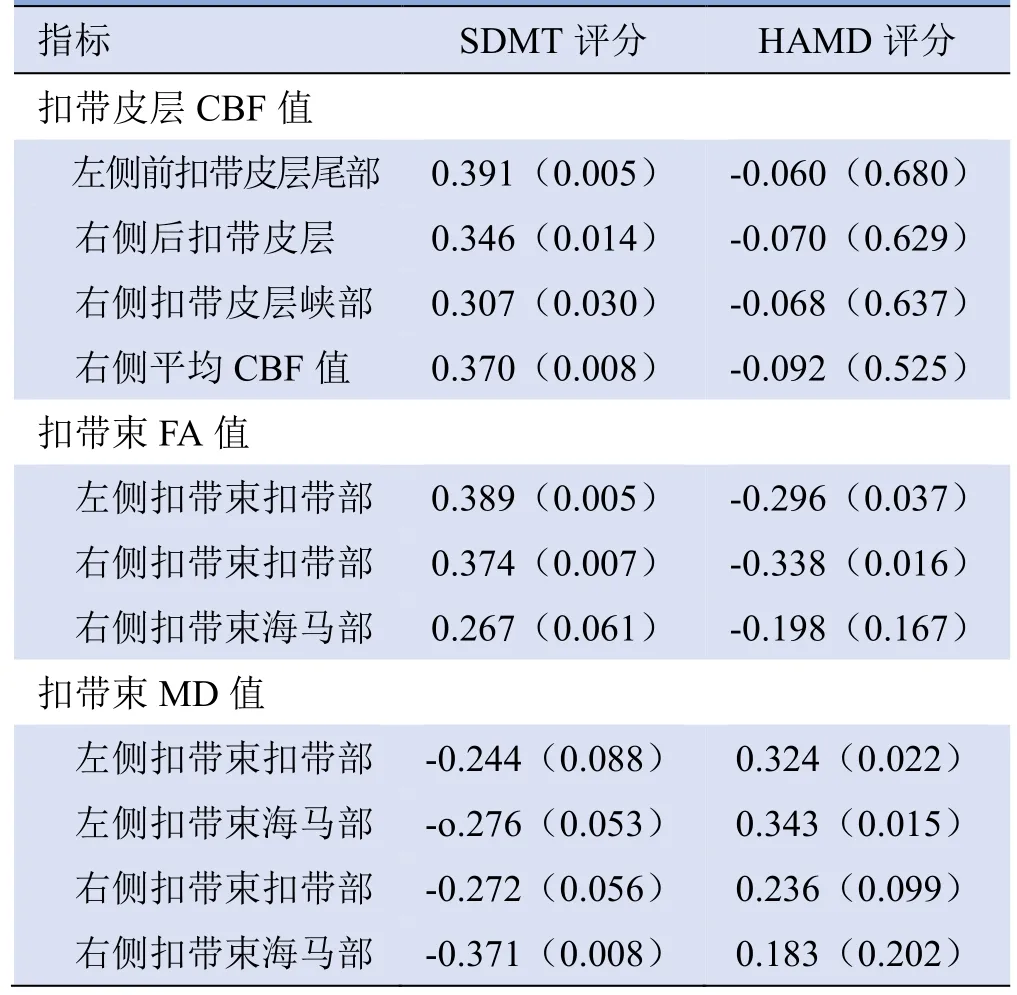
表3 RRMS 患者扣带皮层CBF 值、扣带束FA 值和MD值与SDMT 及HAMD 评分的相关性[r(P)]
3 讨论
扣带回是边缘系统的重要组成部分,MS 所致扣带回病变可导致患者出现认知障碍和情感障碍。本研究使用DTI 及3D-pCASL 分别评估RRMS 患者扣带束微观结构改变和扣带皮层亚区及整体的灌注情况,分析扣带回白质完整性和皮层灰质灌注改变,及其与神经心理学评分的相关性。
3.1 DTI 和3D-pCASL 技术 DTI 通过描述水分子在三维空间中的扩散特性反映微观组织结构的变化,对表征脑白质纤维束改变具有独特的优势,可用于观察颅内纤维束的完整性,其影像学指标如FA 和MD 对组织损伤十分敏感[9]。FA 以白质束平行纤维为基础,反映轴突髓磷脂含量;MD 则反映细胞的完整性[10]。脱髓鞘及轴突变性导致FA 减少、MD 增加。MS 患者DTI 异常与组织损伤相关[11]。3D-pCASL 是以动脉血作为示踪剂,无需静脉注射对比剂的MR 脑灌注成像,可定量检测脑血流量,在多种疾病中广泛应用[12]。3D-pCASL 能够敏感地检测脑血流动力学状态,反映脑内微血管的灌注情况,且受磁敏感伪影的影响较小。
3.2 RRMS 患者与对照组扣带束白质改变和扣带皮层灌注比较 本研究结果显示,MS 组患者扣带束FA 值明显降低、MD 值明显增高,提示RRMS 患者扣带束受微观病理损伤影响,与既往研究相符[13-14]。罗琦等[13]采用基于纤维束的空间统计方法发现MS 患者扣带束、穹窿和钩束的FA 值减低,MD 值增高。Kern 等[14]研究发现,扣带束、穹窿及钩束FA 值降低,并伴丘脑和海马体积减少。动物实验证实FA 值降低与白质微观结构破坏有关,可能预示髓鞘和轴突受损,表明白质纤维束的结构完整性和组织排列可能受到损伤[15]。MD 值升高则表明水分子在各方向上的平均扩散率升高。病理学研究发现,细胞间隙扩大的主要原因是轴索或髓鞘缺损,因而造成水分子扩散增加,表现为MD值升高[16]。Bartzokis 等[17]报道,扣带束具有较长的髓鞘发育周期,直到50 岁左右才发育成熟;而髓鞘化越晚的区域,由于少突胶质细胞较少,修复能力较差,因此更容易暴露于自由基和其他代谢性损害因素中,从而发生脱髓鞘病变。
既往研究发现,RRMS 患者早期未出现脑萎缩时即可出现全脑灰质灌注减低[18]。Hojjat 等[19]采用3DpCASL 对伴发认知障碍的RRMS患者进行全脑研究,发现双侧扣带皮层总体灌注减低。本研究在此基础上评估扣带皮层亚区及整体灌注改变,发现RRMS 患者左侧前扣带皮层尾部、右侧后扣带皮层及峡部CBF值明显减低,右侧扣带皮层平均CBF 值显著降低。大脑灰质灌注减少与神经元代谢功能障碍有关[18]。CBF 降低可能是维持神经激活对CBF 的自发和即时增加的脑血管反应性弥散性降低,这可能是MS 神经变性的潜在原因[20]。
3.3 RRMS 患者扣带回灰白质改变与认知及抑郁的相关性 本研究发现,SDMT 评分与EDSS 评分呈负相关,与Eizaguirre 等[21]及Motl 等[22]的研究结果一致,提示中枢神经系统的损害程度越重,患者残疾越重,认知功能越差。SDMT 主要评估注意力和信息处理速度。SDMT 可较好地区分MS 患者和健康对照组[23]。本研究结果表明,扣带束和扣带皮层受损与RRMS 患者注意力和信息处理速度下降有关。Keser 等[24]报道SDMT 评分与右侧扣带束FA 值及扣带皮层峡部皮层厚度具有显著相关性,结果出现差异考虑与样本选择及个体差异有关。使用偏相关,控制年龄、性别及受教育程度后发现,SDMT 评分与双侧扣带束的FA 值及MD 值仍然显著相关,但与扣带皮层灌注无相关性,推测是由于RRMS 患者认知与扣带回白质受损相关性较强。多发性硬化髓鞘和轴突受损,引起扣带束白质微结构改变,导致与认知和情感相关的皮质-皮质、皮质-皮质下失联络,引起起始和执行功能障碍,造成认知功能损害。Shen 等[25]研究发现,RRMS患者扣带回白质FA 值与HAMD 评分呈负相关,与本研究结果部分一致。本研究发现HAMD 评分不仅与双侧扣带回纤维束FA 值呈负相关,且与MD 值呈正相关。HAMD 评分主要评估患者的抑郁状态,而RRMS 患者扣带束与抑郁的相关性可能提示边缘系统中扣带纤维束功能与情绪有关。
本研究有一定的局限性:纳入的样本量较小,组间比较及相关分析的统计效能可能受样本量的限制;本研究性质为横向研究;研究采用的神经心理学量表较为单一。在后续研究中,本课题组将采用大样本纵向研究,联合采用多种MRI 技术及更加丰富的神经心理学量表研究RRMS 患者扣带回的改变。
总之,本研究使用DTI 及3D-pCASL 研究扣带回灰白质改变,发现RRMS 患者右侧扣带皮层灌注降低,扣带束FA 值降低、MD 值增高,其认知改变与扣带皮层灌注相关,而抑郁情况主要与患者扣带束白质微观结构异常相关。这可能阐释了扣带回的功能异质性,扣带回灰白质的功能差异。
