磁共振三维动脉自旋标记脑灌注成像在多系统萎缩C型患者中的应用
2020-02-10张秋奂王伟新刘明陈云翔李春龙王志群
张秋奂,王伟新,刘明,陈云翔,李春龙,王志群
北京中医药大学东方医院放射科,北京 100078; *通讯作者 王志群 wangzhiqun@126.com
多系统萎缩(multiple system atrophy,MSA)是一种罕见的、发展迅速的神经退行性疾病,累及锥体外系、锥体系、小脑、自主神经系统等部位,其病因尚未明确[1]。MSA 根据主要临床表现分为伴有帕金森症状的MSA-P 型和伴有小脑性共济失调症状的MSA-C 型[2]。在西方国家,MSA 患者中MSA-P 型较多;而在亚洲人口中,MSA-C 型所占比率更高[3-4]。由于常规MRI 序列对MSA 的诊断价值有限,已有研究将磁共振扩散张量成像(diffusion tensor imaging,DTI)及磁敏感加权成像(susceptibility weighted imaging,SWI)等技术应用于MSA 的诊断及鉴别诊断[5-6],而对于MSA脑血流量(cerebral blood flow,CBF)改变鲜有报道。近年发展的磁共振三维动脉自旋标记(threedimensional arterial spin labeling,3D-ASL)脑灌注成像无需注射对比剂即可完成脑血流灌注检查,具有无创、简便、快速等特点。本研究采用磁共振3DASL 脑灌注成像技术,探讨MSA-C 型患者CBF 与正常人的差异,以提高对MSA 发病机制和影像特点的认识。
1 资料与方法
1.1 研究对象 选取在北京中医药大学东方医院检查并经临床诊断为MSA-C 型的25 例患者,其中男15 例,女10 例;年龄45~71 岁。所有患者均经2 名神经内科医师参照Gilman 诊断及排除标准进行筛选[7],且能配合MRI 检查。选取年龄和性别与MSAC 型组相匹配的正常对照组21 例,均排除神经、脑血管及其他躯体疾病,颅脑MRI 检查未见明显病变,所有患者均签署知情同意书。
1.2 检查方法 采用GE Discovery MR 750 3.0T 扫描仪和8 通道头颈联合线圈进行MRI 检查。扫描序列:T1-FLAIR 和3D-ASL。T1-FLAIR 扫描参数:TR 2250 ms,TE 24 ms,层厚3.0 mm,层数46,视野24 cm×24 cm,矩阵288×192,激励次数1,带宽41.67 kHz,扫描时间2 min 55 s;3D-ASL 扫描参数:采用标记后延迟时间(post labeling delay time,PLD)2.0 s,PLD 2.0 s 扫描参数:TR 5003 ms,TE 11.1 ms,层厚3.0 mm,层数46,矩阵512×8,激励次数3 次,带宽62.5 kHz,扫描时间4 min 50 s。
1.3 图像后处理与分析 将采集得到的3D-ASL 原始图像传输至GE AW 4.6 后处理工作站,通过Functool 软件,选取3D-ASL 后处理模块,计算得到全脑CBF 图。在CBF 图上分别在额叶、颞叶、尾状核头、壳核、苍白球、背侧丘脑、小脑中脚、小脑下脚、小脑半球和脑桥区域选取感兴趣区(ROI),测得CBF 值,同时测量对侧镜像区域的CBF 值,为确保测量部位的准确性,将CBF 图与T1-FLAIR图像融合,由2 位有10 年以上工作经验的放射科医师进行绘制,每个位置测量3 次,取平均值(图1)。ROI 大小为50~100 mm2,MSA-C 型组及正常对照组所有人员所选ROI 尽量保持在相同层面,在各颅内区域位置尽可能保持一致。
1.4 统计学方法 采用SPSS 20.0 软件,比较MSAC 型组和正常对照组在PLD 2.0 s 时的双侧额叶、颞叶、尾状核头、壳核、苍白球、背侧丘脑、小脑中脚、小脑下脚、小脑半球及脑桥区域的CBF 值,对各组数据进行正态性分布检验,均采用独立样本t检验比较,若不服从正态分布,则采用非参数检验,P<0.05表示差异有统计学意义;对P<0.05 的脑区进行受试者工作特征(ROC)曲线分析CBF 对MSA-C 型的诊断价值,得到曲线下面积(AUC)以及对应的AUC值、敏感度和特异度。AUC<0.5 为无诊断价值,0.5~0.7表示诊断价值较低,0.7~0.9 表示诊断价值中等,>0.9表示诊断价值较高,计算出每个脑区的约登指数(约登指数=敏感度+特异度-1),寻找最高约登指数所对应的最佳诊断界值。
2 结果
2.1 两组各脑区CBF 值 在脑桥及双侧小脑中脚、小脑下脚、小脑半球区域,MSA-C 型组的CBF 值均小于正常对照组(P均<0.05);在双侧额叶、颞叶、壳核、苍白球、背侧丘脑和双侧尾状核头区域,两组CBF 值差异无统计学意义(表1)。
表1 两组各脑区脑血流量比较[ml/(100 g·min),±s]

表1 两组各脑区脑血流量比较[ml/(100 g·min),±s]
额叶 左侧 27.89±4.88 29.15±3.47 0.987 0.329 右侧 28.97±4.28 30.42±3.48 1.239 0.222 颞叶 左侧 34.13±6.79 35.68±5.59 0.839 0.406 右侧 34.61±6.60 37.32±5.87 1.460 0.151 尾状核头 左侧 53.24±7.93 52.21±8.21 0.431 0.669 右侧 51.79±7.11 51.79±7.76 0.002 0.999 苍白球 左侧 35.42±4.79 37.54±5.61 1.382 0.174 右侧 37.37±6.89 37.34±5.86 0.015 0.988 壳核 左侧 47.04±8.83 50.20±8.67 1.218 0.230 右侧 47.23±8.61 48.81±7.23 0.664 0.510 背侧丘脑 左侧 56.74±10.17 59.13±13.21 0.691 0.493 右侧 56.92±8.67 56.66±12.72 0.083 0.935 脑桥 34.76±6.47 43.24±7.23 4.196 <0.001 小脑中脚 左侧 35.66±7.37 40.61±5.75 2.503 0.016 右侧 35.15±5.20 39.84±5.56 2.947 0.005 小脑下脚 左侧 35.27±9.99 49.27±9.63 4.812 <0.001 右侧 35.79±8.75 48.99±9.40 4.925 <0.001 小脑半球 左侧 34.95±10.12 48.24±10.51 4.360 <0.001 右侧 34.77±10.33 49.21±10.25 4.737 <0.001
2.2 CBF 值对MSA-C 型诊断价值的ROC 曲线分析 对脑桥及双侧小脑中脚、小脑下脚、小脑半球等P<0.05 的脑区做ROC 曲线分析(表2、图2),脑桥、右侧小脑中脚、双侧小脑下脚及双侧小脑半球的AUC 均>0.7,具有中等诊断价值,左侧小脑中脚AUC>0.6,具有较低的诊断价值;右侧小脑下脚区域的AUC 及最佳界值的约登指数最高,当右侧小脑下脚CBF 诊断界值位于37.703 时,敏感度为72.0%,特异度为95.2%,AUC 为0.850,约登指数为0.672。
3 讨论
MSA 是一种少突胶质细胞α-突触核蛋白病,其发病率随着年龄的增长而上升,MSA-C 型较MSA-P型的平均发病年龄更早[8]。目前,MSA 的临床诊断和分型主要依据典型的临床表现和影像学改变。常用于MSA 诊断的颅脑MRI 征象主要有T2WI 上脑桥十字形增高影、壳核尾部低信号伴外侧缘裂隙状高信号以及壳核、脑桥、小脑萎缩等[9]。但关于其脑血流灌注改变国内外鲜有报道。本研究将3D-ASL 脑灌注成像技术用于观察分析MSA-C 型患者的全脑血流改变,发现了MSA-C 型患者脑血流减低的主要脑区,进而获取了敏感的影像学指标。

表2 CBF 对MSA-C 型诊断价值的ROC 曲线分析结果
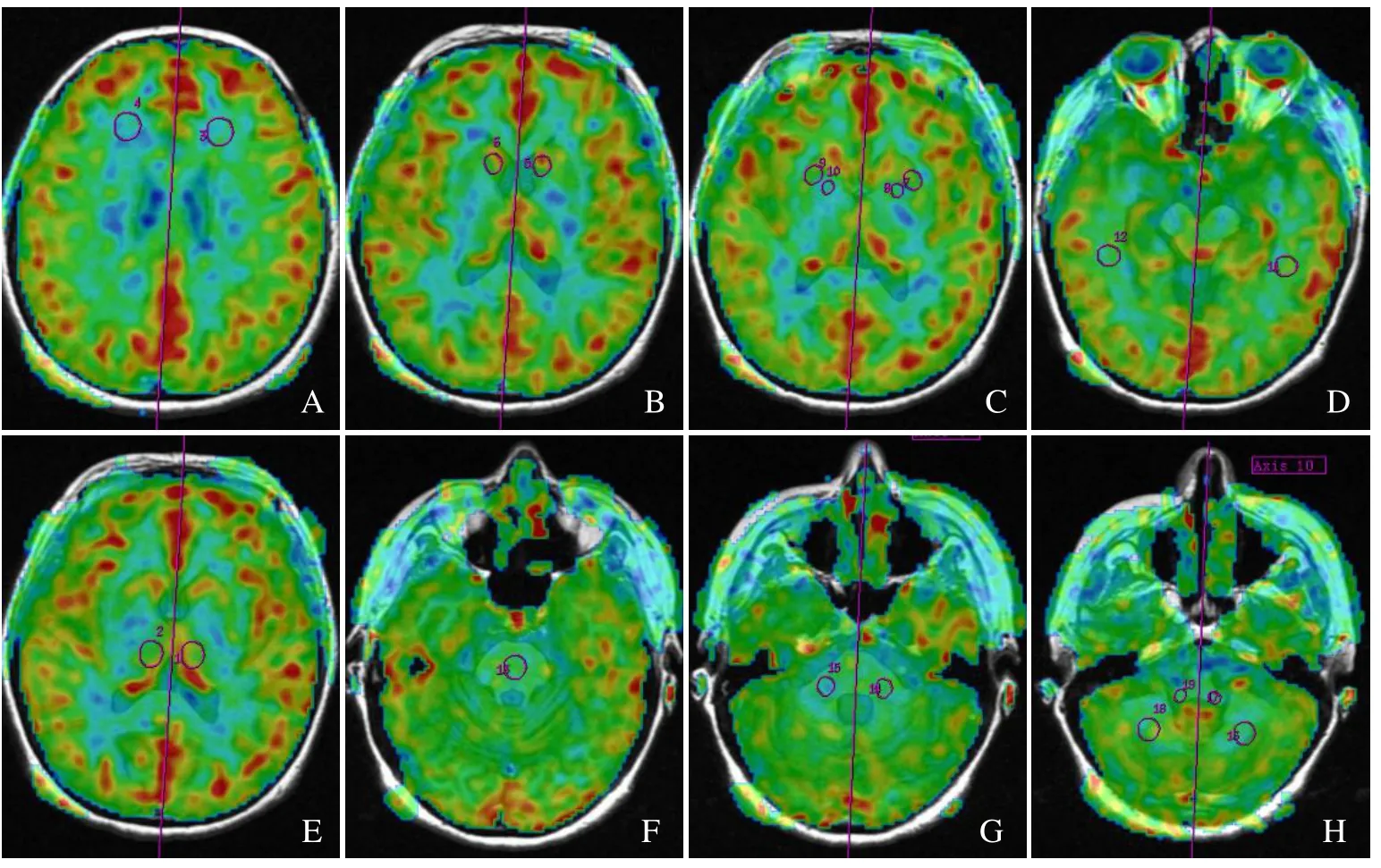
图1 全脑CBF 图与T1-FLAIR 图像融合后图像。女,45 岁,MSA-C 型。选取双侧额叶(A)、双侧尾状核头(B)、双侧壳核和苍白球(C)、双侧颞叶(D)、双侧背侧丘脑(E)、脑桥(F)、双侧小脑中脚(G)、双侧小脑下脚和小脑半球(H)选取感兴趣区(ROI),使用对称轴镜像技术自动选取对侧ROI,测量各脑区的左、右两侧CBF 值

图2 CBF 对MSA-C 型诊断价值的ROC 曲线
本研究中,MSA-C 型组患者与正常对照组CBF值对比结果显示,在脑桥及双侧小脑中脚、小脑下脚、小脑半球区域,MSA-C 型组CBF 值均小于正常对照组(P均<0.05),提示MSA-C 型患者CBF 减少区域主要位于椎基底动脉系统供血的后循环区域,而大脑前、中动脉供血区域CBF 受累不明显,与MSA-C 型的α-突触核蛋白侵犯神经病理改变区域一致[10],即小脑、小脑中脚、桥脑以及橄榄核萎缩。推测在MSAC 型患者中,由于多种因素导致特定的后循环区域脑血流灌注减低,从而诱使α-突触核蛋白早期沉淀在小脑及脑干区域,在少突胶质细胞胞质内折叠并形成包涵体,诱发氧化应激反应,并导致胶质神经元细胞髓鞘变性、脱失,最终发生脑萎缩。
本研究还分析了双侧额叶、颞叶、尾状核、壳核区域、苍白球及背侧丘脑区域,两组CBF 值差异无统计学意义,推测可能原因为:由于选取的MSA-C型患者病程相对较短,病情较轻,少突胶质细胞包涵体主要集中在小脑、脑桥和延髓等处,尚未累及基底核和其他脑区而引起改变。Brettschneider 等[11]针对于MSA-C 型患者进行病理分析,其研究发现,该类型患者α-突触核蛋白沉积在病理上分4 个阶段,其中第1 个阶段即是脑桥、小脑,小脑下脚和小脑中脚等区域,随着病变发展,病例改变逐步沉积在基底节、额颞叶等全脑其他区域。
针对脑桥及双侧小脑中脚、小脑下脚、小脑半球等脑区的ROC 曲线分析发现,应用这些脑区的CBF值诊断MSA-C 型均具有较好的敏感性和特异性。其中,右侧小脑下脚区域的CBF 值最为敏感,采用最佳诊断界值37.703,敏感度可达72.0%,特异度为95.2%,AUC 为0.850,约登指数为0.672。既往关于MSA 的影像学研究多采用脑结构像进行鉴别诊断,如采用十字征评估MSA-C 型和正常对照,结果发现特异度为97%,而敏感度仅为50%[12]。因此,右侧小脑下脚CBF 值在MSA-C 型患者的诊断和鉴别方面具有潜在价值。
关于MSA 的影像学研究已有较多报道[12],包括采用基于体素的形态学分析MSA 的结构改变,结果发现幕下脑区的广泛脑萎缩;采用DTI 分析脑白质微结构损伤,包括部分各向异性、平均扩散系数、纵向扩散系数及轴向扩散系数等。何冠勇等[13]利用DTI 发现MSA-C 型患者中小脑中脚、小脑下脚及锥体束的部分各向异性值和纤维条数均较正常对照组显著降低。研究者应用定量磁敏感加权成像发现MSA 患者基底节区、小脑存在明显的铁沉积改变[12]。这些研究从结构、白质、代谢等不同角度分析了MSA 的影像学特征,然而目前国内外鲜有关于脑血流改变的报道。3D-ASL 技术利用自身动脉血中的水分子作为内源性示踪剂,既不需要注射外源性对比剂,也无需改变自身血液动力学状态,即可获得颅内血流灌注情况[14-15]。目前,3D-ASL 脑灌注技术已广泛应用于肿瘤分级[16]和脑缺血病变[17]等方面。本研究尝试采用3D-ASL成像分析MSA 的血流改变,使用快速自旋回波的螺旋K 空间采集技术,克服了磁敏感伪影的干扰,很大程度上提高了影像质量[18]。由于3D-ASL 脑灌注技术可以较早地反映脑血流灌注异常,从而对于MSA 的发病机制及早期诊断有了更加深入的认识和理解。
本研究的局限性:①病例样本量相对偏少;②在不同患者各脑区图像的ROI 选取时,只能尽可能采用相同层面和大小的ROI,测量的误差可能会有一些影响;③选用不同PLD 时间可能有助于更深入地理解MSA 脑血流改变的动态情况,考虑到患者的检查时间,本研究仅选择常规的PLD 2.0 s 进行分析,今后将不断改进方法,并采用不同PLD 时间分析脑血流差异,从而提高准确度。
总之,本文采用3D-ASL 技术评价MSA-C 型患者的CBF,发现MSA-C 型患者颅内血流灌注较正常对照组存在显著差异,在脑桥及双侧小脑中脚、小脑下脚、小脑半球区域脑血流明显减低,应用右侧小脑下脚区域脑血流值具有重要的鉴别诊断价值,有助于为临床早期诊断提供重要依据。
