新老窖池黄水的差异性及静置培养对其影响
2020-02-10张会敏孟雅静王艳丽李安军刘国英袁志强邢新会
张会敏,孟雅静,王艳丽,李安军,刘国英,袁志强,张 严,邢新会
(1.安徽省固态发酵工程技术研究中心,安徽 亳州 236820;2.清华大学化工系,北京 100084)
中国浓香型白酒发酵是重要的微生物发酵研究领域,老窖池窖泥丰富的菌群对提高白酒发酵质量具有重要作用。目前,很多研究着眼于不同窖龄的窖泥菌群组成差异[1-4]。已知,随着窖龄增加,窖泥菌群丰度增加,窖泥逐渐老熟。窖泥的老熟本质上是窖泥菌群的老熟,窖泥菌群老熟过程中,受酒醅菌群的影响,即“万年糟”的作用。Wang Xueshan等[5]发现酒醅中的厌氧菌主要来自窖泥,即酒醅菌群也受窖泥菌群的影响。窖泥菌群和酒醅菌群具有相互影响的关系,黄水对维系两个固体菌群的相互关系具有重要作用。黄水又称黄浆水,是白酒发酵过程中原材料经微生物分解代谢形成的游离水,其与各种有机物和微生物一起沉降于窖池底部。黄水被认为含有窖池发酵过程中驯化的所有微生物菌种[6],一方面,黄水对窖泥的影响类似于降雨/灌溉对土壤的影响,黄水菌群随黄水渗入窖泥,对窖泥菌群产生影响;另一方面,窖泥菌群中带有鞭毛的厌氧菌随黄水游弋到酒醅中影响酒醅菌群,如梭菌、瘤菌等。因黄水又被称为“液体窖泥”,是“万年糟”作用的执行者。
目前,黄水菌群的研究方法有传统的纯化培养方法、非培养的聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)方法和磷脂分析法[7-9]。韩永胜等[10]通过纯培养方法发现,随着窖龄增加,黄水的总酸、总酯等有机物含量和微生物数量有增加趋势。王传荣等[11]进一步通过纯化培养方法发现黄水中的优势菌群为乳酸菌、丁酸菌和己酸菌。李可等[7]通过纯培养并构建克隆文库的方法发现黄水中的优势菌群为梭菌属、乳酸菌属和沙雷氏菌属,并检测到了甲烷菌的存在。Li Hui等[8]通过非培养的PCR-DGGE方法,发现黄水中的菌群组成主要有乳酸杆菌(Lactobacillus)、梭菌属(Clostridium)和沉积菌属(Sedimentibacter)。外,醋酸杆菌属(A c e t o b a c t e r)、蛋白杆菌属(Proteiniphilum)、喜热菌属(Caloramator)和甲烷菌也在黄水中检测到[8-9]。而目前传统培养方法得到的结果为可以培养的菌属,PCR-DGGE方法也不能给出菌属的具体定量结果。因,基于自然界中未知菌/未培养菌占多数的情况[12],需要相对更准确的免培养方法全面解析黄水中的菌群组成。已知Clostridium、Sedimentibacter、Proteiniphilum和Caloramator是老窖泥中常见的厌氧菌属,而甲烷菌的存在被认为是浓香型窖泥老熟的标志[13]。 可知,黄水菌群中含有老窖泥中典型的厌氧菌。与黄水相比,窖泥给菌群提供了一个相对封闭、稳定、厌氧的生存环境。已知窖泥菌多数为厌氧菌[4],因,黄水菌群中的厌氧菌有可能对窖泥菌群的老熟起重要作用。
1 材料与方法
1.1 材料与试剂
土壤DNA提取试剂盒(D5625) 美国Omega Bio公司;AP-GX-50凝胶回收试剂盒 美国Axygen 公司;其他试剂为国产分析纯。
1.2 仪器与设备
1.3 方法
2018年10月,选取两组窖龄不同而发酵工艺相同的新老窖池,发酵结束时抽取黄水本。取6 个新窖池(窖龄6 a)新鲜黄水本,标记为YN-1~YN-6;6 个老窖池(窖龄≥50 a)新鲜黄水本,标记为YO-1~YO-6。另外取3 个老窖池黄水本封闭静置培养5 个月,标记为YO5-1~YO5-3;另外取3 个新窖池黄水本封闭静置培养5 个月,标记为YN5-1~YN5-3。以上18 个黄水本用于提取基因组后高通量测序。
1.3.2 理化性质分析
采用紫外分光光度计法检测铵态氮含量;采用酸碱中和法测定酸度;采用标准葡萄糖液反滴定法检测淀粉和还原糖含量[14];采用GB 11893ü 1989《水质 总磷的测定》钼酸铵分光光度法检测黄水中的总磷。
KH2PO4(0.02 mol/L),柱流速0.1 mL/min,检测波长208 nm,柱箱温度30 ℃。
1.3.3 DNA提取与Illumina高通量测序
1.3.4 测序数据处理与统计学分析
首先将原始序列优化得到用于后续分析的优质序列。即:去掉长度小于150 bp或者大于300 bp、模糊碱基数大于1、同聚碱基数目大于8、引物错配大于1 bp的序列(QIIME,v1.8.0);双向拼接(FLASH软件v1.2.7)序列,剔除嵌合体(USEARCH,v5.2.236)序列。UCLUST聚类(97%相似度)优质序列得到各可操作分类单元(operational taxonomic units,OTU),认定各OTU中丰度最高的序列为其代表序列。在80%可信度水平,使用Silva数据库(Release132)注释各代表序列即为代表OTU的注释结果,并形成OTU列表。去除OTU列表中序列数目少于总测序量0.001%的OTU。然后将OTU列表进行100 次抽平,取平均,对取平均后的序列数进行四舍五入取整,得到新的OTU列表。对抽平取后的OTU列表,使用Qiime软件(v1.8.0)计其Shannon指数、Chao 1指数等微生物群落多性指数。使用Qiime软件,对Weighted UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件(R3.3.2)进行可视化。黄水本理化因子之间的差异显著性分析通过SPSS(24.0)方差分析(ANOVA)实现。黄水理化因子与其菌群组成之间的冗余分析(redundancy analysis,RDA)通过Canoco 5实现。
2 结果与分析
2.1 黄水本的理化性质
新老窖池的新鲜黄水相比较,两者的淀粉、还原糖、丙酸、乳酸、乙醇含量不具有显著性差异,说明新老窖池发酵粮食(淀粉)产生乙醇的主体过程无差异。如表1所示,与新窖池的新鲜黄水相比,老窖池的新鲜黄水中,丁酸、己酸、戊酸、乙酸、铵态氮的值偏高,而酸度略低。说明:1)与新窖池相比,老窖池发酵过程中代谢形成的各种酸等风味物质较丰富,可能与老窖池发酵过程中己酸菌与甲烷菌之间存在良性的氢传递,更容易促进己酸和丁酸等风味物质的合成有关[15]; 2)老窖池发酵过程中,铵态氮含量比较高,可能与老窖池中降解氨基酸的菌含量比较高有关,比如胺杆菌属(Aminobacterium);3)老窖池的新鲜黄水酸度略低,一方面与其中铵态氮含量较高有关,另一方面与乳酸含量略低(尽管两者不具有显著性差异)有关,因为几种有机酸中,乳酸的含量最大,且其pKa值最小,其对酸度的贡献最大。
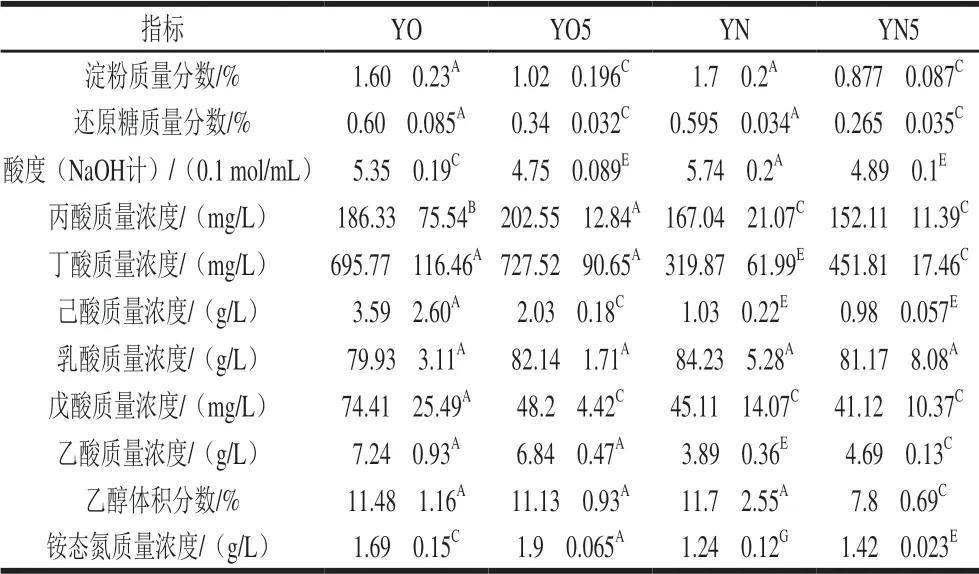
表 1 4 组黄水样本的理化性质Table 1 Physicochemical properties of 4 groups of HS samples
新老窖池黄水经过5 个月的封闭静置培养后,丙酸、乳酸值无显著变化,淀粉、还原糖、酸度值不同程度地降低,而铵态氮有所增加。说明静置培养过程黄水中的菌群生长消耗了其中的淀粉、还原糖,同时生成了铵态氮(降解氨基酸的菌),如Aminobacterium[16-18]。最终黄水酸度有所下降。新老窖池黄水培养后的不同之处在于:老窖池黄水经培养后,己酸和戊酸的值显著降低;新窖池黄水培养后乙醇含量显著降低,丁酸和乙酸的值显著增加。目前已知,在窖泥中存在以乙醇[19-20]和乳酸[21]为前体生成丁酸/己酸的菌种。新窖池黄水经过封闭静置培养后,乙醇减少,同时丁酸和乙酸增加,很可能与其中存在以乙醇为前体的丁酸/己酸菌的代谢功能有关。相比较而言,老窖池黄水中的丁酸/己酸菌在封闭静置培养期间似乎并不活跃。
2.2 黄水原核微生物群落的α多性
通过Illumina MiSeq高通量测序,得到673 738 条平均长度为207 bp的优质序列,平均30 182~53 152 条/本。对所有本10 次抽平(subsample)取平均四舍五入后,得到序列26 931~26 981 条/本,进行后续分析。OTU聚类(97%相似度)得到4 886 个OTU,平均77~580 个/本。每个本的测序覆盖率大于99%,说明测序数目足够,测序序列可以代表其菌群组成。得到注释(门、纲、目、科、属)的序列大于99.9%,无法得到注释的序列仅12 条序列,说明对窖泥中大量的未培养菌也充分实现了系统分类。如表2所示,新老窖池的新鲜黄水相比较,两者微生物群落的OTU数目、Shannon指数和Chao 1指数都不具有显著性差异,经过封闭静置培养5 个月后,3 个微生物群落参数值均显著升高,说明静置培养后黄水中的菌群丰度和多性增加。

表 2 4 组黄水样本的细菌群落丰度和多样性参数Table 2 Bacterial community richness and diversity indices of 4 groups of HS samples
2.3 黄水原核微生物群落的β多性

图 1 4 组黄水样本中15 个优势门的相对丰度Fig. 1 Relative abundances of the 15 dominant phyla in 4 groups of HS samples
对OTU注释,总共得到35 个门,其中32 个细菌门,3 个古菌门。在门的水平上,在新老窖池新鲜黄水中,厚壁菌门(Firmicutes)为绝对优势菌门,分别占新老窖池新鲜黄水本的98.46%和95.72%。将相对丰度超过0.1%的门定义为优势菌门(图1)。除Firmicutes外,其余4 个优势菌门在新老窖池新鲜黄水中的相对丰度依次为:变形菌门(Proteobacteria,1.0%和2.0%)、放线菌(Actinobacteria,0.11%和1.0%)、拟杆菌门(Bacteroidetes,0.1%和0.36%)和绿弯菌门(Chloroflexi,0.03%和0.45%)。Firmicutes在黄水中的绝对优势情况也存在于窖泥中[1-2],但在黄水中占的比例更大。
经过封闭静置培养5 个月后,新老窖池的黄水中的菌群组成发生变化。新老窖池黄水中Firmicutes的相对丰度分别下降为63.14%和79.59%;Proteobacteria在两者中的丰度分别大幅上升至20.86%和12.88%;Bacteroidetes则分别上升至6.21%和1.74%;Actinobacteria分别上升至0.63%和2.79%;Chloroflexi分别上升至1.32%和0.47%。外,经过静置培养后,互养菌门(Synergistetes)在老窖池黄水中的相对丰度上升幅度很大(由0.06%变为2.11%),而在新窖池黄水中变化幅度相对较小(由0.02%变为0.46%)。通过静置培养,黄水菌群与窖泥菌群中的组成更接近了,比如Firmicutes与窖泥中的菌群组成更接近。
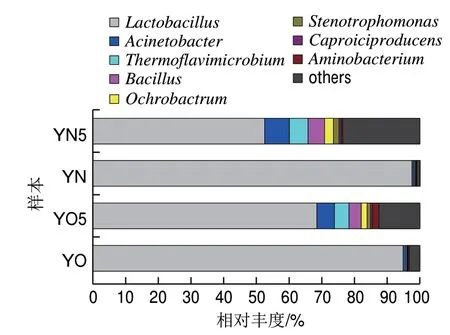
图 2 4 组黄水样本中8 个优势属的相对丰度Fig. 2 Relative abundances of the 8 dominant genera in 4 groups of HS

图 3 18 个黄水样本菌群Weighted Unifrac Distance聚类图Fig. 3 Cluster analysis of the 18 HS samples based on Weighted Unifrac Distance
对O T U 注释,共得到6 6 4 个属,注释度为97.81%,其余序列只能不同程度地注释到门、纲、目、科等级别。注释度之所以如高,因为黄水本中的属种非常集中,Lactobacillus占绝对优势。除Lactobacillus,黄水本中相对丰度超过1%的优势菌属还有:不动杆菌属(Acinetobacter)、双歧黄色高温菌属(Thermoflavimicrobium)、芽孢杆菌属(Bacillus)、苍白杆菌属(Ochrobactrum)、寡养单胞菌属(Stenotrophomonas)、产己酸菌属(Caproiciproducens)和Aminobacterium(图2)。
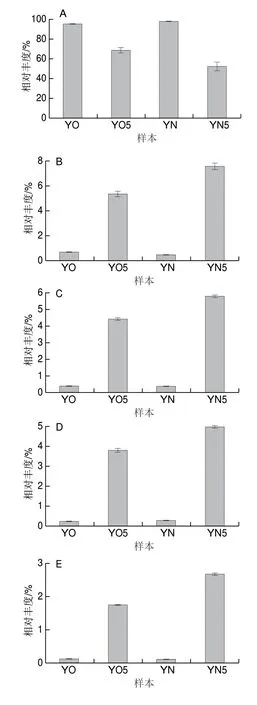
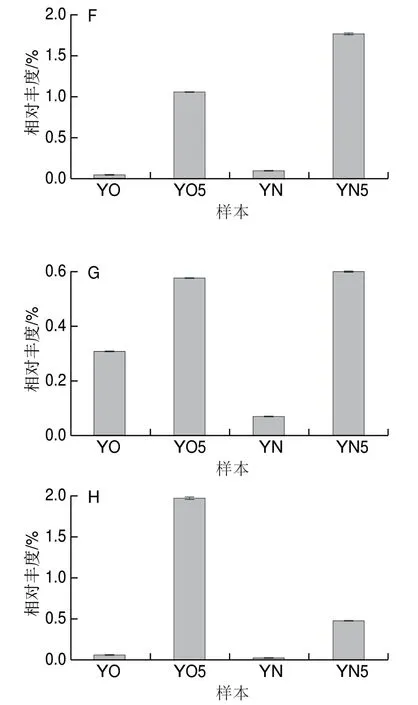
图 4 4 组黄水样本中8 个优势菌属的相对丰度 Fig. 4 Relative abundance of the 8 dominant genera in 4 groups of HS samples
深入分析黄水中优势菌属在封闭静置培养前后的变化(图4)可知,经过封闭静置培养后,新老窖池黄水本中的绝对优势菌属Lactobacillus的相对丰度分别降低至52.5%和68.55%。推测很可能与封闭静置培养条件下的缺氧环境不利于兼性厌氧菌Lactobacillus的增殖有一定关系。外,黄水中的其余7 个优势菌属的相对丰度都显著性增加。
除上述提到的Caproiciproducens和Aminobacterium,窖泥中还存在很多功能菌[1,3], 如棒状杆菌(Caldicoprobacter)[31]、贪铜菌属(Cupriavidus)[32]、 甲烷囊菌属(M e t h a n o c u l l e u s)[2]、瘤梭菌(Ruminiclostridium)[33]、Sedimentibacter[2]和互营单胞菌属(Syntrophomonas)[2],其对窖泥的老熟具有很重要的作用。图5为这些菌属在4 组黄水中的相对丰度。经过封闭静置培养后,6 株菌在新老窖池黄水中的相对丰度都有不同程度的升高。与新窖池黄水相比,老窖池黄水经过封闭静置培养Methanoculleus、Sedimentibacter、Syntrophomonas的相对丰度增加更多。说明黄水中含有大量促进窖泥老熟的菌种,且黄水可以提供这些菌种在厌氧条件下生长所需要的营养物质。

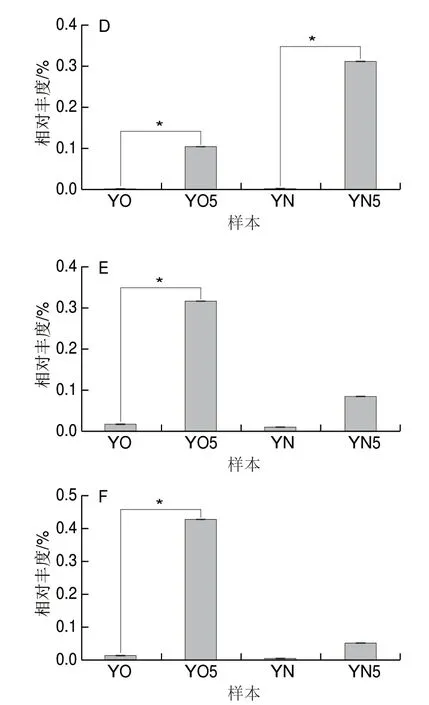
图 5 6 个窖泥中的优势菌属在4 组黄水样本中的相对丰度Fig. 5 Relative abundance of 6 PM-dominant genera in 4 groups of HS samples
2.4 黄水本理化性质与菌群之间的RDA

图 6 黄水的理化因子与其菌群之间的RDAFig. 6 Redundancy analysis of the physicochemical factors and HS prokaryotic communities
如图6所示,2 个主成分的总解释度为87.49%,但是两个坐标轴上的解释度相差悬殊,主要集中在RDA1(86.16%)。以横轴为分界点,封闭静置培养前的新鲜黄水本集中在左侧,静置培养后的黄水本散布在右侧。由也可得知,与窖池的窖龄相比,是否静置培养对黄水本的菌群组成影响更大,与图3结论一致。图6中还原糖、淀粉、酸度和乙醇与新鲜黄水本菌群呈强烈正相关,铵态氮与静置培养黄水呈正相关,表明新鲜黄水中还原糖、淀粉、酸度和乙醇的值偏高,静置培养后的黄水铵态氮升高。使用互动向前选择程序验收11 个理化因子,发现参数还原糖的解释度最高65%(P<0.01)。外,其余理化指标的贡献率都不具有显著性,指标(解释度)分别为:己酸(6.2%)、乳酸(5.9%)、铵态氮(2.7%)、乙酸(2.2%)、丁酸(1.7%)、酸度(1.4%)、淀粉(1.2%)、乙醇(0.9%)、戊酸(0.3%)、丙酸(0.2%)。
3 讨 论
新老窖池新鲜黄水中淀粉、还原糖、丙酸、乳酸、乙醇的含量不具有显著性差异。与新窖池相比,老窖池新鲜黄水中,即老窖池酒醅发酵过程中产生的丁酸、己酸、戊酸、乙酸等风味物质含量较丰富,同时产生的铵态氮的含量较高。己酸是生成浓香型白酒特色风味物质己酸乙酯的前体物质,与“窖池越老,酒质越好”的结论一致。铵态氮是菌群生长的氮源,老窖池黄水中铵态氮含量高与老窖池中菌群含量更丰富有关系。
本研究通过高通量测序分析黄水中的原核菌群组成,证明静置培养有利于窖泥老熟菌属的增加,尤其是老黄水中,窖泥老熟菌属的增加更明显,比如Aminobacterium相对丰度从0.47%升到1.97%,已知优质老窖泥中Aminobacterium相对丰度显著高于新窖泥[4]。Methanoculleus相对丰度从接近于0%上升到0.24%,已知新窖泥中的Methanoculleus相对丰度为0.16%,25 a窖龄窖泥中的相对丰度上升到1.56%[2]。静置培养后的老黄水中Methanoculleus的相对丰度尽管没有达到老窖泥中的丰度,但说明黄水中天然有促进窖泥老熟的菌种存在,为将来通过自然培养黄水改良窖泥提供了一种思路。而考虑到黄水环境与窖泥环境的差异,需要进一步摸索适宜黄水中窖泥老熟菌种生存繁殖的条件。实现对黄水的自然培养并应用于促进窖泥老熟的养护,不但有利于促进窖泥老熟,对黄水的处理也有重要意义。因为黄水的化学需氧量值很高,排放会远超过国家允许的废水排放指标[34]。目前,有研究直接将黄水蒸馏制成低度黄 水酒[35],但只是将黄水中的乙醇进行回收利用;有研究通过超临界CO2萃取技术从黄水中提取风味物质[36],但成本太高。外,柴玉强等[37]提出将黄水进行次发酵再蒸馏酒的方法。本研究尝试了直接静置厌氧培养黄水的方法,可能解决黄水的处理问题,将黄水变废为宝,用于窖泥改良,将来还需要对黄水作为“液体窖泥”的培养条件进行进一步研究。
