焦磷酸钠对氧化猪肉肌原纤维蛋白的谷氨酰胺转移酶交联反应及凝胶性能的影响
2020-02-10耿晓茜张月姝赵虹霏李春强
孙 悦,耿晓茜,张月姝,王 石,石 蕊,赵虹霏,李春强
(沈阳农业大学食品学院,辽宁 沈阳 110866)
微生物谷氨酰胺转移酶( m i c r o b i a l transglutaminase,MTG)在肉制品中应用广泛,可以催化谷氨酰胺与赖氨酸残基发生酰基转移反应使蛋白之间交联,形成高黏性的凝胶网络结构,以稳定的包裹肉制品中的水分和脂肪球,改善肉制品的凝胶性能。MTG催化交联反应除了受温度、pH值、金属离子等因素影响外,还与可利用的谷氨酰胺和赖氨酸残基含量密切相关[1], 肌原纤维蛋白由于含有丰富且充分暴露的可利用的氨基酸底物[2],是良好的MTG交联底物。然而,肌肉蛋白富含脂质、金属离子和血红素类化合物等促氧化物质,在冷冻、贮藏、运输和加工过程中易被氧化,导致肌原纤维蛋白结构发生变化[3]。李春强[4]研究表明,轻度氧化引起的肌原纤维蛋白结构展开,可暴露更多的谷氨酰胺和赖氨酸残基,从而促进MTG交联,而深度氧化造成的氨基酸修饰以及蛋白聚集,会遮蔽MTG底物氨基酸,从而抑制MTG交联。由于磷酸盐是肉制品中常用的食品添加剂,且可引起肌球蛋白构象、活性氨基酸残基和肌动球蛋白解离等变化[5],而且还会改变肌原纤维蛋白的氧化模式[6],故磷酸盐可能会影响MTG交联反应,进而改变蛋白凝胶特性。本实验以猪外脊肉提取的肌原纤维蛋白为研究对象,以羟自由基氧化系统为模型,研究焦磷酸钠(sodium pyrophosphate,TSPP)对天然和氧化肌原纤维蛋白的MTG交联程度和蛋白凝胶性能的影响,以期阐明TSPP、氧化、MTG交联和蛋白凝胶性能之间的关系,为MTG及其他相似的交联酶类在肉制品中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
冷鲜猪外脊肉购于沈阳兴隆大家庭超市,猪品种为大白猪,其具有体型大、繁殖能力强、屠宰率高等特点。
M T G(1 0 0 U/g) 江苏一鸣生物制药有限公司;水溶性V E(T r o l o x) 上海麦克林生化科技有限公司;H2O2、T S P P、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt, E D T A-N a2) 国药集团化学试剂有限公司;哌嗪-N,N’-(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES)、β-巯基乙醇(β-mercaptoethanol,β-ME) 美国Genview生化试剂公司;没食子酸丙酯(propyl gallate,PG) 上海瑞永生物科技有限公司;N-乙基马来酰亚胺(N-ethylmaleimide,NEM) 百灵威科技有限公司。
1.2 仪器与设备
AUY120电子分析天平 日本岛津公司;Cary 50紫外-可见光分光光度计 美国Varian公司;5804R高速冷冻离心机 德国Eppendorf公司;GE-250电泳仪、AI600(UV)超灵敏多功能成像仪 美国GE公司;DHR-1流变仪 美国TA公司;CT3 10K质构分析仪 美国Brookfield公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参考Park等[7]的方法,并加以调整。在最后一次离心前,用3 层100 目绢布过滤,并将其pH值调到6.25,离心所得沉淀即为肌原纤维蛋白。提取出的肌原纤维蛋白存于冰盒中(0 ℃),并在18 h内用完。蛋白含量测定采用双缩脲法。
1.3.2 TSPP处理及氧化模型的构建
参考Xiong Youling等[8]的方法,将30 mg/mL肌原纤维蛋白分散于1 mmol/L TSPP、2 mmol/L MgCl2、 0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25),处理2 h。添加氧化剂(0.01 mmol/L FeC13,0.1 mmol/L抗坏血酸,1、5、10、20 mmol/L H2O2)于4 ℃氧化2 h。通过添加PG-Trolox-EDTA-Na2(1 mmol/L)终止氧化反应。未加氧化剂但含有PG-Trolox-EDTA-Na2的蛋白溶液作为对照。
1.3.3 MTG处理
在氧化和未氧化的肌原纤维蛋白中加入MTG(酶∶底物=1∶20)于4 ℃交联2 h,用0.1% NEM终止反应。
1.3.4 羰基含量测定
参考Levine等[9]的方法采用2,4-二硝基苯肼法测定羰基含量。处理后的样品在波长370 nm处测定吸光度(羰基含量),于波长280 nm处测定吸光度(蛋白含量)。用最大吸光度以消光系数为22 000 L/(mol•cm)计算每克蛋白质羰基含量。
1.3.5 巯基含量测定
按照Liu Gang等[10]的方法测定。蛋白溶液与5,5’-二硫代双(2-硝基苯甲酸)反应,在波长412 nm处测定吸光度,巯基含量根据摩尔消光系数13 600 L/(molg cm)计算。
1.3.6 自由氨基含量测定
MTG交联前后的样品分别与2,4,6-三硝基苯磺酸反应测定自由氨基含量[11]。同时以一系列浓度的L-亮氨酸在相同条件下制作标准曲线,样品自由氨基含量依据所绘标准曲线确定。
1.3.7 SDS-PAGE的测定
参考Park等[7]的方法,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定。分离胶12%、浓缩胶4%,还原剂为β-ME,用GE的AI600超灵敏多功能成像仪成像及分析。
1.3.8 动态流变学测定
使用流变仪测定肌原纤维蛋白在程序升温过程中凝胶形成所产生的力学变化[12]。30 mg/mL肌原纤维蛋白溶液(800h g,1 min,4 ℃去除气泡)均匀涂布于流变仪的下平板上,将40 mm上平板降至1 mm时去除其周围多余的样品,并在边缘涂上硅油以防水分流失。采用振荡模式以1 ℃/min的速率进行升温(20→75 ℃)。振荡频率为0.1 Hz,控制最大应力为0.02。凝胶性能通过储存模量(G’)进行评价。
1.3.9 凝胶强度测定
取5 g 30 mg/mL的蛋白液,放入15 mmh 40 mm密封的玻璃瓶中,保持胶面水平放入水浴锅中,以 1.2 ℃/min的升温速率,从20 ℃加热至75 ℃。达到75 ℃后,立即将样品放入冰水中冷却,并置于4 ℃过夜。凝胶强度测定前,将凝胶样品放在室温下平衡1 h,利用美国Brookfield CT3质构仪测定凝胶强度。采用TA5探头,测试速率为0.3 mm/s。
1.3.10 持水性测定
将小玻璃瓶中的凝胶转移至离心管中,记录原始凝胶质量。然后10 000h g离心15 min,去除上清液,将离心管倒置于铺有滤纸的桌面上,10 min后称量离心后凝胶沉淀质量。持水性按下式计算:

式中:m0为离心管质量/g;m1为离心前离心管和凝胶质量/g;m2为离心后离心管和凝胶质量/g。
1.4 数据统计分析
本实验所有数据均为3 次重复的平均值。数据处理使用Statistix 9软件进行方差分析和显著性分析(LSD法),不同显著性数据用不同字母标记。
2 结果与分析
2.1 TSPP对肌原纤维蛋白氧化程度的影响
2.1.1 羰基含量分析

图 1 TSPP对肌原纤维蛋白羰基含量的影响Fig. 1 Effect of TSPP on carbonyl content of myofibrillar protein
当肌原纤维蛋白暴露于氧化环境时,蛋白中许多氨基酸残基的侧链易被修饰,并且发生肽键裂解,导致羰基化合物的产生[13],因此,羰基是蛋白质氧化的标志性产物。由图1可知,未氧化肌原纤维蛋白的羰基含量为1.51 μmol/g,此结果与前期报道相近[10]。蛋白质羰基含量与H2O2浓度呈正相关,随着H2O2浓度的增加,羰基含量显著增加(P<0.05)。当H2O2浓度为20 mmol/L时,羰基含量比未氧化样品增加60.07%。
经+TSPP所有样品的羰基含量均低于-TSPP样品,特别当H2O2溶液浓度为1~10 mmol/L时,+TSPP样品的羰基含量显著低于-TSPP样品。总体来看,随着H2O2溶液浓度的增加,+TSPP样品增幅稍缓于-TSPP样品。这与 陆玉芹[14]和张杰等[15]的研究结果相符,可能是由于TSPP螯合肌原纤维蛋白氧化体系中促氧化的金属离子,从而抑制肌原纤维蛋白氧化。
2.1.2 巯基含量分析

图 2 TSPP对肌原纤维蛋白巯基含量的影响Fig. 2 Effect of TSPP on sulfhydryl group content of myofibrillar protein
半胱氨酸残基中含有大量的巯基,这些巯基很容易受到羟自由基的攻击而转化成分子内或分子间的二硫键[16]。 因此,巯基含量下降是评估蛋白质氧化程度的重要依据。如图2所示,无论是否添加TSPP,随着H2O2溶液浓度的增加,巯基含量均呈现下降趋势,当H2O2溶液浓度大于10 mmol/L时,巯基含量显著下降(P<0.05),且+T S P P 样品的巯基含量显著高于-T S P P 样品 (P<0.05)。当H2O2溶液浓度达到20 mmol/L时, -TSPP处理样品的巯基含量下降了65.94%,+TSPP处理的蛋白样品下降57.74%,可见TSPP对肌原纤维蛋白氧化具有一定的保护作用。
刘泽龙[6]采用0.5 mmol/L H2O2溶液羟基生成系统在4 ℃氧化含焦磷酸钠的肌球蛋白12 h或者24 h,发现焦磷酸对肌球蛋白S1和S2部位的氧化具有保护作用。从本研究的羰基和巯基结果可以看出,TSPP对肌原纤维蛋白氧化具有一定的保护作用,这与刘泽龙[6]的报道相符。但是对比刘泽龙结果,可以发现TSPP对肌原纤维蛋白的保护效果小于对肌球蛋白的保护效果。这可能是由于在肌原纤维蛋白中,部分肌球蛋白的S1仍与肌动蛋白结合,形成了空间阻碍作用[17-18]。
2.2 TSPP对肌原纤维蛋白交联程度的影响
2.2.1 自由氨基含量分析
如图3所示,肌原纤维蛋白的自由氨基含量随着H2O2溶液浓度的增加而显著降低(P<0.05),这是因为赖氨酸的ε-NH2基团非常容易受到羟自由基攻击转化为羰基,而新生成的羰基又可能与NH2共价结合进一步降低自由氨基的含量[8],所以自由氨基含量的变化在一定程度上也可反映蛋白氧化程度。由图3还可看出,所有+TSPP氧化样品(H2O2溶液浓度为1~20 mmol/L)的自由氨基的降低幅度显著小于-TSPP样品(P<0.05),这可能是因为TSPP对肌原纤维蛋白氧化起到保护作用,这与羰基 (图1)和巯基(图2)的结果相符。

图 3 TSPP和MTG处理后肌原纤维蛋白自由氨基含量的变化Fig. 3 Change in free amine content of myofibrillar protein treated with TSPP and then cross-linked with MTG

表 1 MTG引起的自由氨基、凝胶强度、持水性的相对变化量Table 1 Percent variations in free amine content, gel strength, and water-holding capacity caused by MTG cross-linking%
赖氨酸的ɛ-氨基是MTG交联的一个反应底物,因此自由氨基的降低量可以间接反映MTG交联反应的程度[19-20]。 如图3所示,经MTG处理后,所有样品的自由氨基含量均显著下降(P<0.05)。为了排除氧化的影响且只观察MTG交联程度,通过计算相同氧化条件下MTG交联前后自由氨基的相对降低量(表1),可见自由氨基相对降低量随着H2O2溶液浓度增大出现先增高后降低的趋势,在H2O2溶液浓度为10 mmol/L时达到最大,特别是+TSPP样品自由氨基降幅高达43.60%。总体来说,MTG交联后, +TSPP氧化样品的自由氨基相对降低量高于-TSPP氧化样品,说明TSPP处理有利于MTG交联。这可能与TSPP引起的蛋白结构变化有关:其一,TSPP解离肌原纤维中的肌动球蛋白,产生更多自由的肌球蛋白和肌动蛋白,降低了空间位阻,暴露更多可利用的谷氨酰胺和赖氨酸残基;其二,TSPP与肌球蛋白头部活性部位结合时改变了肌球蛋白空间结构[5],使肌球蛋白中的谷氨酰胺和赖氨酸残基更易于MTG接近。然而,只有在H2O2溶液浓度为1~5 mmol/L时+TSPP氧化样品的自由氨基相对降低量才显著高于-TSPP氧化样品(P<0.05),而当H2O2溶液浓度为10~20 mmol/L时二者差异不显著,这说明过度氧化时TSPP促进MTG交联的作用被大大削弱了,可能与过度氧化引起的蛋白聚集物所形成的空间位阻有关,也可能与谷氨酰胺和赖氨酸残基被过度氧化修饰有关。
2.2.2 SDS-PAGE测定结果

图 4 TSPP和MTG处理后肌原纤维蛋白的SDS-PAGE模式Fig. 4 SDS-PAGE patterns of myofibrillar protein treated with TSPP and then cross-linked with MTG
由图4a可知,无论是否添加TSPP,随着H2O2溶液浓度增加,样品中肌球蛋白重链(myosin heavy chain,MHC)逐渐减少,肌动蛋白条带变化不大。同时,浓缩胶上方有聚集体出现。当添加β-ME还原后(图4b),聚集体大部分消失,并且减少的MHC条带大多能够恢复到氧化前接近的水平,说明这些条带的减少主要是通过二硫键生成了蛋白聚集物,而少量没有恢复的部分,很可能是肌原纤维蛋白提取过程中或氧化过程中通过其他共价键生成的聚集物,如羰基-氨基、酪氨酸-酪氨酸、赖氨酸-脂肪氧化产物(如丙二醛)-赖氨酸等反应形成的共价键[21-23]。 对比TSPP处理前后的电泳图(图4a),发现当H2O2溶液浓度小于5 mmol/L时,+TSPP样品的MHC条带相对较粗,说明TSPP对蛋白氧化具有一定抑制作用,这与羰基(图1)、巯基(图2)和自由氨基(图3)的结果相符。然而,当H2O2溶液浓度达到10~20 mmol/L,-TSPP样品的MHC条带反而比相同氧化条件下+TSPP样品的粗 (图4a),加入β-ME后(图4b),+TSPP样品的MHC条带强度小于-TSPP样品的MHC条带强度,且浓缩胶上部的大分子聚集物反而比-TSPP样品的多,这可能是由于在TSPP条件下,重度氧化蛋白除了通过二硫键进行交联外,还更倾向于通过其他的共价键进行交联。
对比图4a、c发现,MTG交联后,所有样品的MHC显著减少,且浓缩胶顶部的大分子聚集物浓度增加。添加β-ME后,图4d中浓缩胶顶部的聚集物也明显比图4b中多,可见这些聚集体是由MTG催化形成的异肽键 ε(γ-谷氨基)-赖氨酸连接在一起的、不含二硫键的巨大分子[24]。对比图4b、d还发现,+TSPP样品的MHC和肌动蛋白条带明显比相同氧化条件下-TSPP样品的条带细,说明TSPP处理后,肌原纤维蛋白更容易发生MTG交联。这也正好印证了自由氨基的结果(图3)。
2.3 TSPP对肌原纤维蛋白凝胶特性的影响
2.3.1 动态流变学分析
G’通常用来描述凝胶的弹性性状,G’越高,凝胶弹性越好[25]。如图5A所示,随着温度升高,G’增长缓慢,此时肌原纤维蛋白间相互作用较弱。当温度升到40 ℃以后G’迅速增大,这是由于加热使肌原纤维蛋白变性,结构开始展开。未氧化样品的G’在46 ℃出现一个峰值,这是由于加热使肌原纤维蛋白间发生交联,尤其是肌球蛋白头部交联,呈现出弹性较好的结构[26-27]。G’达到峰值后便逐渐下降,这很可能与肌球蛋白尾部解螺旋有关,导致蛋白流动性增加[28]。而随着温度继续升高,蛋白质在二硫键、疏水作用、氢键等作用下重新相互作用加强,逐步形成不可逆的凝胶网络结构,因此G’继续升高。当温度接近75 ℃时,G’趋于稳定,这是由于肌原纤维蛋白逐渐形成了稳定的凝胶体系[29]。
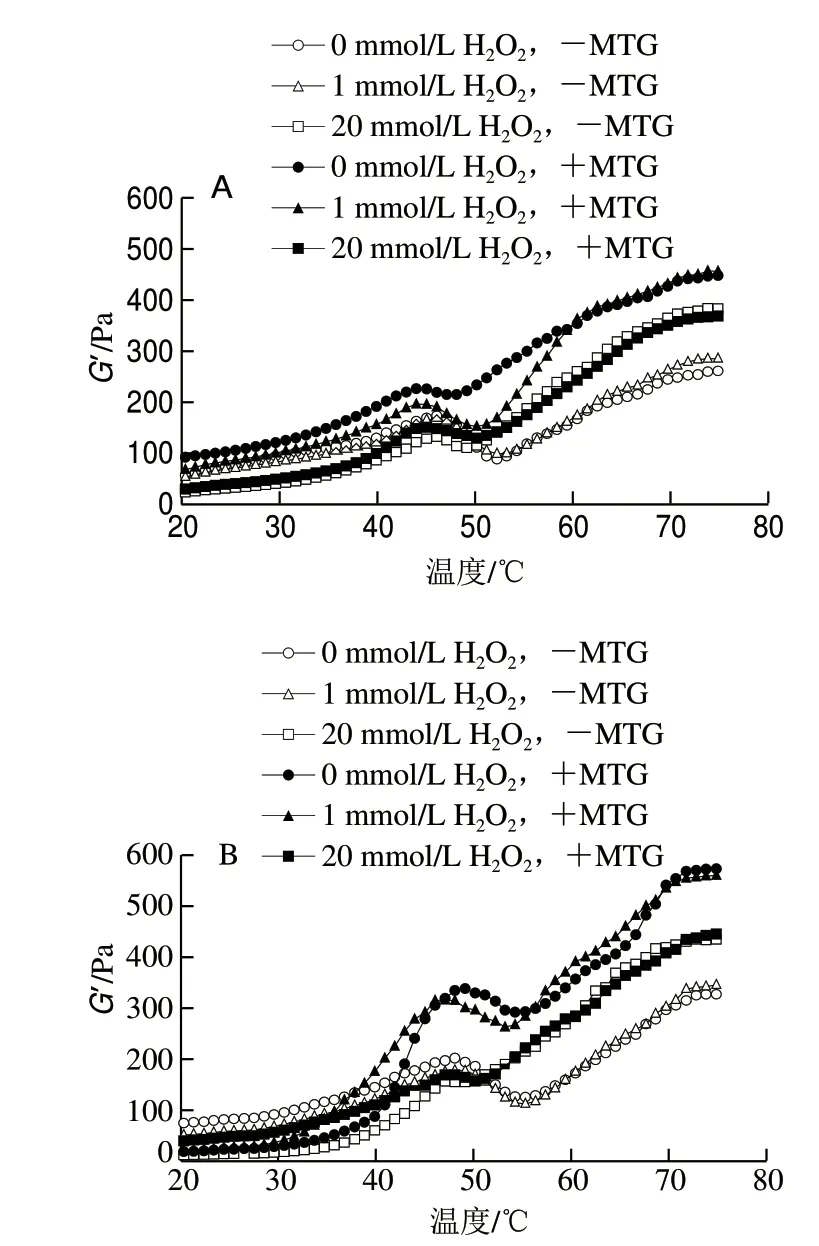
图 5 未经TSPP处理(A)和TSPP处理(B)的肌原纤维蛋白流变Fig. 5 Rheograms of myofibrillar protein not treated with TSPP (A) and treated with TSPP (B)
如图5A所示,当肌原纤维蛋白在无TSPP条件下氧化时,随着H2O2溶液浓度从1 mmol/L升至20 mmol/L,G’峰位置向温度低的方向偏移,且峰值逐渐降低,这可能是由于氧化破坏蛋白的空间结构,使疏水结构暴露,进而导致G’峰位置和峰值发生变化[30]。随着温度逐渐升至75 ℃时,所有样品的G’也呈逐渐上升的趋势。加入MTG交联后,G’峰值进一步增加,峰位置向温度低的方向偏移,这与MTG催化肌原纤维蛋白交联导致蛋白结构变化有关。相对于未交联样品,温度升至75 ℃时,G’显著增加。为了观察MTG交联作用对肌原纤维蛋白凝胶性能的影响,计算由MTG交联引起的G’增幅,发现其与氧化程度相关,即随着H2O2溶液浓度升高(1~20 mmol/L),G’增幅反而从30.32%逐渐降至14.07%,可见在无TSPP条件下MTG催化所引起的凝胶性能提高与氧化程度相关,即蛋白氧化抑制MTG交联所引起的凝胶性能的提高。
相对于-TSPP条件(图5A),在TSPP条件下,未氧化样品的G’峰位置向温度高的方向移动,出现在48.1 ℃,且峰值增大(图5B),这可能是由TSPP对S1部位氧化具有保护作用,抑制起始阶段蛋白的聚集,使变形温度升高约2 ℃。随着H2O2溶液浓度从1 mmol/L升至20 mmol/L, G’峰位置继续向温度低的方向偏移。MTG交联后,TSPP处理肌原纤维蛋白的峰值显著增大(P<0.05),这与Lesiow等[31]结论相符。加热至75 ℃时,+TSPP样品(图5B)的G’明显高于-TSPP样品(图5A),可以看出,TSPP可以提高肌原纤维蛋白凝胶性能。但若扣除氧化所引起的凝胶性能变化,只观察在TSPP条件下MTG交联所引起的凝胶性能变化,发现在TSPP条件下随着H2O2溶液浓度升高(1~20 mmol/L),由MTG交联引起的G’增幅从75.19%逐渐降低至2.47%,变化十分剧烈。由此可见,相对于-TSPP样品,TSPP处理使蛋白氧化对MTG交联引起的凝胶性能提高具有更强的抑制作用。
2.3.2 凝胶强度分析
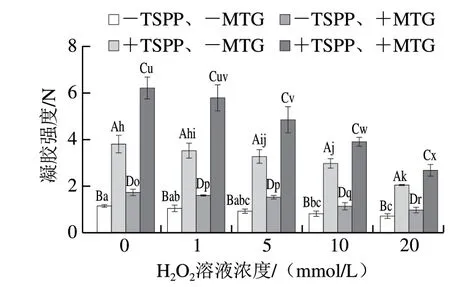
图 6 TSPP和MTG处理后肌原纤维蛋白凝胶强度的变化Fig. 6 Change in gel strength of myofibrillar protein treated with TSPP and then cross-linked with MTG
如图6所示,所有蛋白凝胶样品随着H2O2溶液浓度的增加,凝胶强度均逐渐降低。这说明,氧化造成的肌原纤维蛋白结构变化,特别是大分子聚集物的生成,使凝胶空隙加大、结构松散,进而降低了肌原纤维蛋白的凝胶强度[32]。整体而言,+TSPP样品的凝胶强度显著高于 -TSPP样品(P<0.05),可见TSPP处理会提高天然和氧化肌原纤维蛋白的凝胶性能。
MTG可催化蛋白间发生交联反应,改善蛋白凝胶特性。添加MTG后,所有样品的凝胶强度均显著增加 (P<0.05),且+TSPP样品的凝胶强度显著高于 -TSPP样品(P<0.05)。但是,由MTG交联引起的凝胶强度增幅不同,计算-TSPP以及+TSPP两种条件下,MTG交联样品相对于未交联样品的相对增加量 (表1),可以看出在-TSPP和+TSPP两种条件下由MTG交联引起的凝胶强度增幅均随H2O2溶液浓度增加逐渐降低(P<0.05),虽然在+TSPP条件下,未氧化样品的凝胶强度增幅高于-TSPP样品,但随着氧化程度增加反而降低速度更快,这与动态流变学结果(图5)相符。由此可推断,在-TSPP和+TSPP两种条件下,蛋白氧化抑制MTG交联所引起的凝胶性能的提高,且在TSPP条件下抑制作用更剧烈。造成这种现象的原因可能有二:其一,虽然+TSPP条件下,MTG交联程度更高,但是蛋白交联过度,反而不利于凝胶形成。Li Chunqiang等[33]也发现类似现象,在高盐条件下,MTG交联程度高的样品形成的凝胶强度并不是最高的。其二,可能是TSPP、氧化和MTG交联均改变了肌原纤维蛋白的空间结构,且形成高分子质量聚集物,三者的叠加效应可能导致凝胶网络结构的形成模式发生变化。
2.3.3 持水性分析
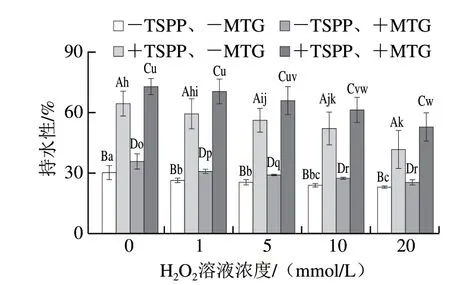
图 7 TSPP和MTG处理后肌原纤维蛋白持水性的变化Fig. 7 Change in water-holding capacity of myofibrillar protein treated with TSPP and then cross-linked with MTG
肌原纤维蛋白凝胶持水性主要表现为对存在于凝胶致密的空间网络结构内部的不易流动水和凝胶空间网络结构外部自由水的保持能力。由图7可知,氧化蛋白凝胶的持水性随着H2O2溶液浓度增加而逐渐降低。有研究表明,氧化造成的肌原纤维蛋白结构变化(大分子聚集、组织松散等)会导致蛋白凝胶的持水性下降[34]。 +TSPP蛋白凝胶的持水性显著高于同条件下-TSPP样品 (P<0.05),这与磷酸盐可以提高肌肉持水性的报道相符[35],机制可能与磷酸盐使蛋白的pH值偏离等电点、解离肌动球蛋白等有关。然而,随着H2O2溶液浓度增加, +TSPP样品的持水性与-TSPP样品之间的差异越来越小,可见氧化会减弱TSPP提高凝胶持水性的作用。
M T G 交联后,所有凝胶持水性均显著增加 (P<0.05)。由MTG交联引起的持水性相对增加量 (表1),可见-TSPP样品的持水性相对增加量随着H2O2溶液浓度增加逐渐减小(P<0.05),而+TSPP氧化样品的持水性相对增加量明显高于未氧化样品 (P<0.05),这表明TSPP和氧化共同作用反而有利于提高MTG交联后蛋白凝胶的持水性。
3 结 论
TSPP对肌原纤维蛋白氧化具有一定的抑制作用,但对MTG交联反应起到积极作用,且与氧化程度相关,这可能与TSPP改变肌球蛋白结构,进而改变MTG交联模式有关。总的来说,无论添加TSPP与否,氧化会导致肌原纤维蛋白凝胶性能下降,而MTG交联后均有所回升,其上升幅度与氧化程度和TSPP处理相关:在+TSPP和 -TSPP条件下,由MTG交联引起的凝胶性能增幅随着氧化程度的增加均降低,但在+TSPP条件下降低速度更快。由此可知,相对于-TSPP样品,在氧化胁迫条件下TSPP对MTG交联引起的凝胶性能提高具有更强的抑制作用。总之,TSPP、氧化和MTG三者对肌原纤维蛋白凝胶性能的影响复杂,作用机制有待进一步研究。磷酸盐与MTG是肉制品中常见添加剂,探究二者的相互作用对肉制品加工及产品品质提高具有重要理论意义。
