响应面法优化红曲调味酒的发酵条件
2020-02-06董彩文王雪纯李一晴汪雪莲杨晓磊胡晓龙
董彩文,王雪纯,李一晴,汪雪莲,杨晓磊,胡晓龙*
(1.郑州轻工业大学 食品与生物工程学院,郑州 450002;2.河南省食品生产与安全协同创新中心,郑州 450002;3.长葛市颐恒健蜂业有限公司,河南 长葛 461502;4.许昌市蜂蜜发酵工程技术研究中心,河南 长葛 461502)
红曲米是曲霉科真菌属红曲霉的菌丝体附着寄生在糯米中,并且以籼稻和粳稻等为原料发酵而成,红曲米具有许多十分重要的药用功能,例如:降血压、降血脂、抗肿瘤、抗癌等多种重要功效[1,2]。红曲调味酒以蜂蜜为原料,将蜂蜜的营养功能和酒的保健功能集为一体,所以对其进行开发更具有特色和一定的商业价值[3]。红曲已经在调味品中得到应用[4],同时已经建立了红曲酿造料酒的相关标准[5]。本研究的红曲调味酒则是在蜂蜜发酵的基础上,在酿酒的过程中利用红曲米和酵母进行发酵。在发酵过程中,红曲米中的多种活性物质溶解于酒中,可以加强营养保健功能[6];同时,与传统的料酒工艺相比[7],省去了浸米、蒸米、淋饭等复杂操作,更容易实现工业化和连续化生产。高级醇是酒精发酵过程中产生的副产物,其含量高低对调味酒的香气和品质有很大影响,是评价酒品质的重要指标之一[8]。
通过单因素试验确定pH、培养时间、温度、氮源、糖浓度等对红曲调味酒中高级醇含量的影响;然后通过响应面优化试验确定酿造红曲调味酒的最佳条件[9,10]。
1 材料与方法
1.1 材料
蜂蜜:枣花蜜,购自长葛市;红曲米:购自福建古田;酿酒高活性酵母:购自安琪公司。
1.2 试验方法
1.2.1 工艺流程
蜂蜜→稀释→调酸→加热灭菌→冷却→接入酵母(加磷酸氢二铵)→发酵→分离原酒→调整成分→过滤→装瓶→灭菌→冷却→成品。
1.2.2 高级醇的测定
1.2.2.1 标准曲线的制作
取6支干净的比色管,编号依次为0~5。在6支比色管中依次分别加入0,0.2,0.4,0.6,0.8,1.0 mL高级醇标准使用液,加水定容至2.0 mL,摇匀后置于冰水浴中,沿管壁缓慢加入4 mL 0.5%对二氨基苯甲醛浓硫酸溶液,将各比色管同时摇匀后盖塞,置于沸水浴中精确计时加热15 min后取出迅速放于冰水中冷却,加水定容至10 mL摇匀后,用1 mL比色皿以0号管作为对照,于520 nm波长下测定OD值。以OD值为纵坐标,高级醇含量为横坐标,绘制高级醇标准曲线。
1.2.2.2 发酵液中高级醇的测定
在空白对照组中加入2 mL蒸馏水,其余试验组中加入1.5 mL蒸馏水、0.5 mL样液。在冰水浴中加入0.5%对二氨基苯甲醛浓硫酸溶液4 mL,随后放入80 ℃的水浴中15 min。取出后加入4 mL的蒸馏水混匀,用分光光度计测量OD值。根据标准曲线方程,计算高级醇含量。
1.2.3 红曲调味酒发酵温度试验
配制的蜂蜜水糖度为16%,pH调整为4.5,红曲米的添加量为10 g,酿酒高活性酵母的添加量为0.5 g。将温度梯度设置为24,26,28,30,32 ℃,每个温度包含2瓶样品作为平行试验,培养时间为3 d。培养结束后离心,取上清液蒸馏,进行高级醇的测定。
1.2.4 红曲调味酒发酵pH试验
配制的蜂蜜水糖度为16%,培养温度为28 ℃,每瓶250 mL。红曲米的添加量为10 g,酿酒高活性酵母的添加量为0.5 g。将pH梯度设置为3.5,4,4.5,5,5.5,每个pH包含2瓶样品作为平行试验,培养时间为3 d。培养结束后离心,取上清液蒸馏,进行高级醇的测定。
1.2.5 红曲调味酒发酵培养时间试验
配制的蜂蜜水糖度为22%,pH调整为4.5,每瓶250 mL。红曲米的添加量为10 g,酿酒高活性酵母的添加量为0.5 g,将培养时间梯度设置为3,4,5,6,7 d,每个培养时间梯度下包含2瓶样品作为平行试验,培养结束后离心,取上清液蒸馏,进行高级醇的测定。
1.2.6 红曲调味酒发酵氮源添加量试验
配制的蜂蜜水糖度为22%,pH调整为4.5,每瓶250 mL。红曲米的添加量为10 g,酿酒高活性酵母的添加量为0.5 g,发酵时间为5 d。将氮源添加量梯度设置为300,600,900,1200,1500 mg/L,每个氮源添加量梯度下包含2瓶样品作为平行试验。培养结束后离心,取上清液蒸馏,进行高级醇的测定。
1.2.7 红曲调味酒发酵糖浓度试验
配制的蜂蜜水pH为4.5,每瓶250 mL。红曲米的添加量为10 g,酿酒高活性酵母的添加量为0.5 g,磷酸氢二铵添加量为900 mg/L,培养时间为5 d。将糖浓度梯度设置为16%、20%、24%、28%、32%,每个糖浓度梯度下包含2瓶样品作为平行试验。培养结束后离心,取上清液蒸馏,进行高级醇的测定。
1.2.8 方差分析软件分析单变量单因素的显著性
采用方差分析方法对由各个因素得到的试验结果进行显著性检验。分析得到的结果中,显著的两个单变量之间用不同的字母表示,不显著的两个单变量之间用相同的字母表示。
1.2.9 响应面优化
根据单因素试验的结果,对红曲调味酒发酵影响较大的因素进行响应面优化,试验的因素水平见表1。

表1 试验因素及水平Table 1 Experimental factors and levels
2 结果与分析
2.1 高级醇标准曲线的绘制
按照高级醇标准曲线的步骤得到的标准曲线见图1。
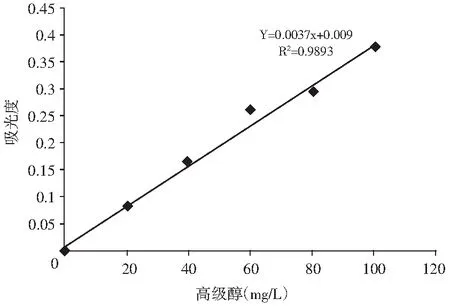
图1 高级醇标准曲线Fig.1 Standard curve of higher alcohols
由图1可知,R2值达到0.99,说明拟合的试验结果准确率较高。通过该回归曲线得到的高级醇含量结果较为准确。
2.2 发酵温度对红曲调味酒高级醇的影响结果

图2 温度对高级醇的影响Fig.2 Effect of temperature on higher alcohols
由图2可知,高级醇的含量先呈现下降的趋势,在28 ℃时达到最低值,随后高级醇的含量又有缓慢的回升,但是差别不显著。
2.3 pH对红曲调味酒高级醇的影响结果

图3 pH对高级醇的影响Fig.3 Effect of pH on higher alcohols
由图3可知,高级醇含量随着pH的上升先上升后下降,在pH达到5以后,高级醇含量趋于平衡。
2.4 培养时间对红曲调味酒高级醇的影响结果

图4 培养时间对高级醇的影响Fig.4 Effect of culture time on higher alcohols
由图4可知,高级醇含量随着培养时间的增加而增加,超过5 d以后增加明显。
2.5 氮源添加量对红曲调味酒高级醇的影响结果

图5 氮源添加量对高级醇的影响Fig.5 Effect of nitrogen source additive amount on higher alcohols
由图5可知,磷酸氢二铵浓度的变化对高级醇的生成影响不明显。方差分析结果显示:磷酸氢二铵浓度为300,600,900,1200 mg/L 时,4个试验组无显著性差异。说明在此范围内,磷酸氢二铵浓度对高级醇的生成影响不大。当磷酸氢二铵浓度达到1500 mg/L时,高级醇的生成显著降低。
2.6 糖浓度对红曲调味酒高级醇的影响结果

图6 糖浓度对高级醇的影响Fig.6 Effect of sugar concentration on higher alcohols
由图6可知,糖浓度为16%时,高级醇含量达到最高值。随着糖浓度增加,高级醇含量减少。
2.7 响应面优化结果
其中高级醇的回归方程为:
Y=43.16+0.44A-1.6B-26.49C+7.1AB-2.17AC-6.7BC+10.66A2+1.43B2+20.51C2,方程中每项字母前系数的正负代表Y值的影响是正相关还是负相关。
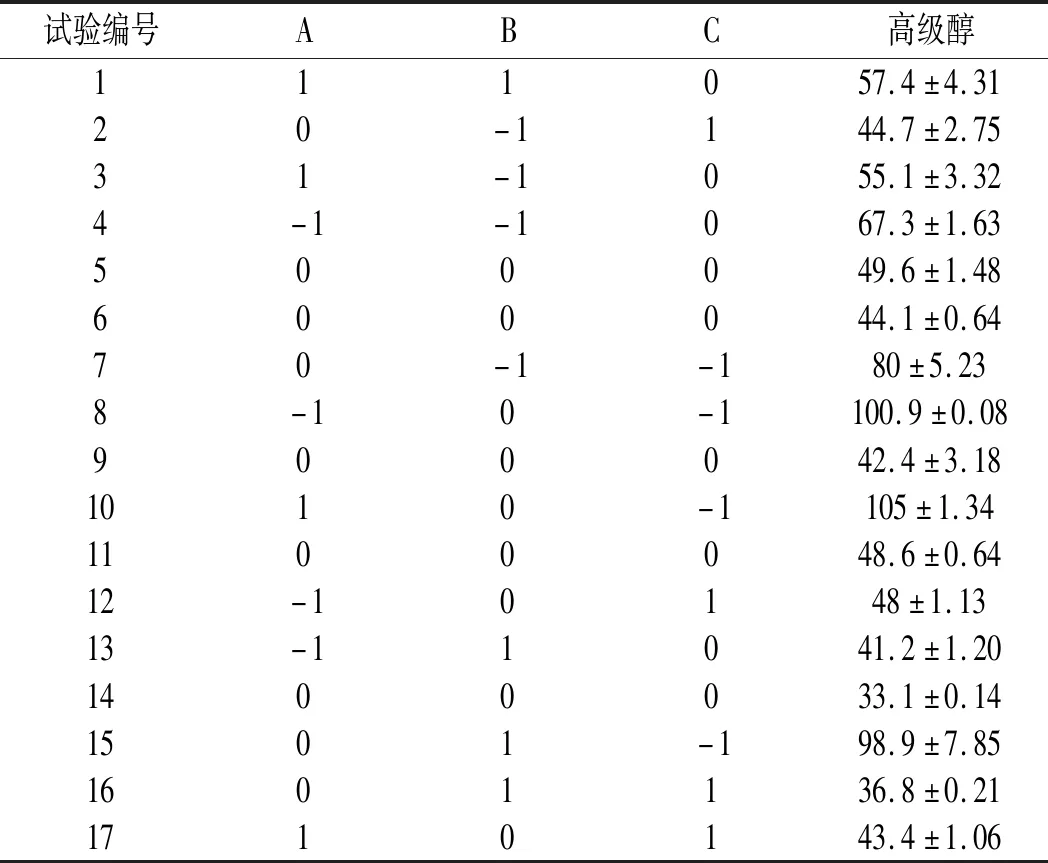
表2 试验设计及其结果Table 2 Experimental design and results

表3 高级醇回归方程方差分析结果Table 3 Results of variance analysis of higher alcohols regression equations
注:“****”为差异极显著(P<0.0001);“***”为差异高度显著(P<0.01);“**”为差异显著(P<0.05);“*”为差异不显著(P>0.05)。
由表3可知,由于模型的P值<0.01,说明该模型高度显著。回归方程的回归系数>0.9049,说明约有90.49%高级醇含量的变化率可以用该模型来解释。对糖度、磷酸氢二铵添加量和培养时间进行分析,发现培养时间的P值<0.0001,说明培养时间对高级醇的影响是极显著的。糖度的P值=0.8654>0.05,说明糖度对高级醇变化率的影响是不显著的。磷酸氢二铵的P值=0.5405>0.05,说明磷酸氢二铵对高级醇变化率的影响是不显著的。但是该模型总体对高级醇变化率的影响是高度显著的。在对二次项的分析中,发现糖浓度的P值=0.0171<0.05,磷酸氢二铵添加量的P值=0.6886>0.05,培养时间的P值=0.0006<0.01,分别说明糖浓度对高级醇变化率的影响是显著的,磷酸氢二铵添加量对高级醇变化率的影响是不显著的,培养时间对高级醇变化率的影响是高度显著的。在交互项中,AB、AC、BC的P值均大于0.05,说明交互项对高级醇变化率的影响是不显著的。综合以上分析表明,回归方程为高级醇的变化率提供了一个较为合适的模型。
2.8 验证试验结果
软件分析给出的试验条件及结果为:当糖浓度为25.45%、磷酸氢二铵添加量为1000 mg/L、培养时间为6 d时理论的高级醇含量为28.78 mg/L。为了验证该模型给出的方案是否与实际情况相符合,进行2次平行验证试验,但是从实际情况考虑,高级醇的验证条件调整为:糖度为25.4%,磷酸氢二铵添加量为1000 mg/L,培养时间为6 d。高级醇的验证试验中实际测得的高级醇平均值为28.6 mg/L,与理论值的相对误差为0.6%,说明该模型能较好地反映实际情况。
3 结论
通过单因素试验和响应面优化试验方法考察了培养温度、pH、培养时间、氮源添加量、糖浓度等因素对高级醇含量的影响。结果表明:培养时间对红曲调味酒酿造过程的影响较大,其次是糖浓度的影响。通过响应面优化和验证试验得到的高级醇的优化方案为:培养温度为28 ℃,培养液pH为5,红曲米添加量为4%,酵母添加量为0.2%,糖浓度为25.4%,磷酸氢二铵添加量为1000 mg/L,培养时间为6 d。
