表观遗传学药物对弥漫大B细胞淋巴瘤SU-DHL-4细胞株增殖及SHP-1基因表达的影响*
2020-02-05李佳佳
刘 林 李佳佳 张 凤
蚌埠医学院第一附属医院血液科,安徽 蚌埠 233000
弥漫大B细胞淋巴瘤(diffuse largeB-cell lymphoma,DLBCL)是最常见的非霍奇金淋巴瘤。有文献报道DLBCL在欧美国家NHL发病率约占40%[1],在发展中国家的发病率比例更高。因此积极寻找更多的治疗靶点是十分必要的。表观遗传学是指基因表达或蛋白表达的改变不涉及DNA序列变化,但又可稳定遗传的现象,主要包括基因组印记、DNA甲基化、组蛋自修饰和非编码RNA等。DNA甲基化与组蛋白乙酰化可通过甲基CpG结合蛋白(MeCP)协同调控基因表达,因而可通过甲基转移酶抑制剂与HDACI协同抑制肿瘤细胞,使失活的抑癌基因恢复功能,克服耐药性,减轻不良反应,发挥更强的抗肿瘤作用。鉴于此,本研究采用去甲基化药物5-Aza-CdR及SAHA处理弥漫大B细胞淋巴瘤SU-DHL-4细胞株,观察5-Aza-CdR及SAHA对SU-DHL-4细胞增殖的影响及其对SHP-1表达水平的变化,探讨其作用与机制,报道如下。
1 材料与方法
1.1 主要实验仪器与试剂
紫外分光光度仪(型号:NANODROP 8000,美国Thermo Scientific公司);反转录及实时荧光定量PCR所用试剂(日本TaKaRa公司);GAPDH及SHP-1引物(上海英骏生物公司合成);5-Aza-CdR、SAHA、MTT试剂(美国Sigma公司)。
1.2 细胞培养
SU-DHL-4细胞株(上海瑞金医院血液学研究所赵维莅教授馈赠)。从液态氮罐取出后,用含有10%热灭活小牛血清的RPMI1640培养液,放置于培养箱(温度37 ℃、5%CO2、空气饱和湿度95%)。每2 d换液传代。5-Aza-CdR处理细胞时,维持细胞密度在0.5×106~1×106/ml,用终浓度为1μM的5-Aza-CdR处理细胞,隔日半量换液,补加新鲜培养液和药物调整至终浓度,持续培养48 h后,再加入终浓度为2μM的SAHA,继续培养24 h,第4 d收集1×107以上数量细胞进行检测。
1.3 MTT实验
检测不同浓度的5-Aza-CdR和SAHA单用及联合使用对各细胞株的增殖抑制作用。各细胞株,以每孔15000个细胞分别将细胞悬浮于浓度为0.25μM、0.5μM、1μM和2μM的5-Aza-CdR和SAHA培养液中,接种于96孔板中。设对照组(不加药)和空白孔组(只有培养液无细胞)。先用5-Aza-CdR处理48 h,然后加用SAHA继续处理24 h;72 h后,向每孔中加入0.1 mg MTT, 37 ℃作用4 h后,每孔加入180 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,在全自动酶标仪490 nm处测量标本吸光度(A)值并记录数据,计算平均A值,按照公式计算细胞生长抑制率。实验设3复孔,反复实验3次。细胞生长抑制率=(1-A加药组/A对照组)×100%
1.4 SYBR Green荧光染料标记的实时荧光定量PCR
分别用终浓度为用1 μmol/L的5-Aza-CdR、2μmol/L的SAHA及两药联合应用处理SU-DHL-4细胞,培养72h后收集对照组与加药组细胞,按TRIzol试剂说明书提取总RNA,用分光光度法检测RNA的浓度和纯度,A260/A280比值均为1.9~2.1,按试剂盒说明书要求采取两步法反转录成cDNA,以GAPDH基因作为内参。设计过程:首先,在Nucleotide中查找基因序列,然后使用软件Primer 3.0设计,最后做BLAST分析核对引物的特异性及可行性。PCR反应分三步:第一步,95 ℃,30 s;第二步,95 ℃,5 s;60 ℃,30 s;第三步,95 ℃,15 s;60 ℃,1 min;95 ℃,15 s;共40个循环。同时扩增SHP-1基因和内参基因,溶解曲线检测产物的特异性,所得结果和同期扩增内参基因做比较,用基因相对定量法(2-ΔΔCt)计算各组基因相对于对照组的表达倍数:ΔCt=待测基因CT值-内参基因CT值,-ΔΔCt=待测基因ΔCt-对照基因ΔCt,每个基因做3个复孔,取平均值。
1.5 统计学处理
实验数据以均数±标准差表示,结果采用单因素方差分析,组间两两比较选用SNK-q检验, 以P≤0.05为差异有统计学意义。
2 结 果
2.1 5-Aza-CdR及SAHA对SU-DHL-4细胞增殖的抑制作用
各浓度5-Aza-CdR及SAHA均可以不同程度的抑制细胞生长,且表现为浓度依赖性。在终浓度为0.25μmol/L、0.5μmol/L、1μmol/L、和2μmol/L5-Aza-CdR及SAHA对SU-DHL-4细胞的抑制率分别为8.13%、13.42%、28.07%、43.39%和6.99%、10.38%、14.87%、21.03%,1μmol/L5-Aza-CdR及2μmol/SAHA联合应用后,SU-DHL-4细胞的增殖抑制率增高为52.23%,且不同药物浓度间吸光度比较,差异有统计学意义(P<0.01)。(表1)
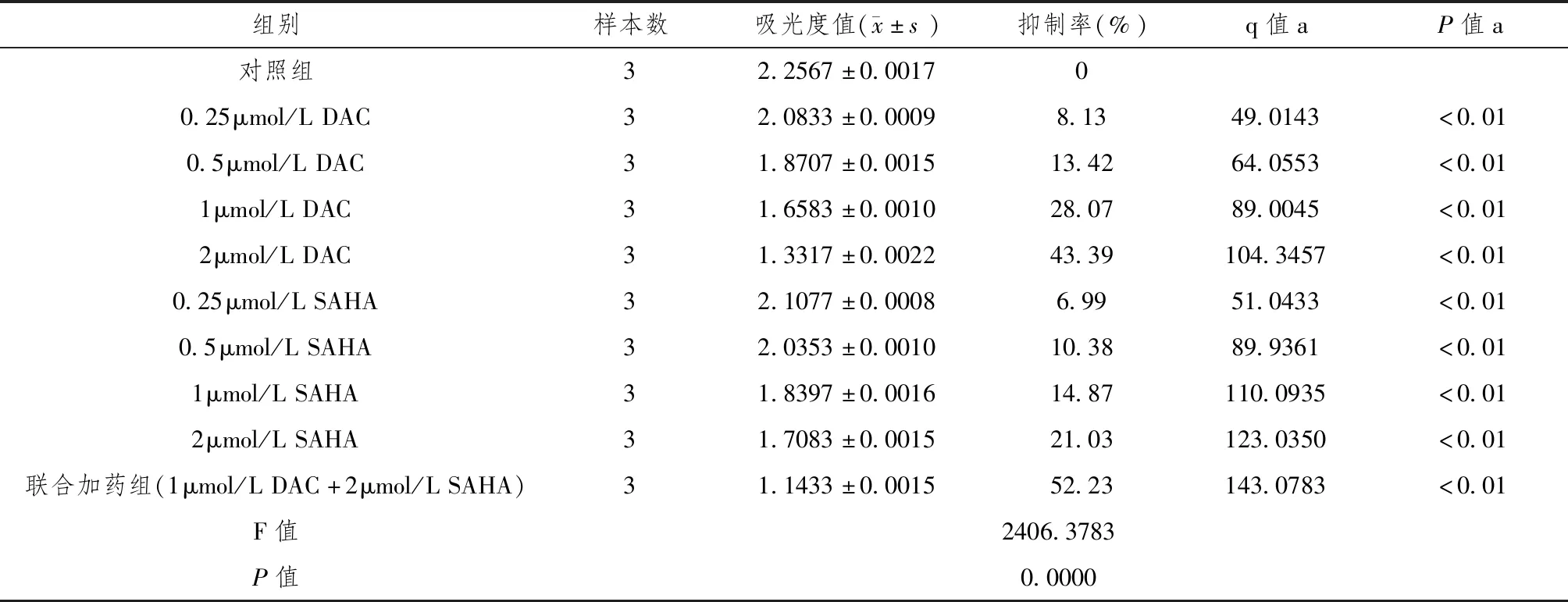
表1 5-氮杂-2’-脱氧胞苷对弥漫大B细胞淋巴瘤SU-DHL-4细胞株增殖抑制情况
注:细胞生长抑制率=(1-A加药组/A对照组)×100%;a与对照组比较;加药组内各组间比较,P<0.01.
2.2 5-Aza-CdR及SAHA对SU-DHL-4细胞SHP-1基因表达的影响
扩增曲线可见GAPDH及SHP-1基因扩增一致,分析融解曲线可以确定SHP-1基因产物的特异性(表2)。对其进行相对定量分析,可见加药组SHP-1基因表达量升高,其中去甲基化药物5-Aza-CdR使基因表达量增加的更明显,并且两药联合应用后SHP-1的表达量进一步增加,两两比较均可见统计学差异(P<0.05)。

表2 SHP1 mRNA相对表达情况
注:相对表达量为2-ΔΔCt表示;a与对照组比较;任意各组两两比较,P值均<0.01。
3 讨 论
DLBCL是是一种高侵袭性肿瘤,也是非霍奇金淋巴瘤中最常见的类型,在细胞起源、形态学、免疫组织化学表型、分子遗传学、累及部位、化疗反应及生存率等方面都表现出明显的异质性。近年来,随着CD20单克隆抗体-美罗华的使用,使生存率有了显著性提高,但仍有部分复发难治患者可因疾病进展生存期明显下降。
5-Aza-CdR是脱氧胞苷的类似物,可以通过整合入DNA干扰DNA对甲基的接受能力,或直接抑制DNA甲基转移酶活性,最终导致DNA甲基在细胞分裂周期中进行性丢失而产生低甲基化,使某些基因重新激活,因此其可作为一种表观遗传学药物干预肿瘤中相关基因的表达[2]。SAHA属羟肟酸类组蛋白去乙酰化酶抑制剂,可通过抑制在肿瘤细胞中过度表达的HDAC,提高染色质特定区域组蛋白乙酰化,中和组蛋白的电荷,引起核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA结合位点特异性结合,激活部分抑癌基因的转录,调控抑癌基因的再表达,诱导细胞凋亡。可以通过增加组蛋白的乙酰化状态,中和组蛋白的电荷,使DNA结构变得更加松散、开放,增加转录因子的进入,从而促使某些沉默的抑癌基因重新表达。SHP-1基因位于第12号染色体的p12-p13区, 是一种含有SH2结构域且主要在造血细胞中表达的胞质蛋白 - 酪氨酸磷酸酶[3], 是信号转导中的重要调节因子[4]。K.Amara等[5]发现了B细胞淋巴瘤/白血病病人病理组织中SHP-1基因高频率的高甲基化状态,且SHP-1甲基化患者的生存期有缩短的趋势,提示SHP-1基因沉默是疾病发生的关键事件之一。
5-Aza-CdR能使甲基化沉默的基因重新被激活,恢复其正常功能。HDAC抑制剂主要是通过改变组蛋白的乙酰化程度来干扰肿瘤细胞内组蛋白乙酰化和去乙酰化状态的平衡,可引起染色体重建和细胞周期停滞、诱导细胞分化和自噬、调控转录因子、促进肿瘤细胞凋亡、抑制肿瘤抑制基因的脱乙酰基作用[6]。本实验中,对于弥漫大B细胞淋巴瘤SU-DHL-4细胞株给予5-Aza-CdR及SAHA处理后可发现对其增殖有较明显的抑制作用,联合用药组抑制率更高,且各加药组吸光度之间的差异均有统计学意义(P<0.05),同时,定量PCR检测到加药后SHP-1在基因和蛋白水平均恢复表达,联合用药组较单药组表达量更高,其中单用5-Aza-CdR较单用SAHA组SHP-1表达恢复的更明显,可能是去甲基化药物5-Aza-CdR在降低SHP-1启动子区的甲基化的作用更大,也更直接一些。
总之,经本实验进一步证实5-Aza-CdR及SAHA具有抑制弥漫大B细胞淋巴瘤细胞增殖的作用,同时,针对加药后SHP-1表达量的明显升高,我们进一步验证了特异性甲基转移酶抑制剂5-Aza-CdR及组蛋白去乙酰化酶抑制剂SAHA可通过去甲基化及组蛋白乙酰化等表观遗传修饰,重新激活沉默的SHP-1基因,促使SHP-1基因恢复表达,从而起到抑制SU-DHL-4细胞增殖的作用。
