塞尼卡谷病毒3ABC蛋白的表达、纯化及多克隆抗体制备
2020-02-05连凯琪周玲玲张明亮王英杰林正丹宋玉伟
连凯琪,周玲玲,张明亮,张 慢,王英杰,林正丹,宋玉伟
(安阳工学院 生物与食品工程学院/河南省动物疫病防控与营养免疫院士工作站/河南省兽用生物制品研发与应用国际联合实验室,河南 安阳 455000)
2002年,美国首次报道SVV,确认该病毒存在于PER.C6细胞培养物中,认为是细胞培养基的污染物。在对先前患有水疱症状的病猪保藏样品进行测序分析发现,自20世纪80年代,美国猪群中便存在该病毒[6]。2002—2015年,猪感染SVV的病例只有在美国和加拿大零星发生,但自2015年下半年起,在美国、巴西、哥伦比亚、中国等相继出现了SVV感染猪的病例。2015年初,巴西有6个州报告了SVV感染的疫情[7-8]。同年,美国中西部多个地区的猪群发生水疱性疫情,感染猪的鼻吻、蹄冠状带部位出现水疱样病变,偶见腹泻症状,病情急促,新生仔猪病死率达30%~70%。后经实验室病原学鉴别诊断,排除口蹄疫、猪水疱病和水疱性口炎等重要动物疫病,最终确诊为SVV感染[9-10]。2015年5月,我国广东省也发生了SVV感染猪的疫情,其特征是鼻吻和蹄冠部出现明显水疱,发病母猪发热、厌食,产房仔猪急性死亡[11-12]。2016年10月,泰国北部一猪场暴发SVV疫情[13]。2017年初,我国福建和河南再次发生SVV感染猪的疫情[14]。至此,SVV在我国猪群中明确存在,且有蔓延趋势,在河南省的猪群中也有该病的报道[14]。
猪感染SVV后出现水疱的临床表现与感染口蹄疫病毒(FMDV)、猪水疱病毒(SVDV)、水疱性口炎病毒(VSV)等极为相似,主要都是鼻子和冠状带出现水疱、跛行、厌食、嗜睡、发烧,并且持续排毒[6]。其中,口蹄疫和猪水疱病都是国家法定一类动物疫病,且口蹄疫疫情一旦发现将对患病动物和同群动物全部捕杀,造成严重的经济损失,这就要求建立方便、快捷、准确的鉴别诊断产品,早日确诊,进行相应治疗或处理[4-6]。非结构蛋白3ABC在FMDV的疫苗免疫和野毒感染的鉴别诊断中发挥着重要的作用,SVV与FMDV属于同科病毒,有着相似的病毒框架和结构。鉴于此,克隆SVV3ABC基因,进行原核表达,制备抗原和抗体,以期为后续开发3ABC抗原或抗体的检测试剂盒奠定基础。
1 材料和方法
1.1 SVV病料
试验所用SVV病料由河南省动物疫病防控与营养免疫院士工作站采集保存。
1.2 载体及菌株
试验所用的pET30a(+)载体由河南省兽用生物制品研发与应用国际联合实验室保存,感受态细胞E.coliDH5α和BL21(DE3)购自北京全式金生物技术有限公司。
1.3 主要试剂
病毒基因组提取试剂盒、反转录试剂盒、LATaqDNA聚合酶、限制性内切酶Hind Ⅲ和BamH Ⅰ、T4 DNA连接酶、胶回收和质粒抽提试剂盒、DL2000 Marker和DL15000 Marker,均购自宝生物工程(大连)有限公司;蛋白质分子质量标准均购自生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.4 病毒基因组的提取和3ABC基因的PCR扩增
将病料进行研磨,取少许放入离心管中,按照试剂盒步骤提取病毒RNA。把提取的病毒RNA取5 μL反转录成cDNA作为PCR扩增的模板。根据GenBank数据库中公布的序列,设计1对引物(3ABC-F:5′-CGCGGATCCATGAGCCCGAACGAAA-
ATGACG-3′和3ABC-R:5′-TCCCAAGCTTTACTGCATGGTTGCCAGCGGT-3′,在上、下游引物中分别引入位点BamH Ⅰ和Hind Ⅲ酶切位点,以及起始密码子和终止密码子),预期扩增片段大小为988 bp。PCR反应体系为50 μL,其中LATaqDNA聚合酶25 μL,10 μmol/L的上、下游引物各1 μL,cDNA模板1.5 μL,用ddH2O补至50 μL。反应条件:94 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 延伸10 min。反应结束后,取PCR产物6 μL进行琼脂糖凝胶电泳,观察结果。
1.5 重组质粒pET30a(+)-3ABC的构建
胶回收纯化的3ABC基因片段和载体pET30a(+)均经BamH Ⅰ和Hind Ⅲ双酶切后胶回收,将回收的目的片段和载体片段按一定的比例在T4 DNA连接酶的作用下16 ℃连接过夜。将连接产物转化感受态细胞E.coliDH5α中,转化平板置温箱(37 ℃)培养14 h,挑单菌落到含卡那霉素的液体LB中37 ℃摇菌13 h,然后提取质粒进行双酶切和PCR鉴定,将鉴定阳性的质粒送生工生物工程(上海)股份有限公司测序。
1.6 重组质粒pET30a(+)-3ABC的表达
按照参考文献[15]中描述的表达方法对重组质粒pET30a(+)-3ABC进行原核表达和SDS-PAGE分析。
第二步则是成像过程,该过程利用衍射原理使物体光波信息得以再现,全息照片在相干激光的照射下,会形成两个象,一个是初始像,另一个是共轭像。这样产生的图像具有较强的立体感,视觉效果也相对真实。值得一提的是,原则上全息照片的每一部分都能再现原物的整个图像,利用这点,在同一张底片上进行多次曝光就可以记录多个不同的图像,并且在显示时也不会互相干扰。
1.7 重组3ABC蛋白的可溶性表达分析和纯化
将1.6中的表达菌液扩大培养,按照参考文献[15]中描述的可溶性分析方法对重组3ABC蛋白进行可溶性分析。按照参考文献[16]中的KCl染色切胶纯化的方法,对重组3ABC蛋白进行纯化,并通过SDS-PAGE分析纯化的目的蛋白。
1.8 重组3ABC蛋白多克隆抗体的制备
用1.7中纯化的重组3ABC蛋白作为抗原免疫2只大鼠(郑州大学实验动物中心),一免抗原与弗氏完全佐剂等体积混合乳化,二免、三免和四免抗原与弗氏不完全佐剂等体积混合乳化,免疫剂量100 μg/只,背部皮下分点注射,每隔14 d免疫1次。第4次免疫后10 d,心脏采血分离血清,冻存于-20 ℃冰箱备用。
1.9 多克隆抗体反应性和滴度检测
将1.6中的表达产物SDS-PAGE电泳后转至硝酸纤维素膜上,用制备的大鼠抗3ABC血清作为一抗,HRP标记的山羊抗大鼠IgG(北京中杉金桥生物技术有限公司)为二抗进行Western blot,分析制备的多克隆抗体对表达的重组3ABC蛋白的识别能力。
将纯化的重组3ABC蛋白作为抗原包被96孔板,制备的多克隆抗体作为一抗,HRP标记的山羊抗大鼠IgG为二抗进行ELISA,分析制备的多克隆抗体的滴度。
2 结果与分析
2.1 3ABC基因的PCR扩增
利用特异性引物扩增3ABC基因,PCR产物凝胶电泳结果显示,在1 000 bp附近扩增出1条比较亮的条带,与预期片段988 bp大小相符(图1)。
2.2 重组质粒pET30a(+)-3ABC的构建
将重组质粒分别进行PCR扩增和酶切鉴定,经琼脂糖凝胶电泳后,结果显示,PCR扩增条带单一,大小约988 bp,BamH Ⅰ和Hind Ⅲ双酶切也出现1条大小约988 bp的条带(图2),测序结果进一步证实重组质粒pET30a(+)-3ABC构建成功。
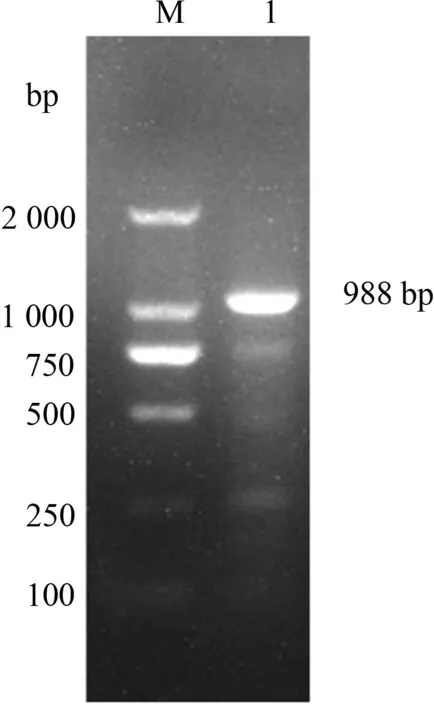
M.DL2000 Marker;1.SVV 3ABC基因
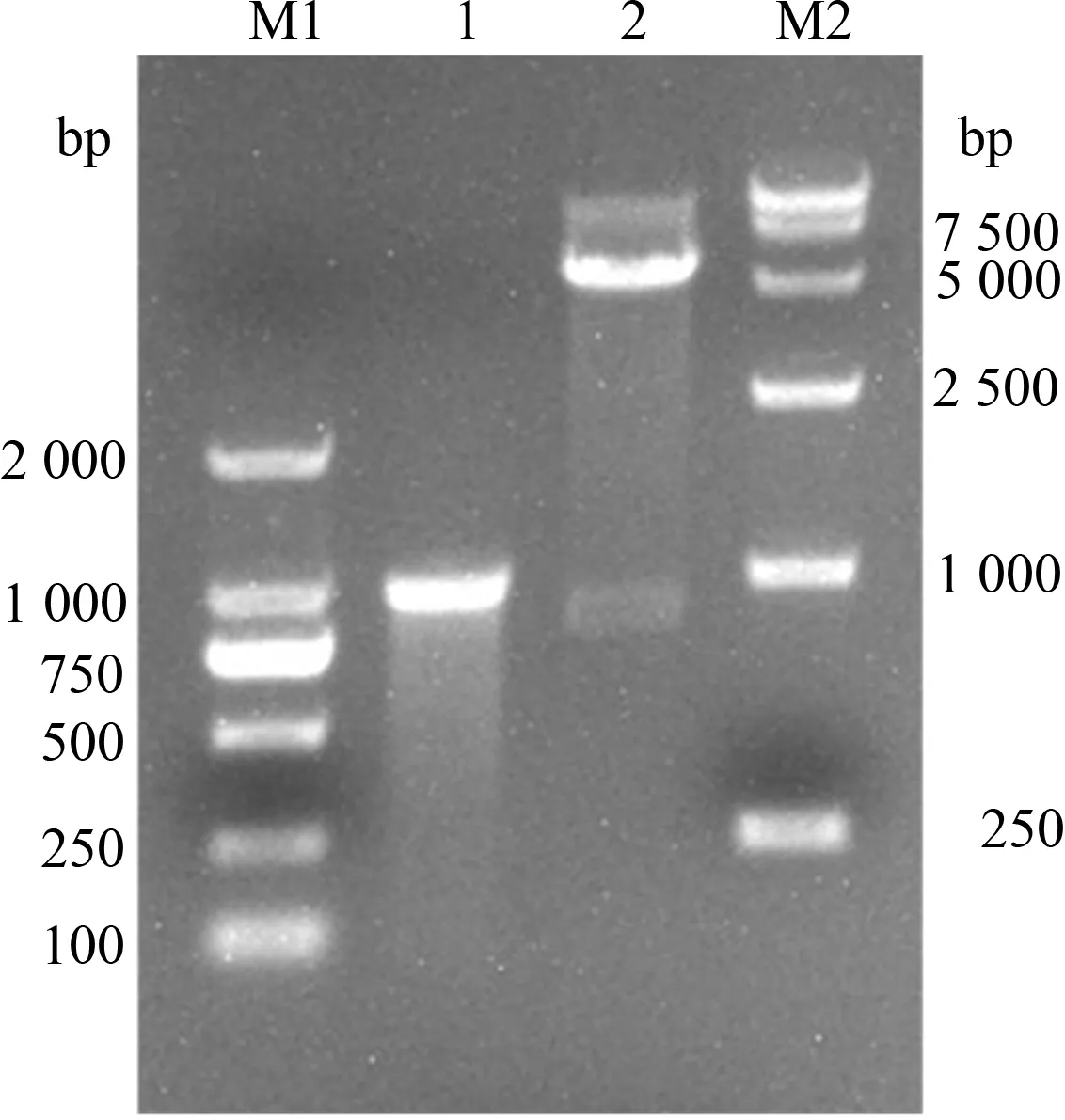
M1.DL2000 Marker;M2.DL15000 Marker;1.PCR鉴定;2.双酶切鉴定
2.3 重组质粒pET30a(+)-3ABC的表达
重组质粒pET30a(+)-3ABC转化的大肠杆菌BL21(DE3),经IPTG诱导,表达产物进行SDS-PAGE分析,在55 ku处出现1条特异性条带,pET30a(+)空载体表达对照组没有出现目的条带(图3),该条带与预测的目的蛋白大小相符。
2.4 重组3ABC蛋白的可溶性表达和纯化
pET30a(+)-3ABC转化的大肠杆菌BL21 (DE3)在IPTG终浓度为0.5 mmol/L、37 ℃下诱导表达6 h时, 3ABC重组蛋白主要在包涵体中表达(图4)。SDS-PAGE结果表明,纯化的重组蛋白在约55 ku的位置出现了1条单一的条带(图5),与2.3中表达的3ABC重组蛋白位置相符。
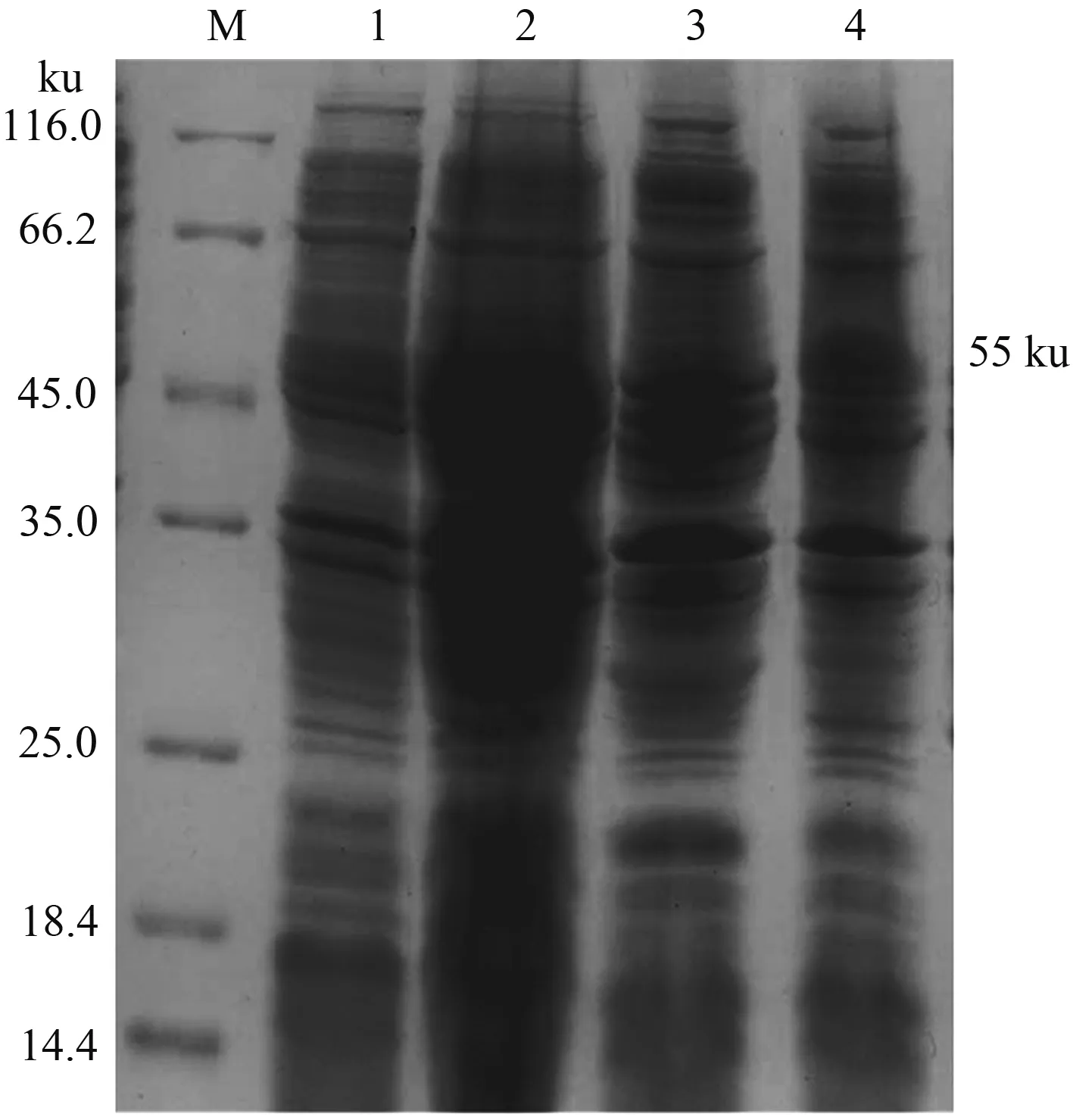
M.蛋白质分子质量标准;1.BL21[pET30a(+)]未诱导组;2.BL21[pET30a(+)]诱导组;3.BL21[pET30a(+)-3ABC]未诱导组;4.BL21[pET30a(+)-3ABC]诱导组

M.蛋白质分子质量标准;1.BL21[pET30a(+)]诱导菌液;2.BL21[pET30a(+)-3ABC]诱导菌体裂解上清;3.BL21[pET30a(+)-3ABC]诱导菌体裂解沉淀
2.5 多克隆抗体的反应性和效价检测
Western blot分析结果显示,表达的重组3ABC蛋白与大鼠抗3ABC血清反应形成了特异的抗原抗体反应带,而与大鼠阴性血清反应未形成相应条带(图6),表明制备的大鼠抗3ABC血清特异性良好,滴度大于1∶64 000。

M.蛋白质分子质量标准;1.纯化的重组3ABC蛋白

M.蛋白质分子质量标准;1.抗3ABC阳性大鼠血清;2.阴性大鼠血清
3 结论与讨论
SVV是一种新发猪病毒病,目前关于SVV疫苗和免疫诊断研究的报道相对较少。SVV与FMDV属于同科病毒,基因和蛋白质结构比较相似,因此,SVV的疫苗类型和免疫诊断产品与FMDV相似[6,17]。FMDV 3ABC抗体诊断试剂盒在FMDV的诊断,尤其是野毒感染与疫苗免疫鉴别诊断中发挥着非常重要的作用[18]。因此,本试验对SVV3ABC基因进行表达,并制备其多克隆抗体,以期为进一步研发SVV 3ABC抗原或抗体诊断试剂盒提供基础。
本试验首先克隆了SVV的3ABC基因,其大小为969 bp,并构建了重组质粒pET30a(+)-3ABC,将该重组质粒转入大肠杆菌感受态细胞,在IPTG为0.5 mmol/L、37 ℃条件下诱导6 h时,3ABC重组蛋白实现了高效表达。在表达条件多次优化后,该融合蛋白仍主要以包涵体形式存在,这对融合蛋白的纯化增加了难度。或许这与蛋白质本身的特性有关,后期可以通过考虑选取某一段进行表达,实现可溶性表达,易于获取有效抗原。本试验通过切胶纯化的重组3ABC蛋白免疫大鼠制备的多克隆抗体具有良好的反应性和较高的滴度。切胶纯化虽然简便易于操作,但不易大量纯化抗原,因此,在后期研究中应该建立包涵体纯化方法。
本研究首次表达了SVV 3ABC,可能与所用原核表达载体、感受态细胞、3ABC基因密码子未优化等有关,未能实现3ABC基因的可溶性表达,这对目的蛋白纯化造成一定的困难。后续仍需调整实验方案实现3ABC基因可溶性高效表达,为进一步研发SVV 3ABC蛋白和抗体的检测产品奠定基础。
