设施内外春美桃果实有机酸含量及柠檬酸代谢酶活性差异研究
2020-02-05尹宝颖李中勇庞锦轩贾秋蕊张学英徐继忠
尹宝颖,马 宏,李中勇,庞锦轩,贾秋蕊,张学英,徐继忠
(1.河北农业大学 园艺学院,河北 保定 071000; 2.保定市农业生态园管理处,河北 保定 071000;3.迁西县林业局,河北 迁西 064300)
桃果外表色泽艳丽,营养丰富,口感细腻,深受消费者喜爱。设施桃栽培可以实现桃果提前上市,满足市场需求,因此桃已成为目前设施果树栽培的主要树种[1],但由于设施内环境与露地环境存在差异,设施内栽培的桃树果实普遍存在口感不佳、低糖高酸的现象[2]。有机酸是果实中酸的主要成分,果实中不同的有机酸种类、含量和比例是决定果实风味品质的重要基础[3]。有关果实中有机酸含量、组分及其相关酶活性变化已在苹果、梨、杏、李、蓝莓、枣、葡萄等树种上有研究报道[4-9]。赵永红等[10]认为,设施油桃果实中有机酸组分主要为苹果酸和柠檬酸,随着果实生长发育,苹果酸含量呈现先上升后下降的趋势,柠檬酸含量呈平稳上升的趋势。但有关设施内外有机酸含量差异报道较少。果实中有机酸含量的变化与相关酶活性的变化关系密切,已有相关研究表明,影响果实有机酸含量变化的主要酶包括磷酸烯醇式丙酮酸羧化酶(PEPC)、苹果酸酶(ME)、苹果酸脱氢酶(MDH)、柠檬酸合成酶(CS)、异柠檬酸脱氢酶(IDH)和乌头酸酶(ACO)[11-12]。前人认为有机酸类型不同的果实中有机酸合成酶和代谢酶的活性存在很大差异[13]。本研究分析设施内外春美桃果实不同时期的有机酸含量、组分以及相关酶的活性变化,为改善设施内春美桃果实品质提供理论依据。
1 材料和方法
1.1 试验材料
试验材料选取自河北省顺平县桃树栽培基地,该基地主栽品种为春美桃,露地树龄为5 a,树形为三主枝开心形,株行距为1.5 m×3.0 m,试验园整体管理水平高;选取长势一致、生长健壮的树为试验树。设施内桃树树龄为5 a,树形为纺锤形,株行距为1.0 m×2.0 m,试验园整体管理水平高。于盛花后第5周开始,每周取样1次,在每棵树外围中上部的4个方向各采果1个,共采集5棵树,采后将果肉立即放入液氮冷冻,然后保存于-80 ℃的超低温冰箱备用。
1.2 方法
1.2.1 可滴定酸含量的测定 采用标准NaOH溶液滴定法[14]测定可滴定酸含量。
1.2.2 有机酸含量的测定 先将桃果实去皮去核取果肉,准确称取3 g果肉,放入研钵,研磨至匀浆转移到10 mL离心管中,加入超纯水至刻度,放入超声振荡清洗机中超声30 min,然后放入离心机中,在10 000 r/min、4 ℃下离心30 min,取出上清液经0.45 μm滤膜过滤到1.5 mL进样小瓶中,上机测定。
采用液相色谱法测定。色谱仪为Agilent 1260 高效液相色谱仪(安捷伦科技有限公司),带紫外检测器。测定条件:Hypersil ODS2色谱柱(4.6 mm×250 mm,5 μm),流动相为KH2PO4(0.02 mol/L,pH值2.4),流速0.8 mL/min,柱温40 ℃,进样量10 μL,检测波长210 nm。
1.2.3 相关酶活性的测定
1.2.3.1 酶液的制备 参考HIRAI[15]和李雪梅[16]的方法,略有改动。取3 g果肉用3 mL研磨液在冰浴下研磨,4 000 r/min离心20 min,取上清液定容至5 mL,其中2 mL于4 ℃、15 000 r/min离心15 min,取上清液用提取缓冲液定容至4 mL,即得细胞质乌头酸酶(Cyt-ACO)酶液;沉淀用提取液定容至2 mL,用于测定烟酰胺腺嘌呤二核苷酸-异柠檬酸脱氢酶(NAD-IDH)活性。另外3 mL加入等体积提取液,取其中4 mL在大量透析液(即提取缓冲液)中4 ℃透析过夜,即得PEPC、CS酶液。各项操作均在0~4 ℃下进行。
研磨缓冲液:0.2 mol/L Tris-HCl(pH值8.2)、0.6 mol/L蔗糖、10 mmol/L异抗坏血酸;提取缓冲液:0.2 mol/L Tris-HCl(pH值8.2)、10 mmol/L 异抗坏血酸、0.1% TritonX-100。
1.2.3.2 酶活性的测定 参考HIRAI[15]和罗安才等[17]的方法。测定的反应体系为3 mL,各种酶活性分析反应体系:PEPC反应液含0.8 mol/L Tris-HCl(pH值8.5) 300 μL、0.01 mol/L还原型谷胱甘肽(GSH) 150 μL、3 mmol/L还原型烟酰胺腺嘌呤二核苷酸(NADH) 150 μL、0.04 mol/L MgCl2150 μL、0.2 mol/L KHCO3150 μL、酶液500 μL、4 mmol/L磷酸烯醇式丙酮酸(PEP) 1 600 μL,紫外波长 340 nm。CS反应液含0.8 mol/L Tris-HCl (pH值9.0) 300 μL、0.8 mmol/L 5,5′-二硫代双(2-硝基苯甲酸)(DTNB) 150 μL、0.8 mmol/L乙酰辅酶A(acetyl-CoA) 150 μL、超纯水300 μL、酶液800 μL、0.08 mol/L草酰乙酸(OAA) 1 300 μL,紫外波长 412 nm。NAD-IDH反应液含0.8 mol/L Hepes (pH值9.0) 300 μL、4 mmol/L MnSO4150 μL、16 mmol/L NAD 150 μL、超纯水600 μL、酶液1 200 μL、20 mmol/L异柠檬酸钠600 μL,紫外波长为340 nm。ACO反应液含0.8 mol/L Tris-HCl(pH值7.5)300 μL、2 mmol/L NaCl 150 μL、超纯水450 μL、酶液1 200 μL、2 mmol/L乌头酸900 μL,紫外波长为340 nm,测定前酶液用等体积2 mmol/L GSH在30 ℃共培养1 h。加入反应底物后立即用UV-2450型紫外分光光度计测定吸光度,以5 s为单位扫描3 min,记录吸光度变化,重复3次,以每分钟吸光度变化0.01为1个酶单位。
2 结果与分析
2.1 设施内外桃果实可滴定酸含量的变化
由图1可知,设施内外桃果实可滴定酸含量均呈现先升高后降低的趋势,设施内果实可滴定酸含量是从盛花后第5周开始一直升高,到盛花后第8周达到峰值(1.35%),然后下降,到盛花后第9~10周含量稍有升高,然后一直到成熟采收呈下降趋势,成熟时果实可滴定酸含量为0.49%。露地果实可滴定酸含量从盛花后第5周开始呈上升趋势,到盛花后第6周可滴定酸含量达到最高值(1.00%),然后一直下降直到成熟采收,成熟时果实可滴定酸含量为0.27%。通过显著性分析可知,盛花后第6周之前,设施内桃果实可滴定酸含量显著低于露地,盛花后第7~12周,设施内桃果实可滴定酸含量均显著高于露地桃果实。
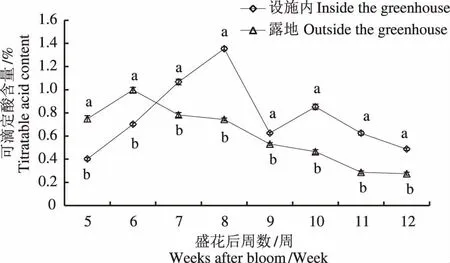
不同小写字母表示同一时期设施内外差异显著(P<0.05),下同
2.2 设施内外桃果实有机酸含量的变化
2.2.1 苹果酸含量 设施内桃果实苹果酸含量呈先升高再降低的趋势,在盛花后第6周达到最大值,为1.62 g/L,然后到盛花后第8周苹果酸含量基本平稳,从盛花后第9周开始苹果酸含量急速下降,到成熟时设施内桃果实苹果酸含量为0.73 g/L。露地桃果实苹果酸含量呈先升高后下降再升高的趋势,到盛花后第6周达到最高值(0.95 g/L),然后开始下降,到盛花后第9周下降到最低值(0.16 g/L),之后到盛花后第12周苹果酸含量一直升高,到成熟采收时为0.56 g/L。整个生长发育过程中设施内桃果实苹果酸含量一直显著高于露地桃果实(图2A)。
2.2.2 柠檬酸含量 设施内和露地桃果实柠檬酸含量均呈先升高后降低的变化趋势。设施内桃果实柠檬酸含量在盛花后第5周开始呈上升趋势,第9周达到最大值(0.59 g/L),经过2周的平稳期后开始迅速下降,到盛花后第12周下降到0.37 g/L。露地桃果实柠檬酸含量于盛花后第5周开始升高,盛花后第7周升高到最大值(0.65 g/L),之后柠檬酸含量显著降低,盛花后第12周达到最低值(0.15 g/L)。果实发育过程中,盛花后第5~8周桃果实柠檬酸含量均为露地显著高于设施内,盛花后第9~12周均为设施内桃果实柠檬酸含量显著高于露地桃果实(图2B)。
2.2.3 奎宁酸和莽草酸含量 设施内外桃果实奎宁酸含量总体呈先升高后降低的趋势(图2C)。设施内桃果实奎宁酸含量在盛花后第5~8周缓慢升高,第8周达到最大值(1.79 g/L),后期显著降低,盛花后第12周桃果实中奎宁酸含量达到最小值(0.34 g/L)。露地桃果实奎宁酸含量在盛花后第5~7周变化较平稳,盛花后第7周桃果实奎宁酸含量开始显著降低,盛花后第9周下降到0.31 g/L,后期变化缓慢。果实发育过程中,盛花后第8周之后设施内桃果实奎宁酸含量均显著高于露地桃果实。
设施内外桃果实莽草酸含量整体呈下降趋势。设施内桃果实莽草酸含量由盛花后第5周(0.066 g/L)开始下降,盛花后第12周,果实莽草酸含量为0.024 g/L。露地桃果实中莽草酸含量在盛花后第5周开始降低,到盛花后第9周下降到最低值(0.016 g/L),盛花后第10周开始到果实成熟采收,莽草酸含量略有升高,但差异不显著。在整个桃果实生长发育期,设施内桃果实中莽草酸含量均显著高于露地桃(图2D)。
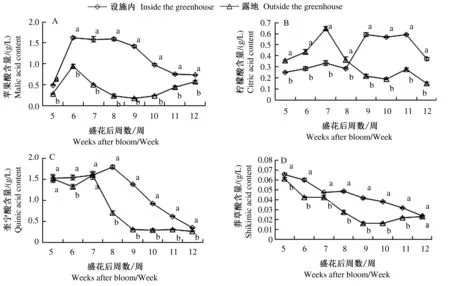
图2 设施内外桃果实有机酸含量的变化Fig.2 Changes of organic acid content inside and outside the greenhouse
2.2.4 设施内外桃成熟果实中各酸组分所占比例 由表1可知,设施内外桃果实成熟时,苹果酸所占比例最高,分别为49.62%和56.47%,说明春美桃是苹果酸型果实。设施内成熟桃果实柠檬酸含量所占比例高于露地桃,同时也高于设施内桃奎宁酸所占比例,而露地桃果实奎宁酸所占比例高于柠檬酸。设施内外成熟桃果实莽草酸所占比例均较低。
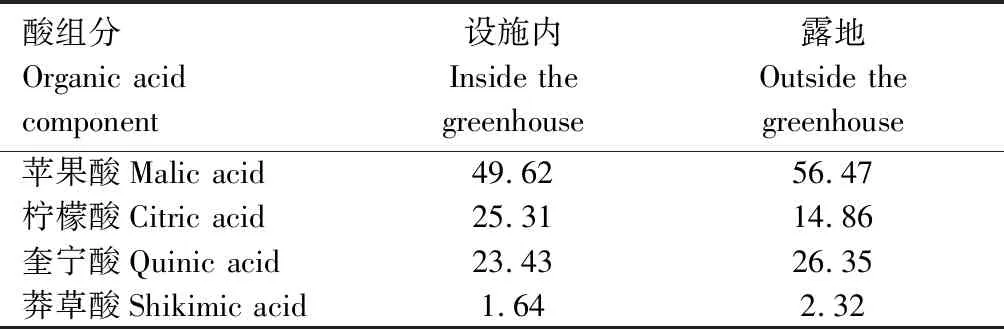
表1 设施内外桃成熟果实中各酸组分所占比例Tab.1 The proportion of acid components in the mature peach fruit inside and outside the greenhouse %
2.3 设施内外桃果实柠檬酸代谢相关酶活性的变化
设施内桃果实PEPC活性在盛花后第11周之前总体呈上升趋势,第11周达到最大值,为42.37 U/(g·min),在果实成熟采收时降至最低;露地桃果实PEPC活性在盛花后第6周达到最高值[30.59 U/(g·min)],然后急剧下降至盛花后第7周,此时设施内外桃果实PEPC活性差异不显著,盛花后第7周至果实采收时PEPC活性变化幅度不大。设施内外桃果实PEPC活性差异比较表明,整个生长发育过程中除盛花后第5、7、12周外,设施内桃果实PEPC活性均显著高于设施外桃果实(图3A)。
设施内桃果实CS活性呈双峰变化的趋势(图3B),首个高峰出现在盛花后第8周,峰值为3.58 U/(g·min),此时桃果实CS活性显著高于露地桃果实,第8周后迅速降低,到盛花后第10周达到第2个峰值,为2.64 U/(g·min),此时桃果实CS活性显著高于露地桃果实。露地桃果实CS活性整体呈先升高后降低的趋势,盛花后第6周达到最高值[2.49 U/(g·min)],后期缓慢降低,盛花后第11周CS活性达到最低值,为0.39 U/(g·min),显著低于设施内桃果实。
设施内外桃果实NAD-IDH活性均呈先上升后降低的趋势,且均在盛花后第8周达到最大值,分别为1.00、0.97 U/(g·min),差异不显著,第8周前设施内外NAD-IDH活性虽有变化,但变化幅度较小,设施内NAD-IDH活性显著高于露地桃果实,第8周后设施内外桃果实中NAD-IDH活性均显著降低,但设施内外差异不显著(图3C)。
设施内外桃果实Cyt-ACO活性在整个生长期均呈先下降后升高再下降的变化趋势。盛花后第5~7周设施内外果实Cyt-ACO活性均有小幅度下降,但设施内外差异不显著,第7周后设施内外桃果实Cyt-ACO活性呈上升趋势,盛花后第9周达到最大值,分别为0.81、1.47 U/(g·min)。此时设施内桃果实Cyt-ACO活性显著低于露地桃果实,第9周后设施内外桃果实中Cyt-ACO活性均呈下降趋势,且设施内桃果实中Cyt-ACO活性高于露地桃果实(图3D)。
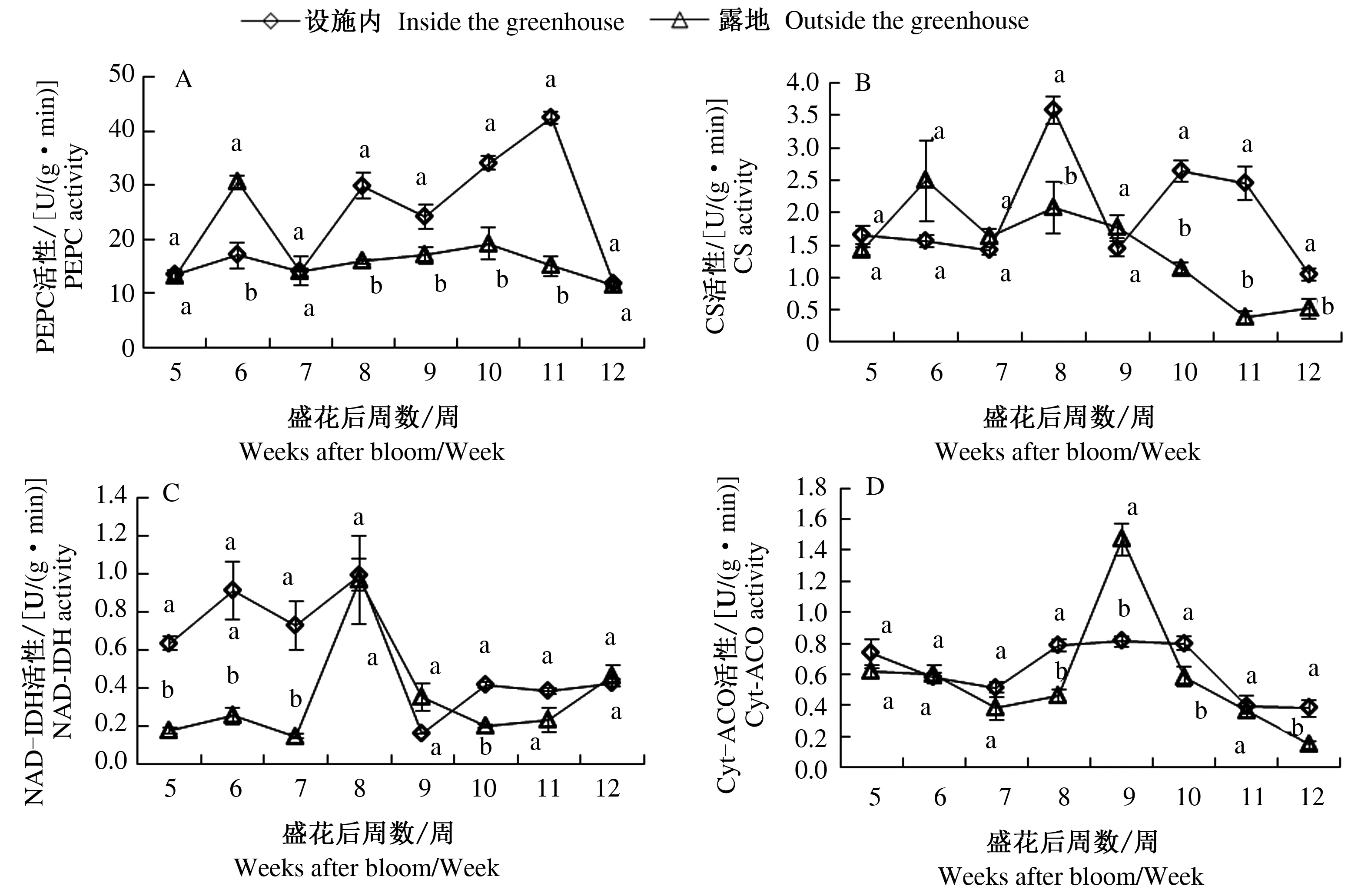
图3 设施内外桃果实柠檬酸代谢相关酶活性的变化Fig.3 Changes of emzyme activities of citric acid inside and outside the greenhouse
2.4 设施内外桃果实柠檬酸含量与代谢相关酶活性间相关性分析
由表2可知,设施内桃果实柠檬酸含量与PEPC和CS活性呈正相关,其中,与PEPC活性呈显著正相关(r=0.690*),与NAD-IDH和Cyt-ACO活性呈负相关,其中,与NAD-IDH活性呈极显著负相关(r=-0.820**),表明设施内桃果实中PEPC活性升高可以促进柠檬酸的积累;露地桃果实中柠檬酸含量与PEPC和CS活性呈正相关,与NAD-IDH和Cyt-ACO活性呈负相关,但均未达到显著水平。
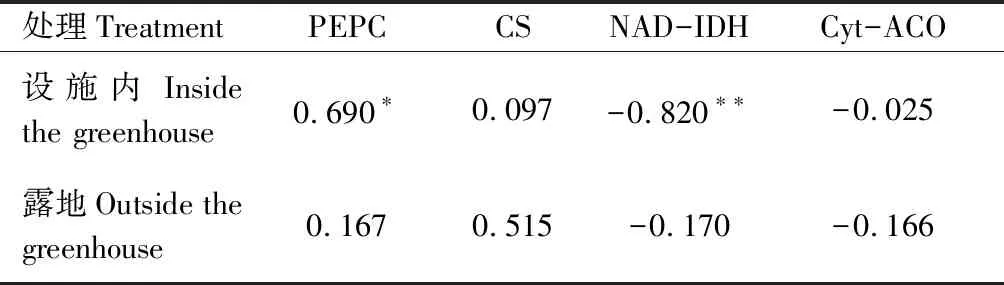
表2 柠檬酸含量与代谢相关酶活性间相关性分析Tab.2 Analysis of correlation between the content of citric acid and the metabolism enzyme activities
注:*、**分别表示0.05、0.01相关水平。
Note: * and ** mean significant at 0.05 and 0.01 levels.
3 结论与讨论
对杨梅[18]、柑橘[19]等的研究结果表明,设施栽培对果实品质有重要的影响,设施内外果实中酸含量有差异,从而影响了果实的风味形成。本研究以春美桃为试材,结果表明,设施内外桃可滴定酸含量变化趋势相同,设施内早期(盛花后第6周前)果实中可滴定酸含量低于露地果实,后期高于露地果实,到采收时可滴定酸含量高于露地果实。关于设施内外不同环境对果实有机酸含量影响的原因,钱皆兵等[20]认为,设施内外土壤理化性质不同,设施内土壤的全盐量明显高于露地土壤,氮、磷、钾含量比露地略有升高,因此设施内外果实有机酸含量不同。赵雪惠等[21]研究表明,对设施内的油桃补充蓝光降低了油桃有机酸含量。马凯等[22]研究表明,设施内通过人工加富CO2可以提高果实品质。
果实中的有机酸含量是果实风味品质的重要指标之一,不同种类果实有机酸组成及其含量存在显著差异。在本试验中发现,设施内外春美桃果实有机酸组分有苹果酸、柠檬酸、莽草酸和奎宁酸,其中苹果酸含量分别占有机酸含量的49.62%和56.47%,是春美桃果实的主要有机酸。但果实成熟时设施内春美桃果实柠檬酸所占比例明显升高,设施内外总酸含量相差0.47 g/L,其中,苹果酸含量的差异占总差异的34.94%,柠檬酸含量的差异占总差异的47.67%,说明设施内外柠檬酸含量的差异是造成果实成熟时酸味差异的主要原因。本研究还发现,桃果实柠檬酸含量整体呈先升高后降低的趋势,果实发育前期露地果实柠檬酸含量显著高于设施内果实,果实发育后期露地果实柠檬酸含量显著低于设施内。果实有机酸含量的高低由果实生长发育过程中有机酸合成和降解共同决定[23-24]。有研究表明,在胞质中PEPC催化磷酸烯醇式丙酮酸β-羧化生成OAA,OAA在MDH作用下产生苹果酸。OAA和苹果酸进入三羧酸循环(TCA)生成柠檬酸和其他代谢产物[25]。本研究结果表明,整个生长发育过程中设施内桃果实PEPC活性显著高于露地果实。相关性分析表明,设施内PEPC活性与柠檬酸含量存在显著正相关关系,设施外PEPC活性与柠檬酸含量存在正相关关系,但不显著,说明PEPC活性对设施内柠檬酸含量的影响大于露地。此结果与MOING等[26]的PEPC有效促进了桃发育过程中有机酸的合成和积累的研究结果相符。相关性分析还表明,设施内外桃果实CS活性与柠檬酸含量呈正相关关系,但均不显著,NAD-IDH和Cyt-ACO活性与柠檬酸含量呈负相关关系,其中设施内桃果实NAD-IDH活性与柠檬酸含量呈显著负相关关系,其余相关性不显著,说明PEPC和CS促进柠檬酸的积累,而NAD-IDH和Cyt-ACO促进柠檬酸的降解,这与前人在枣[27]、果梅[28]、山葡萄[29]上的研究结果一致。果实发育前期,设施内桃果实NAD-IDH活性显著高于露地果实,导致设施内桃果实柠檬酸降解速度大于露地果实,从而使设施内桃果实柠檬酸含量显著低于露地果实。果实发育后期,设施内桃果实PEPC和CS活性显著高于露地,而NAD-IDH活性仅在盛花后第10周差异显著,致使设施内柠檬酸合成量高于露地,从而使设施内桃果实柠檬酸含量显著高于露地桃果实,说明桃果实发育前期NAD-IDH活性对柠檬酸含量的调控作用较大,而果实发育后期PEPC和CS活性对柠檬酸含量调控作用较大。
综上所述,春美桃果实为苹果酸型果实,但成熟期设施内外桃果实有机酸含量的差异主要由柠檬酸引起,设施内桃果实PEPC活性和果实发育后期CS活性较高是导致设施内桃果实酸性较高的主要原因。
