玉米脱落酸受体ZmPYL9基因的克隆及功能探究
2020-02-05王延召鲁晓民魏良明
王延召,鲁晓民,魏良明,周 波,黄 保
(河南省农业科学院 粮食作物研究所,河南 郑州 450002)
植物通过复杂的调控网络来应对干旱胁迫,如气孔关闭、诱导干旱响应基因应答等。其中,脱落酸(ABA)作为重要的植物激素之一,参与植物多种生理过程,且对植物适应多种非生物胁迫具有重要的调控作用[1]。干旱胁迫刺激ABA的生物合成[2-3],但是一直以来对ABA受体的研究较缓慢。RAZEM等[4]通过放射性同位素方法验证了ABA与FCA蛋白的结合,但RISK等[5]研究证实FCA蛋白并不结合ABA。LIU等[6]研究表明,G蛋白偶联受体与ABA结合[7],但RISK等[5]质疑这一结论。PANDEY等[8]提出,GTGs膜蛋白可以结合ABA,但仍需要大量的代表性试验来证实。直到2009年,PYR1基因被鉴定出来,同时证明PYL蛋白与ABA结合,引起构型变化,从而抑制下游PP2C蛋白的磷酸化活性,进而调节植物的生长发育[9];之后MA等[10]利用酵母杂交也筛选到可与HAB1(Protein phosphatase 2C16)结合的PYL5、PYL6、PYL8蛋白。
PYL蛋白被证实是ABA的直接受体后,在拟南芥中鉴定出PYL蛋白家族有14个成员,被分为3个亚家族[11],随后,在水稻[12]、草莓[13]、黄瓜[14]、玉米[15]中分别鉴定出12、9、11、13个PYL蛋白,参考拟南芥PYL蛋白家族成员分类将其分为3个亚家族。但不同PYL蛋白的存在形式不同,PYL4、PYL5、PYL6、PYL8、PYL9、PYL10等以单体形式存在,而PYL1、PYL2等以二聚体形式存在。在功能方面,拟南芥中已有报道,除AtPYL13外,其他基因均可激活植物体内ABA下游相关基因的表达[16];此外,水稻上亦有报道,OsPYL能够正向调控ABA信号,提高水稻抗旱和抗盐碱能力[17-18]。
玉米作为重要的粮食作物,经常受到干旱的影响,产量和粮食安全受到严重威胁。ABA在植物抵御逆境胁迫中具有重要功能,但目前对ABA受体PYL蛋白的功能报道多集中在拟南芥和水稻上,玉米上关于ABA和干旱胁迫诱导对PYL蛋白的影响报道甚少。鉴于此,以玉米为材料,克隆了一个PYL家族基因(Zm00001d010445),暂时命名为ZmPYL9,分析ZmPYL9编码蛋白质的进化关系、表达模式及其对干旱胁迫和ABA诱导的响应情况,并了解该基因的启动子顺式作用元件,预测该基因特异结合目标靶基因的DNA片段等,旨在为PYL蛋白家族基因在玉米逆境胁迫和ABA传导中的作用研究提供参考,为抗逆性强的种质资源筛选提供依据,最终为挖掘抗旱优质资源、培育抗旱型玉米品种奠定基础。
1 材料和方法
1.1 材料及处理
试验材料为河南省农业科学院粮食作物研究所提供的抗旱性强的玉米自选系郑H71。取大田正常生长的郑H71抽雄期的根、茎、芽、叶、雄穗、雌穗、花粉、胚、胚乳,作为测定ZmPYL9基因时空表达的样品。将郑H71籽粒播种于营养土,生长至一叶一心时将幼苗从营养土中转移至Hoagland营养液(pH值5.8)中,置于30 ℃光照培养16 h、26 ℃暗培养8 h,相对湿度为40%~55%的温室中进行水培。当郑H71长至三叶一心时,挑选长势一致的玉米苗分别转移至以下营养液中进行处理:Hoagland营养液(CK)、Hoagland营养液+20% PEG、Hoagland营养液+100 μmol/L ABA、Hoagland营养液+20% PEG+100 μmol/L ABA,分别在处理6、12 h时取各处理幼苗叶片,然后将各处理幼苗转移至新鲜的Hoagland营养液中,恢复48 h后再次取各处理幼苗叶片。以上所有大田和室内样品5株相同部位叶片混合为1个样品,每个样品3个生物学重复,且取样后迅速将其放入液氮,存于-80 ℃超低温冰箱。
1.2 玉米总RNA提取及cDNA合成
利用EasyPure RNA Purification Kit提取郑H71每个样品的总RNA,然后根据TansScript One-Step gDNA Removal and cDNA Synthesis试剂盒说明书所提供的程序进行反转录,合成cDNA。
1.3 ZmPYL9基因cDNA的克隆
用BLAST在线工具搜索ZmPYL9基因序列,设计特异扩增引物(ZmPYL9-F:5′-ATGGTGGGTCTCGTCGGC-3′和ZmPYL9-R:5′-TCACTGATCGATCAGCGACG-3′),以反转录的cDNA为模板进行扩增,然后将扩增产物连接pMD19-T并转化大肠杆菌DH5α感受态,挑选阳性单克隆送武汉奥科鼎盛生物科技有限公司测序,并利用NCBI数据库比对测序结果。
1.4 ZmPYL9基因的生物信息学分析
使用在线工具MG2C绘画玉米数据库中的PYL基因在染色体上的分布;利用在线EXPASY中的Protparam对ZmPYL9基因所编码蛋白质的等电点(pI)、分子质量(MW)、稳定性、疏水性等属性进行计算;分别利用TMHMM Server和SOPMA网站对ZmPYL9蛋白的跨膜结构和二级结构进行分析,使用ExPASy网站的NetPhoS预测ZmPYL9蛋白的磷酸化位点;采用Plantcare预测ZmPYL9基因启动子的顺式作用元件;利用MEGA软件中的NJ法构建ZmPYL9蛋白与其他物种同源蛋白质的系统发育树;使用MEME在线分析ZmPYL9蛋白的保守基序(Motif),基序的最大数目设置为8。
1.5 ZmPYL9基因的表达分析
采用qRT-PCR定量分析不同部位和不同处理玉米样品ZmPYL9基因的表达,设计基因序列特异荧光引物(ZmPYL9-QF:5′-TCGTCAAGCACATCAAGG-3′和ZmPYL9-QR:5′-AGGCCGGTCTTGACGTTGA-3′);以玉米18S为内参,设计引物18S1:5′-CCTGCGGCTTAATTGACTC-3′,18S2:5′-GTTAGCAGGCTGAGGTCTGG-3′。利用CFX96实时荧光定量PCR仪(Bio-Rad,USA),参考SYBR Premix Ex TaqTM(TaKaRa,Japan)试剂盒程序,采用两步法进行Real-time PCR。根据2-△△CT(△CT=CT目标基因-CT内参基因,△△CT=△CT处理后-△CT对照)法进行数据处理。
2 结果与分析
2.1 PYL基因家族在玉米染色体上的分布
图1显示了PYL家族基因在玉米10条染色体上的定位。从图1发现,除了第7和第10染色体外,PYL家族基因随机分布在8条染色体上,没有特殊的染色体偏好。

图1 ZmPYL基因家族在玉米染色体上的分布
2.2 ZmPYL9基因的克隆和蛋白质结构分析
利用RT-PCR技术扩增ZmPYL9基因,得到大小为600 bp左右的特异条带(图2),回收并测序。分析测序结果发现,该序列包含一个完整的594 bp开放阅读框,编码197个氨基酸,与全基因组序列已经公布的玉米自交系B73的序列一致。
蛋白质结构分析发现,ZmPYL9分子质量为21.79 ku,理论等电点为 5.69,GRAVY值为-0.249,属于亲水性蛋白质;跨膜螺旋区分析结果显示,ZmPYL9蛋白无跨膜结构域;SOPMA预测显示,ZmPYL9蛋白无规则卷曲(L)占35.53%,β折叠(E)占3.55%,α螺旋(H)占43.65%,该蛋白质结构以α螺旋为主;NetPhoS分析显示,ZmPYL9蛋白含有8个丝氨酸磷酸化位点、8个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点,说明ZmPYL9蛋白可能主要受丝氨酸和苏氨酸蛋白激酶激活,从而调控下游靶基因的表达,参与植物的生长发育、信号传导及逆境胁迫响应过程。
2.3 ZmPYL9蛋白的进化及保守基序分析
为了揭示玉米ZmPYL9基因的进化关系,利用NJ法构建ZmPYL9蛋白序列与其他单子叶和双子叶植物同源蛋白质的进化树(图3),分析发现,ZmPYL9蛋白与单子叶植物高粱同源蛋白质的进化关系最为紧密,与双子叶植物大豆和胡桃木的进化关系较远。为了进一步分析ZmPYL9蛋白及其他物种同源蛋白质的保守性,利用MEME软件共鉴定了8个保守基序。由图3可知,玉米与高粱不仅同源性较高,且在相同的氨基酸位置含有相同的6个保守基序;与大豆和胡桃木的进化较远,其含有的保守基序相差较大。说明进化关系密切的物种保守功能基序也较为一致。
M为Trans5K DNA Marker,泳道1为ZmPYL9基因PCR扩增产物

8种颜色代表8个不同的保守基序;Zm00001d010445代表玉米;Sb09g006700代表高粱;Bradi2g32250代表二穗短柄草;AT5G53160代表拟南芥;LOC Os05g12260代表水稻;Pavir.Ca00496代表柳枝稷;Seita.3G076200代表谷子;Pahal.C00916代表胡桃木;Glyma07g06270代表大豆Eight colors represent eight different conservative motifs;Zm00001d010445 stands for Zea mays L.;Sb09g006700 stands for Sorghum bicolor (Linn.) Moench;Bradi2g32250 stands for Brachypodium distachyum (L.) Beauv.;AT5G53160 stands for Arabidopsis;LOC Os05g12260 stands for Oryza latifolia Desv.;Pavir.Ca00496 stands for Panicum virgatum Linn.;Seita.3G076200 stands for Setaria italica (L.) Beauv.;Pahal.C00916 stands for walnut;Glyma07g06270 stands for Glycine max (Linn.) Merr.图3 ZmPYL9蛋白与其他物种同源蛋白的进化树及保守基序
2.4 ZmPYL9基因启动子顺式元件分析
为了进一步解析ZmPYL9的潜在功能,分析ZmPYL9基因ATG上游2 000 bp的顺式响应元件(表1),发现该基因含有多种功能元件,除了启动子本身核心元件TATA-box、CAAT-box外,还包含如ARE、AuxRR-core、CGTCA-motif、DRE core、ERE、GC-motif、STRE、TCA-element等结合位点。其中,ARE和GC-motif是厌氧诱导必不可少的响应元件;AuxRR-core属于生长素响应因子,在胚乳、子叶和侧根发育中起重要作用;CGTCA-motif和TCA-element参与茉莉酸和水杨酸信号途径;DRE core、ERE和STRE响应多种非生物胁迫。另外,还发现大量光刺激应答元件(AT1-motif、GA-motif、Sp1)。推测ZmPYL9不仅响应逆境胁迫和激素信号传导途径,可能还参与植物光合作用和调控植物开花等光反应。
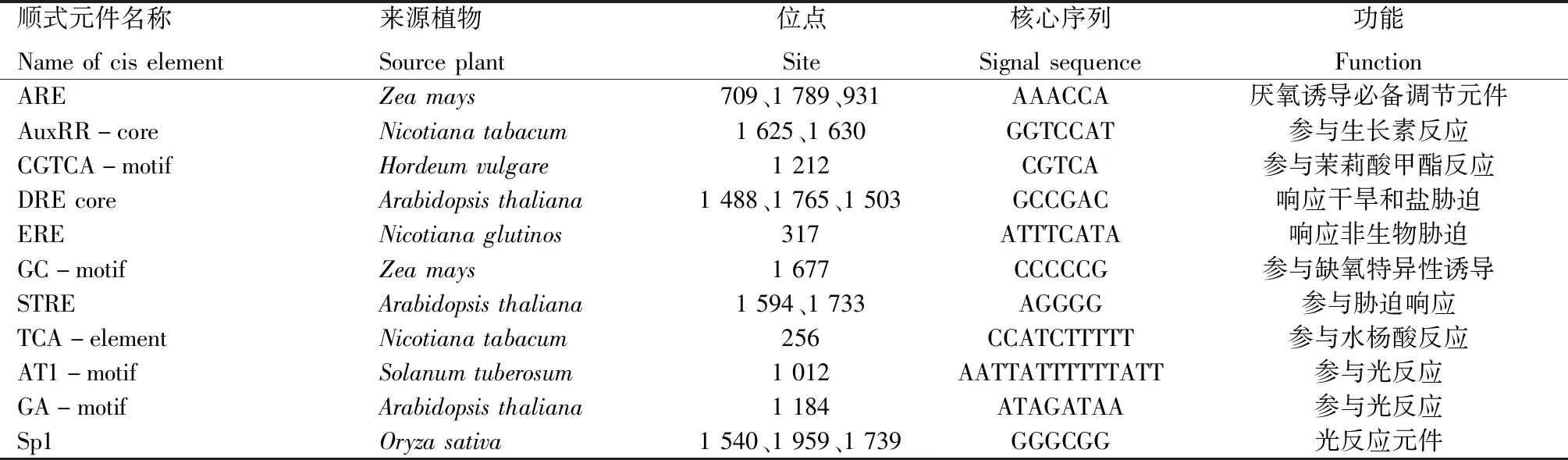
表1 ZmPYL9基因启动子顺式元件分析Tab.1 The cis element analysis of ZmPYL9 gene promoter
2.5 ZmPYL9基因的组织表达模式分析
为了解ZmPYL9基因的表达模式,利用qRT-PCR分析该基因在不同组织中的表达情况(图4),结果显示,ZmPYL9基因在根、茎、叶、雌穗、雄穗、花粉、胚、胚乳中均有表达,但在胚乳中表达量最高,其次是雄穗和根。可见,ZmPYL9基因属于组成型表达基因,但在不同部位的表达量存在一定的差异。
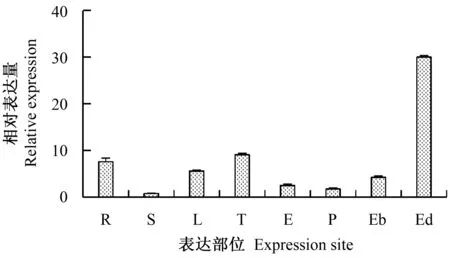
R.根;S.茎;L.叶;T.雄穗;E.雌穗;P.花粉;Eb.胚;Ed.胚乳
2.6 ZmPYL9基因对PEG胁迫和ABA诱导的响应模式
由图5可见,ABA诱导6、12 h时,ZmPYL9表达量均高于CK,但恢复48 h后ZmPYL9相对表达量低于CK;PEG和PEG+ABA胁迫6、12 h时,ZmPYL9表达量均低于CK,但恢复48 h后ZmPYL9表达量上升且PEG胁迫处理的ZmPYL9表达量远高于CK;同时发现,ABA+PEG胁迫较PEG胁迫提高了该基因的表达量,也就是说外源ABA可以提高干旱胁迫下ZmPYL9基因的表达量。说明ZmPYL9基因响应干旱胁迫和ABA诱导,且受ABA的正向诱导,受PEG和PEG+ABA胁迫的负向诱导。

图5 ZmPYL9基因响应干旱胁迫和ABA诱导模式
3 结论与讨论
玉米是重要的粮食、饲料、加工原料等,其需求量越来越大。近年来,干旱导致的玉米产量下降已成为急需解决的严峻问题。筛选抗旱玉米种质资源并挖掘其自身的抗旱优质分子资源是一条有效的解决手段。植物可通过ABA信号途径应对干旱胁迫,如关闭气孔、诱导干旱基因应答等方式。PYL基因作为ABA受体,直接影响ABA的生物合成。目前,关于玉米PYL家族基因的抗旱功能研究报道甚少,基于此,本研究克隆了一个ZmPYL9基因,编码197个氨基酸,蛋白质结构主要以α螺旋为主,且该蛋白质可能主要被丝氨酸和苏氨酸蛋白激酶激活,从而调控下游靶基因的表达,参与植物的生长发育和逆境胁迫响应过程。系统进化及保守基序分析发现,ZmPYL9蛋白与高粱不仅同源性较高,且基序一致,进化关系较为紧密;与大豆和胡桃木的进化关系较远,含有的保守基序相差较大。说明物种间的进化关系与其保守功能基序较为一致。
本研究分析发现,ZmPYL9基因启动子区域存在多个顺式元件,说明ZmPYL9基因的表达可能受多种转录因子的调控,且这些转录因子与多种信号途径相关。这些顺式元件包含生长素、茉莉酸、水杨酸等多种激素的应答元件,说明ZmPYL9基因的表达除响应ABA外,还受其他激素的调节,参与多种激素信号转导网络。但前人研究表明,与激素应答相关的顺式元件存在冗余的可能,这一结论在水稻和拟南芥上均有验证[19]。
本研究发现,ZmPYL9基因在玉米多个组织中均存在表达,说明该基因属于组成型表达基因。该结果与拟南芥AtPYL3、AtPYL10、AtPYL11、AtPYL12和AtPYL13的研究结论一致[20],但与AtPYL8[21]不同。SAAVEDRA等[21]研究表明,AtPYL8基因表达具有时空特异性,只在根中表达,说明PYL家族基因在表达模式上有所区别。
ZmPYL9基因正向响应外源ABA诱导,而恢复正常培养后,该基因表达量急速下降且低于CK,说明ZmPYL9基因确实参与ABA信号途径;ZmPYL9基因被PEG和PEG+ABA负向诱导,且PEG+ABA胁迫下表达量高于PEG胁迫,而恢复正常培养后,2种胁迫下ZmPYL9表达量均表现上升趋势,说明ZmPYL9基因响应干旱胁迫,且ABA可以提高干旱胁迫下该基因的表达量。前人对PYL家族基因的功能研究发现,OsPYL5过表达的转基因水稻产量降低[18];AtPYL4基因过表达导致拟南芥幼苗的莲座叶变小[22];AtPYL5、AtPYL8和AtPYL9的过量表达不仅能够显著提高植物在种子萌发、幼苗生长等阶段对ABA的敏感性,而且还能提高植物的抗旱能力[21,23]。这些结果表明,转PYL基因虽提高了植物的抗旱性,但也会带来一些不良影响,因此在转基因的过程中要尽可能地不影响植物的其他优良性状。
