乙草胺胁迫对水华微囊藻光合生理特性的影响
2020-02-03李俊杰李玲黄沛玲
李俊杰,李玲,黄沛玲
华侨大学化工学院,厦门 361021
乙草胺(ACT)是一种氯乙酰胺除草剂,能够在杂草出苗前或出苗后施用,能被根和叶子吸收,可抑制光合作用的电子传递,是我国最广泛使用的除草剂之一[1]。ACT施用后会通过灌溉侵蚀或雨水和地表径流冲刷进入水生环境中造成污染。在中国广西的甘蔗种植区,ACT在33.3%的测试水样中检出。ACT在中国东北地区的水产品中也有检出[2]。在美国,春秋季的地表水和饮用水中均能检出ACT,它是美国的中西部流域潜在生态风险的主要贡献者之一[3]。
当ACT进入到环境中时,会对非靶标生物产生一定的毒性效应。Xie等[4]的研究表明,ACT容易积聚在铜绿微囊藻中,会对藻类造成氧化损伤并且导致其释放藻毒素。李薪芳等[5]的研究表明,高浓度的ACT会对铜绿微囊藻造成氧化损伤并抑制其生长。吴晓霞等[6]研究发现,ACT对大型水生植物(浮萍和金鱼藻)的生长发育和生理生化指标具有显著影响。王秀红等[7]的研究表明,ACT高浓度时会抑制藻类蛋白质的合成和α-淀粉酶的活性从而导致其死亡。此外,接触ACT也可以致鱼类中甲状腺激素相关基因的组织特异性替代表达,导致基因变异[8]。Xu等[9]的研究表明,ACT会影响斑马鱼胚胎发育且破坏甲状腺功能。有研究表明,长期接触ACT会诱发大鼠肝脏和肾脏损害,导致抗氧化系统功能障碍,并影响脂肪酸的合成[10]。美国环境保护局将ACT列为B-2致癌物[11];ACT的广泛存在已经对生态环境造成了巨大威胁。本文研究了在不同浓度ACT的胁迫下,水华微囊藻在染毒期间,叶绿素荧光参数、藻蛋白、藻胆蛋白和藻细胞结构受到的影响,综合评价ACT对浮游植物光合作用的潜在影响。此结果可为ACT环境风险评估及农药的合理利用提供依据。
1 材料与方法(Materials and methods)
1.1 试剂和仪器
供试药剂:乙草胺(2-乙基-6甲基-N-乙氧基甲基-α-氯代乙酰替苯胺)原药由浙江大有化工有限公司提供,纯度>90%。
仪器:浮游植物分类荧光仪(Phyto-PAM,Walz公司,德国),透射电子显微镜(H-7650,日立公司,日本),切片机(UC7,Leica公司,奥地利),酶标仪(SP-Max 2300A,上海闪谱生物科技有限公司,中国),人工气候箱(PYX-250Q-B,韶关科力仪器有限公司,中国)。
1.2 实验材料
蓝藻水华微囊藻(Microcystisflos-aquae)(FACHB-1028)由中国科学院水生生物研究所淡水藻种库提供。水华微囊藻采用BG11培养基培养。置于人工气候箱中,培养条件为:温度25 ℃,湿度60%,光暗比12 h∶12 h,光强为3 700 lx左右,静置培养,每天定时人工摇动3次。
1.3 实验方法
1.3.1 叶绿素相关荧光的测定
在水华微囊藻进入生长对数期(1×106~3×106cell·mL-1)后进行染毒,置于250 mL三角锥形瓶中培养。设置乙草胺对水华微囊藻藻液的染毒浓度分别为0、0.01、0.1、1、10和50 mg·L-1。每组浓度设置3个平行,染毒9 d。
试验使用浮游植物分类荧光仪(Phyto-PAM,Walz公司,德国)测定水华微囊藻藻细胞的叶绿素a含量(Chla)、光系统Ⅱ(PSⅡ)的最大光合效率(Fv/Fm)、PSⅡ的实际光合效率(Y(Ⅱ))、快速光响应曲线(电子传递速率(rETR)、光合有效辐射(PAR))、光能利用率(α)、最大潜在相对电子传递速率(ETRmax)、半饱和光强(Ik)等叶绿素荧光参数。Chla每天测一次,其余参数隔天测一次。计算公式如下:
Fv/Fm=(Fm-F0)/Fm
(1)
Y(Ⅱ)=(Fm’-F)/Fm’
(2)
rETR=PAR×Y(Ⅱ)×0.84×0.5
(3)
Ik=ETRmax/α
(4)
式中:F0表示初始荧光,Fv表示可变荧光,Fm表示最大荧光,Fm’表示光适应最大荧光,F表示实际荧光产量。
1.3.2 藻蛋白和藻胆蛋白的测定
蛋白的提取:设置乙草胺染毒浓度为0、1、10和50 mg·L-1,在染毒3、6和9 d时,取一定量的藻液在4 ℃条件下冷冻离心10 min,转速为10 000 r·min-1,去除上清液,藻细胞重悬浮于磷酸盐缓冲液(PBS)(0.05 mol·L-1,pH 7.8)中,冰浴破碎后,再在4 ℃条件下冷冻离心10 min,转速为12 000 r·min-1,取上清液用PBS定容,-80 ℃低温保存。
藻蛋白的测定:采用Bradford法[12]。将标准蛋白质溶液和蛋白提取液加入考马斯亮蓝(G250)溶液,在595 nm处测定吸光度。
藻胆蛋白的测定:在620 nm(A620)、650 nm(A650)和565 nm(A565)处测定吸光度,计算公式如下[13]:
藻蓝蛋白(PC)=(A620-0.7A650)/7.38
(5)
别藻蓝蛋白(APC)=(A650-0.19A620)/5.65
(6)
藻红蛋白(PE)=(A565-2.8PC-1.34APC)/12.7
(7)
1.3.3 藻细胞超微结构观察
设置乙草胺染毒浓度为0 mg·L-1和10 mg·L-1,在染毒4 d时,取一定量的藻液离心,去上清,藻细胞加入2.5%的戊二醛,在4 ℃下固定4 h,用PBS洗3次,每次15 min。再加入1%四氧化锇固定1 h,用乙醇的水溶液按30%、50%和70%的浓度梯度对样品进行脱水,每次15 min,之后在90%乙醇、90%乙醇∶丙酮(V∶V=1∶1)和90%丙酮中脱水各15 min,100%丙酮脱水2次,每次15 min。使用丙酮、Spurr树脂包埋剂浸透与包埋,70 ℃加温聚合24 h。用Leica UC7超薄切片机切成厚度100 nm的切片,醋酸双氧铀和枸橼酸铅染色,超纯水漂洗。最后在透射电子显微镜(TEM)中观察。
1.4 数据处理
试验数据采用SPSS 17.0软件的单因素分析及Duncan检验进行显著性差异分析,P<0.05表示有显著性差异。所得数据利用Origin 8.5作图。
2 结果(Results)
2.1 Chl a含量的变化
由图1可知,随着染毒时间的增加,同一浓度组的Chla含量呈现上升趋势,但都低于对照组;在前6天,各浓度组与对照组均无显著性差异(P>0.05),从第7天起,除了0.01 mg·L-1浓度组以外,其余浓度组均显著低于对照组(P<0.05);到第9天时,0.1、1、10和50 mg·L-1浓度组中水华微囊藻Chla含量分别为对照组的91%、88%、86%和78%。
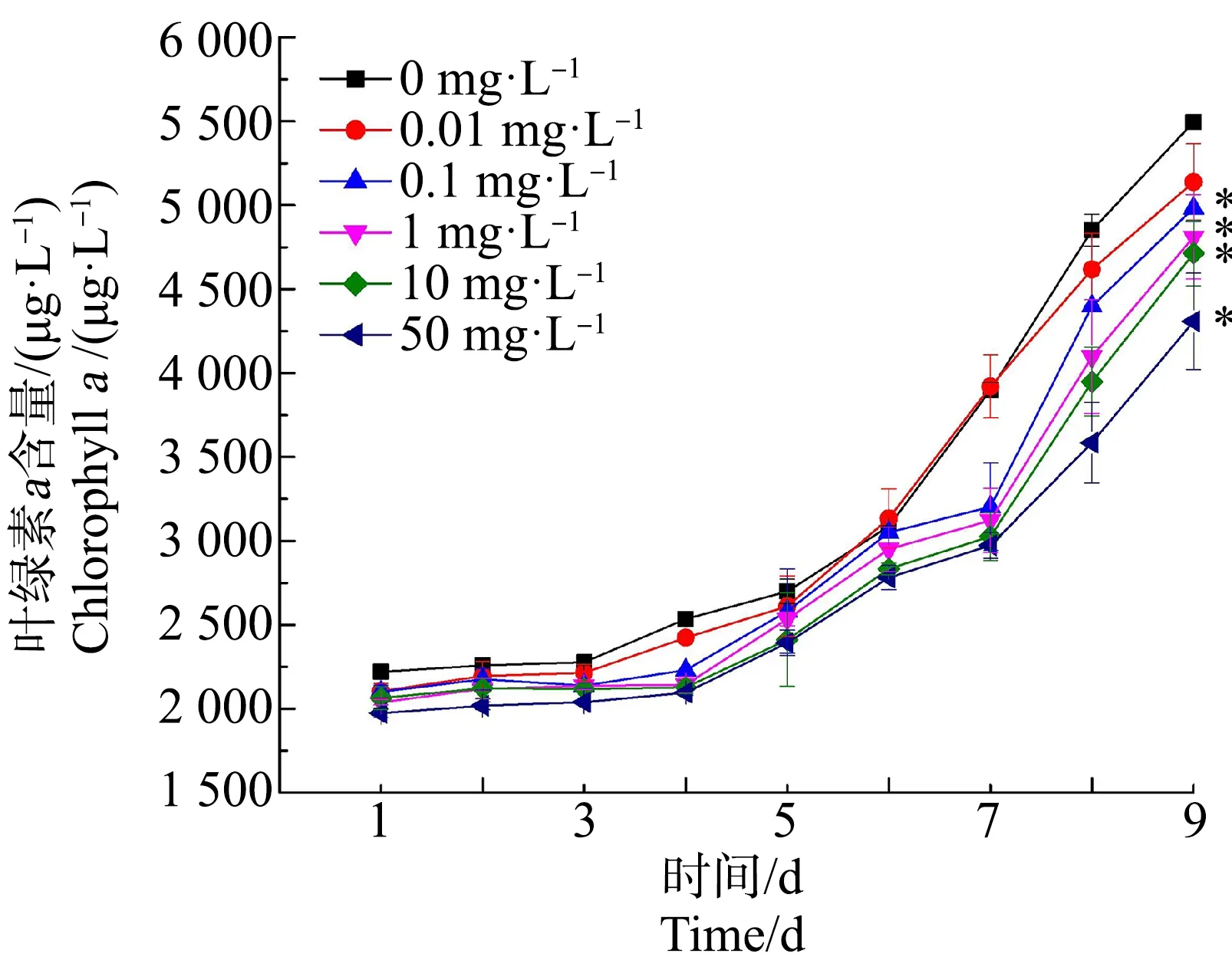
图1 不同浓度乙草胺(ACT)对水华微囊藻叶绿素a(Chl a)含量的影响注:*代表与对照组比较具有显著性差异,P<0.05;下同。Fig. 1 Effects of different concentrations of acetochlor (ACT) on chlorophyll a (Chl a) content of Microcystis flos-aquaeNote: *represents significant difference compared with the control group, P<0.05; the same below.
2.2 Fv/Fm的变化
如图2所示,在前3天,各浓度组Fv/Fm都呈现增大的趋势,但是50 mg·L-1浓度组的Fv/Fm低于对照组;从第3天起,50 mg·L-1浓度组的Fv/Fm呈现下降趋势,时间越长,Fv/Fm越小,显著低于对照组(P<0.05);而10 mg·L-1浓度组从第5天起也开始显著低于对照组(P<0.05)。第9天,10 mg·L-1和50 mg·L-1浓度组的Fv/Fm值分别为对照组的82%和27%。而其余浓度组在染毒期间与对照组无显著性差异(P>0.05)。
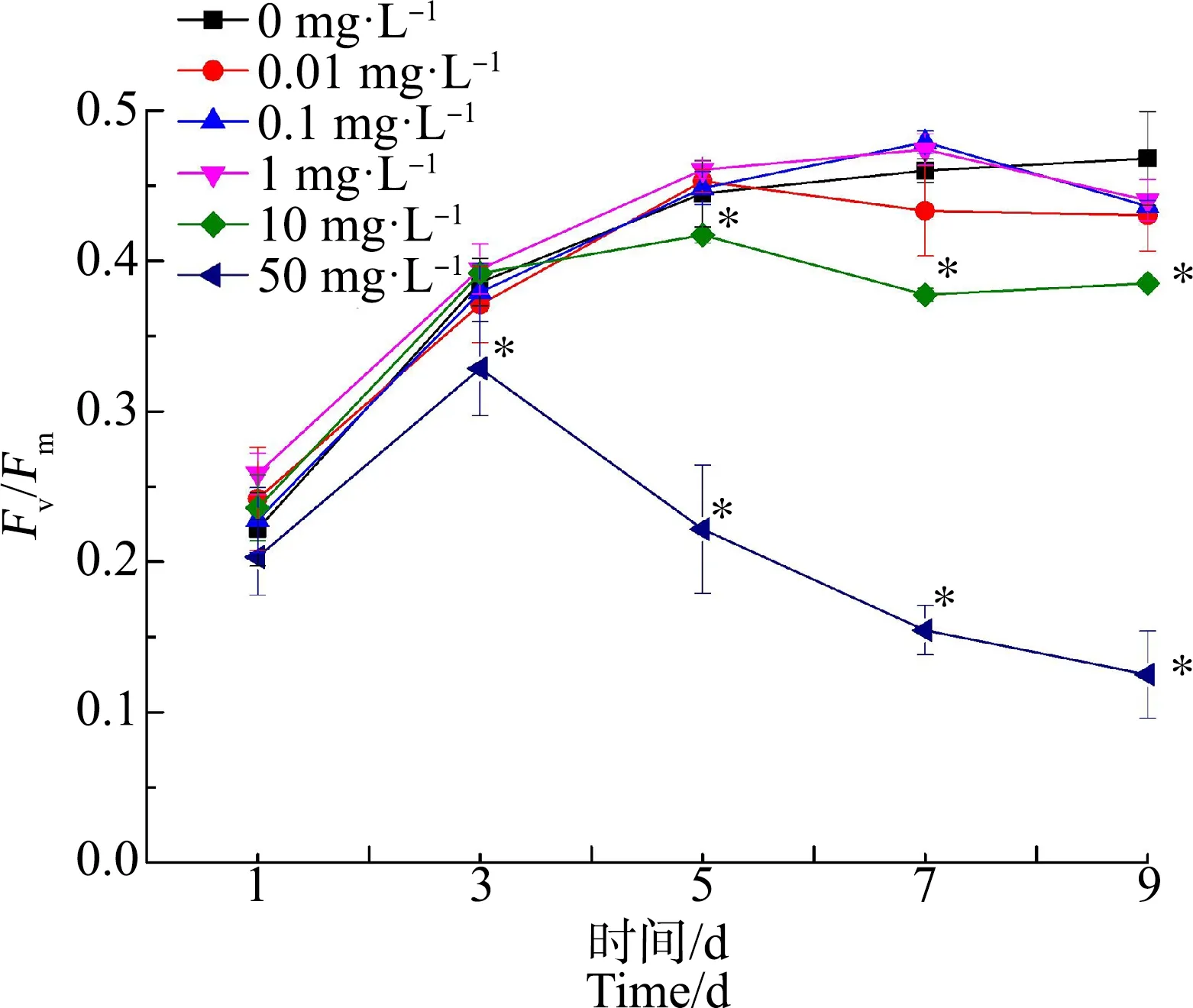
图2 不同浓度ACT对水华微囊藻最大光合效率(Fv/Fm)的影响Fig. 2 Effects of different concentrations of ACT on the maximum photosynthetic efficiency (Fv/Fm) of Microcystis flos-aquae
2.3 Y(Ⅱ)值的变化
如图3所示,在前3天,所有浓度组Y(Ⅱ)值均呈现上升趋势,但是50 mg·L-1浓度组的Y(Ⅱ)值增长速率低于对照组,从第3天起,50 mg·L-1浓度组的Y(Ⅱ)值呈现下降趋势,时间越长,Y(Ⅱ)值越小,显著低于对照组(P<0.05);而10 mg·L-1浓度组从第5天起也开始显著低于对照组(P<0.05)。第9天,10 mg·L-1和50 mg·L-1浓度组的Y(Ⅱ)值分别为对照组的82%和25%。而0.01、0.1和1 mg·L-1浓度组在染毒期间与对照组无显著性差异(P>0.05)。
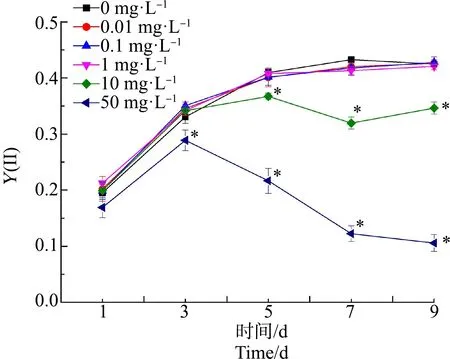
图3 不同浓度ACT对水华微囊藻PSⅡ的实际光合效率(Y(Ⅱ))的影响Fig. 3 Effects of different concentrations of ACT on the actual photosynthetic efficiency of PSⅡ(Y(Ⅱ)) of Microcystis flos-aquae
2.4 快速光响应曲线的变化
如图4所示,在第1天时,各浓度组的快速光响应曲线与对照组并无显著性差异(P>0.05);在第3天时,随着PAR的增大,50 mg·L-1浓度组的rETR开始显著低于对照组(P<0.05);在第5天时,随着PAR的增大,10 mg·L-1浓度组的rETR也开始低于对照组;从第7天起,随着PAR的增大,10 mg·L-1和50 mg·L-1浓度组rETR均显著低于对照组(P<0.05),而其余浓度组的rETR均与对照组无显著性差异(P>0.05)。
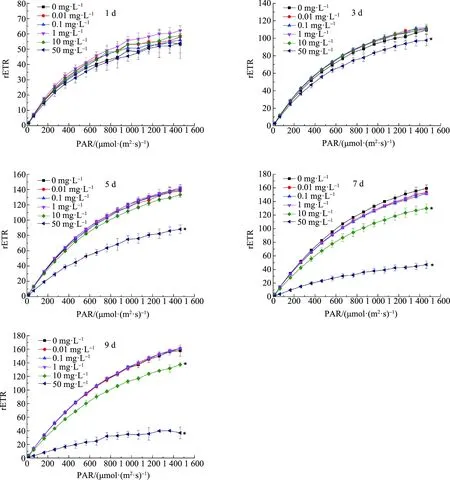
图4 不同浓度ACT对水华微囊藻快速光响应曲线的影响注:PAR表示光合有效辐射,rETR表示电子传递速率。Fig. 4 Effects of different concentrations of ACT on rapid light curves of Microcystis flos-aquaeNote: PAR is photosynthetically active radiation and rETR is electron transport rate.
2.5 α值、ETRmax值和Ik值的变化
ACT对水华微囊藻α值的影响如图5所示,随着染毒时间的增加,0.01、0.1和1 mg·L-1浓度组的α值与对照组的变化趋势一致,呈先上升后趋于相对平稳;而10 mg·L-1和50 mg·L-1浓度组则呈先上升后降低,且从第5天起,α值显著低于对照组(P<0.05)。到第9天时,10 mg·L-1和50 mg·L-1浓度组的α值分别为对照组的85%和25%。
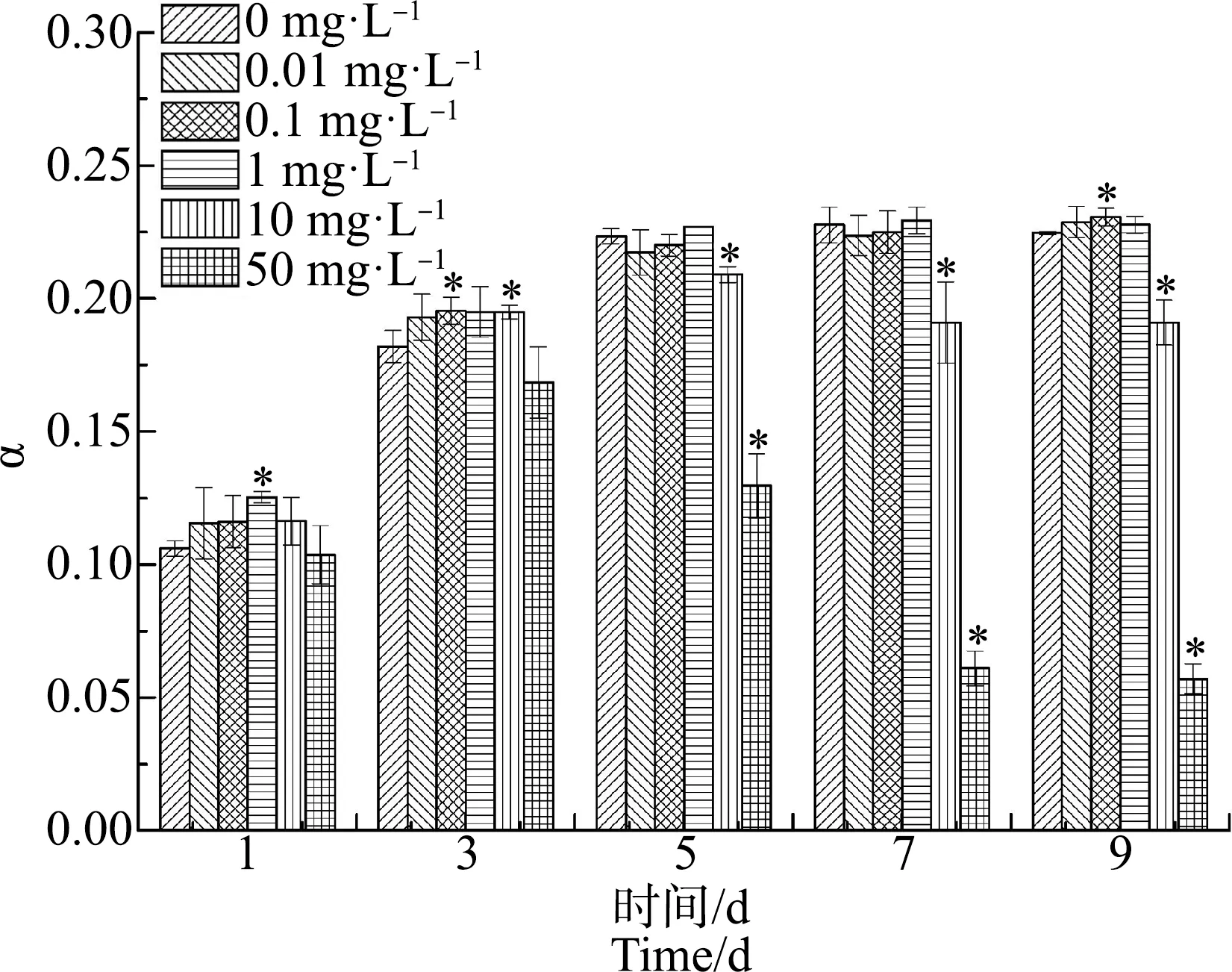
图5 不同浓度ACT对水华微囊藻光响应曲线的初始斜率(α)值的影响Fig. 5 Effects of different concentrations of ACT on the initial slope of rapid light curve (α) value of Microcystis flos-aquae
ACT对水华微囊藻ETRmax值的影响如图6所示,随着染毒时间的增加,0.01、0.1和1 mg·L-1浓度组的ETRmax值保持相对稳定的上升趋势;而10 mg·L-1和50 mg·L-1浓度组则随着染毒时间的增加,呈先增后减的趋势,从第7天起显著低于对照组(P<0.05)。到第9天时,10 mg·L-1和50 mg·L-1浓度组的ETRmax值分别为对照组的78%和22%。
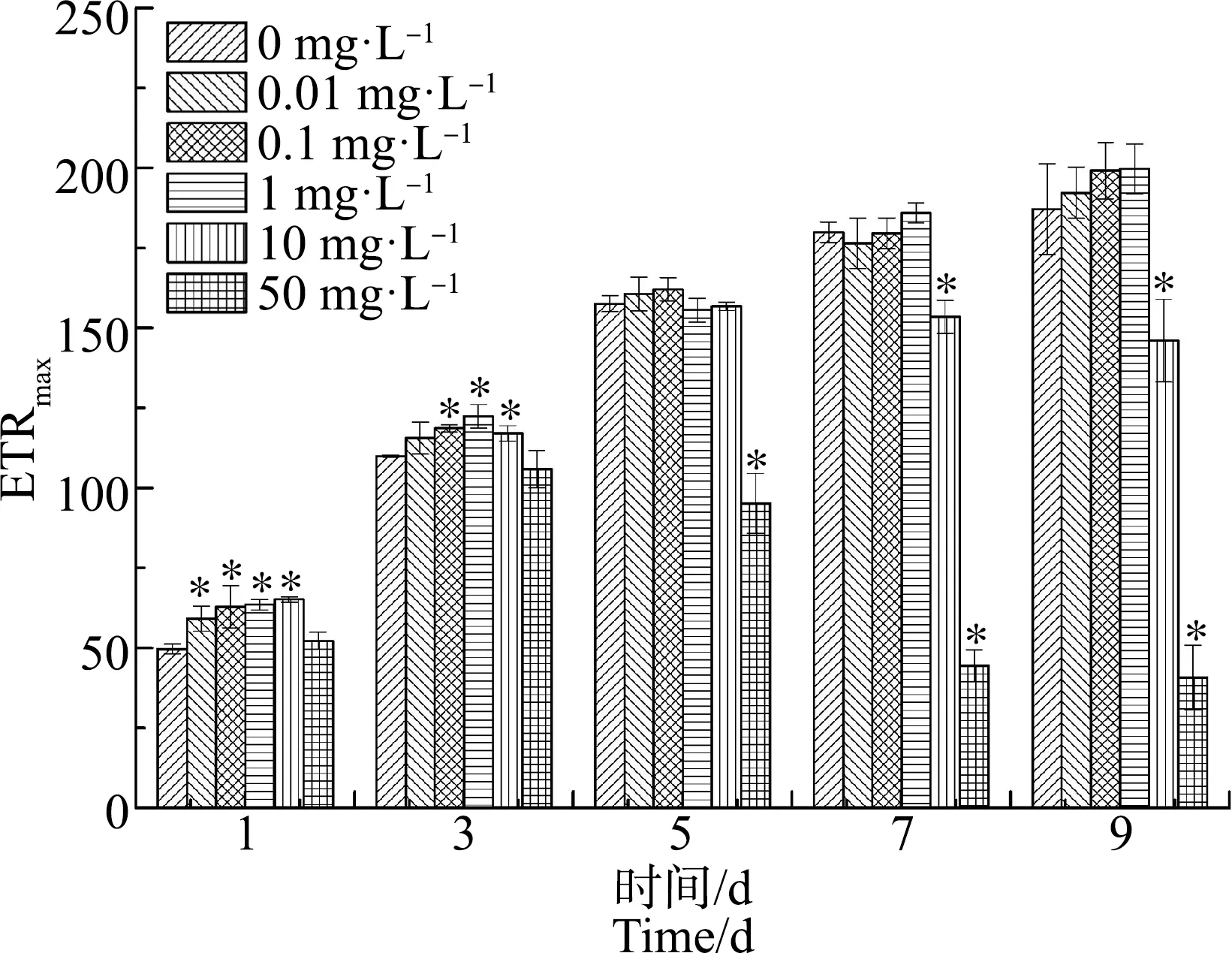
图6 不同浓度ACT对水华微囊藻最大潜在相对电子传递速率(ETRmax)值的影响Fig. 6 Effects of different concentrations of ACT on maximum potential relative electron transfer rate (ETRmax) value of Microcystis flos-aquae
ACT对水华微囊藻Ik值的影响如图7所示,所有浓度组的Ik值随着染毒时间的增加而增大。从第7天起,10 mg·L-1和50 mg·L-1浓度组显著低于对照组(P<0.05)。到第9天时,10 mg·L-1和50 mg·L-1浓度组的Ik值分别为对照组的108%和120%。
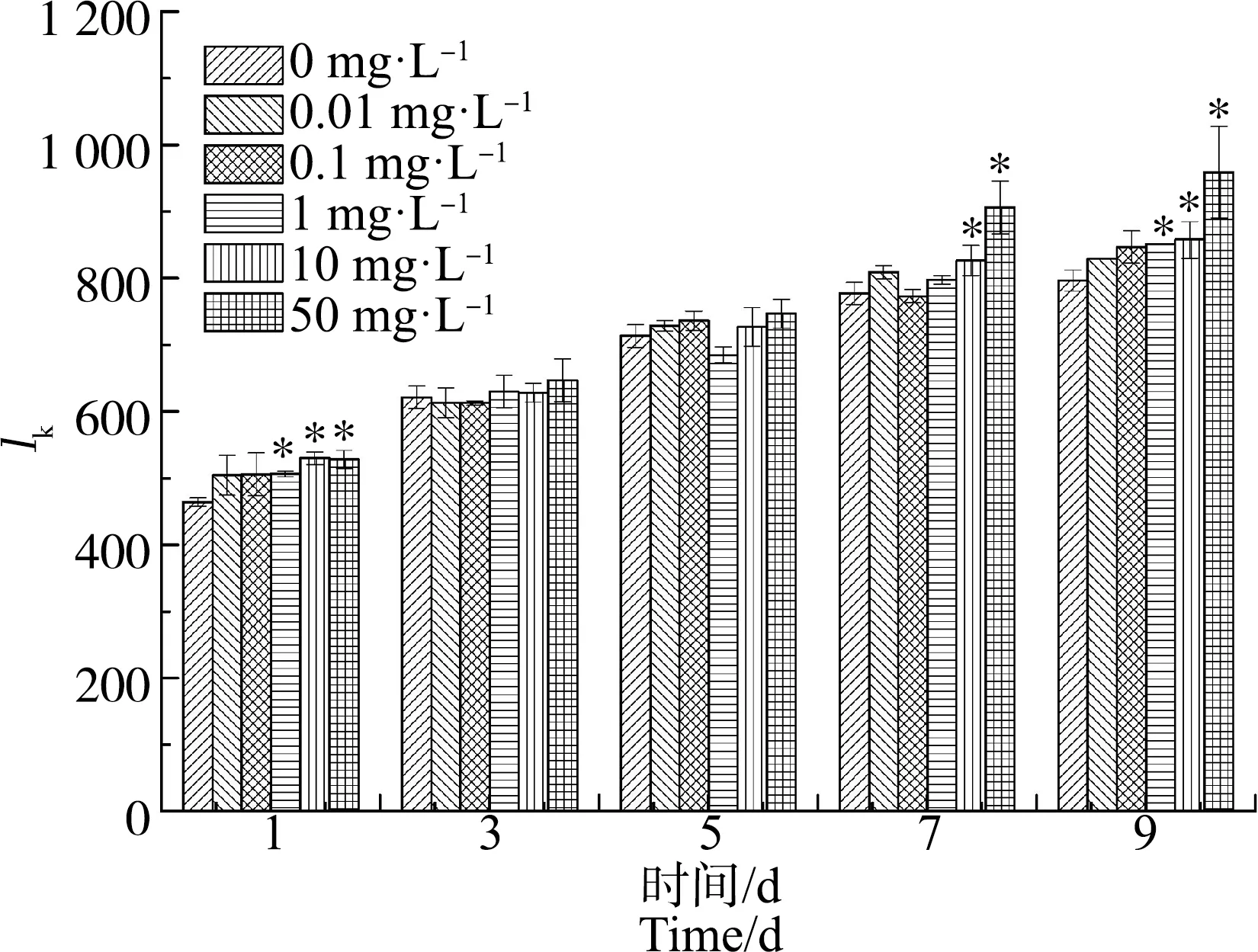
图7 不同浓度ACT对水华微囊藻半饱和光强(Ik)值的影响Fig. 7 Effects of different concentrations of ACT on the semi-saturated light intensity (Ik) value of Microcystis flos-aquae
2.6 藻蛋白和藻胆蛋白的变化
ACT对水华微囊藻藻蛋白的影响如图8(a)所示,藻蛋白相对含量随着ACT浓度的增加呈下降的趋势,从染毒第6天起,50 mg·L-1浓度组的藻蛋白相对含量开始显著低于对照组(P<0.05);在第9天,50 mg·L-1浓度组的藻蛋白相对含量为59.29%±6.54%,且显著低于第3天和第6天时该浓度组的藻蛋白相对含量(P<0.05);而其余浓度组与对照组之间未见显著性差异(P>0.05)。
ACT对水华微囊藻藻蓝蛋白的影响如图8(b)所示,藻蓝蛋白相对含量随着ACT浓度的增加呈下降的趋势,在染毒第9天,10 mg·L-1和50 mg·L-1浓度组的藻蓝蛋白相对含量显著低于对照组(P<0.05),相对含量分别为82.24%±11.06%和64.61%±2.61%,且50 mg·L-1浓度组的藻蓝蛋白相对含量与其余浓度组存在显著性差异(P<0.05)。
ACT对水华微囊藻别藻蓝蛋白的影响如图8(c)所示,别藻蓝蛋白相对含量随着ACT浓度的增加呈下降的趋势。其中,1、10和50 mg·L-1浓度组的别藻蓝蛋白相对含量从第3天起就显著低于对照组(P<0.05);且随着染毒时间的增加,10 mg·L-1和50 mg·L-1浓度组的别藻蓝蛋白相对含量在第9天时显著低于第3天和第6天(P<0.05),其相对含量分别为77.48%±2.23%和57.61%±3.30%。
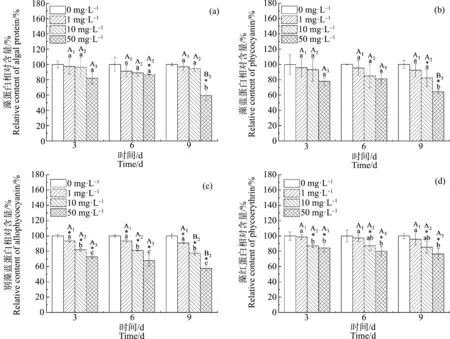
图8 不同浓度ACT对水华微囊藻藻蛋白和藻胆蛋白的影响注:不同小写字母(a、b和c)表示相同暴露时间的不同浓度组之间存在显著差异(P<0.05);不同大写字母(A和B)表示相同浓度组不同暴露时间之间存在显著差异(P<0.05);大写字母的下标1、2和3分别表示1 mg·L-1、10 mg·L-1和50 mg·L-1浓度组。Fig. 8 Effects of different concentrations of ACT on protein and phycobiliprotein of Microcystis flos-aquaeNote: Different lowercase letters (a, b and c) indicate significant differences (P<0.05) between different concentrations at the same exposure time; different capital letters (A and B) indicate significant differences (P<0.05) between different exposure time groups with the same concentration; the subscripts 1, 2 and 3 of capital letters respectively represent concentration groups of 1 mg·L-1, 10 mg·L-1 and 50 mg·L-1.
ACT对水华微囊藻藻红蛋白的影响如图8(d)所示,藻红蛋白相对含量随着ACT浓度的增加呈下降的趋势,从第3天起,10 mg·L-1和50 mg·L-1浓度组的藻红蛋白相对含量均显著低于对照组(P<0.05);在第9天时,10 mg·L-1和50 mg·L-1浓度组的藻红蛋白相对含量分别为85.18%±7.59%和76.51%±7.35%。
2.7 超微结构观察
通过透射电子显微镜观察到ACT染毒前后水华微囊藻细胞的超微结构,如图9所示。图9Ⅰ为对照组经过96 h后的水华微囊藻细胞结构。细胞周围有一层黏液,核区、类囊体、藻青素小粒和气泡清晰可见(图9Ⅰ(a)),类囊体之间存在少量糖原(图9Ⅰ(b));图9Ⅰ(c)和图9Ⅰ(d)中展示的是处于细胞分裂的细胞,箭头指示的细胞壁层含有脂质颗粒,多β羟基丁酸和多面体也清晰可见。图9Ⅱ为水华微囊藻暴露在10 mg·L-1ACT 96 h后的藻细胞结构。细胞整体变形,质壁分离明显(图9Ⅱ(a)),细胞壁被破坏,细胞质紊乱,类囊体数量减少,且大多与细胞壁垂直(图9Ⅱ(b)),细胞分裂不对称,气泡、藻青素小粒数量减少,多β羟基丁酸和脂质颗粒增多(图9Ⅱ(c)和Ⅱ(d))。
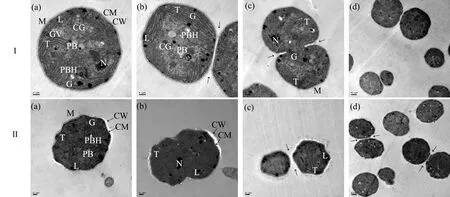
图9 接种96 h后水华微囊藻超微结构的变化注:Ⅰ 对照组,Ⅱ 10 mg·L-1 ACT组;超微结构包含类囊体(T)、黏液(M)、核区(N)、藻青素小粒(CG)、多面体(PB)、多β羟基丁酸(PBH)、脂质颗粒(L)、糖原(G)、气泡(GV)、细胞壁(CW)和细胞膜(CM)。Fig. 9 Ultrastructure of Microcystis flos-aquae cell in sample (96 h after inoculation)Note: Ⅰ control, Ⅱ 10 mg·L-1 ACT group; ultrastructure includes thylakoids (T), mucilage (M), nucleoplasmic area (N), cyanophycin granules (CG), polyhedral body (PB), hydroxybutyrate (PBH), lipid (L), glycogens (G), gas vesicle (GV), cell wall (CW) and cell membrane (CM).
3 讨论(Discussion)
Chla是植物进行光合作用的主要色素,其含量反映光合作用的状况,也是衡量植物生长状况的重要指标之一[14]。本研究中,随着ACT浓度的增加,水华微囊藻的Chla含量逐渐降低,这可能是因为ACT对水华微囊藻光合色素的合成有抑制作用,从而导致Chla含量的下降。以上结果与很多已有研究结果相似,例如,Wang等[15]的研究表明,三角褐指藻的Chla含量会随着对氯苯胺浓度的增加而减少,因为对氯苯胺降低了三角褐指藻光和色素合成酶的活性,导致光和色素合成受到抑制;Smythers等[16]的研究表明,除草剂拿捕净暴露会导致小球藻的Chla含量降低。
Fv/Fm是表征PSⅡ中藻类细胞损伤的快速指标,当藻类遭受非生物胁迫时,就会显著降低[17-18]。本研究中,水华微囊藻的Fv/Fm随着ACT浓度的增加而减少,表明最大量子产量减少,最大光能转化效率受到抑制,这可能是因为在高浓度ACT的胁迫下,水华微囊藻的光合作用过程受到破坏,光合电子传递过程中断,藻体利用光能转化为化学能的能力降低[19]。Élise等[20]的研究也表明,草甘膦会造成蓝藻和绿藻的Fv/Fm降低。Khanama等[21]的研究表明,高浓度敌草隆会造成藻类光合性能降低。刘伟杰等[22]的研究表明,羊角月牙藻的Fv/Fm随着壬基酚的浓度增加而下降,这证明壬基酚能降低羊角月牙藻的光合性能且抑制羊角月牙藻的生长。PSⅡ的Y(Ⅱ)反映了PSⅡ的实际光能转换效率和实际量子产量[23]。水华微囊藻Y(Ⅱ)随着ACT浓度的增加而减少,这表明,ACT暴露会导致水华微囊藻PSⅡ的实际量子产量减少,实际光能转化效率降低,从而影响光合作用。Zhao等[24]的研究报道了4种除草剂(莠去津、敌草隆、敌稗和灭草松)导致3种藻(小球藻、铜绿微囊藻和斜生栅藻)光合作用的最大光合效率和实际光合效率降低。王寿兵等[25]的研究表明,高浓度Cu2+暴露会导致铜绿微囊藻PSⅡ的实际光能转换效率下降,说明铜绿微囊藻的光化学性能受到抑制。
快速光响应曲线可以反映不同试验条件下浮游生物光合活性的相对变化[26]。rETR反映了相对电子传递速率,PAR为有效光辐射强度。在10 mg·L-1和50 mg·L-1ACT浓度组中,随着PAR的增加,rETR增加速率低于对照组,表明藻类的光合作用受到抑制,可能是因为高浓度的ACT破坏了光合作用的电子传递过程,使得光合作用受阻,净光合作用能力降低,从而影响藻类生长。Wu等[27]的研究表明,高浓度微塑料会阻碍藻类光合作用中的电子传递,导致光响应曲线的变化。王俊英[28]用水胺硫磷(ICP)对水华微囊藻进行对映体选择性研究时发现(+)-ICP降低了藻类的光合活性,原因是(+)-ICP阻碍了PSⅡ中电子的传递。Sandra等[29]的研究表明,当藻类受到胁迫时,光响应曲线会显著降低,光合作用受到抑制。
α值反映了藻细胞对光能的利用效率,能直观反映藻类捕光色素对光能的吸收能力[30]。ETRmax值可反映一定光强下单位藻细胞内光合作用速率的快慢[31]。Ik表示浮游植物保持捕获光能和处理光能的最佳平衡点[32],是浮游植物光适应能力的指标,能反映对强光耐性的大小。本研究结果表明,0.01、0.1和1 mg·L-1ACT浓度组中,水华微囊藻的α值和ETRmax值呈上升趋势,其中,部分α值和ETRmax值与空白组呈现显著性差异。可能是因为在低浓度的ACT胁迫下,水华微囊藻通过增强捕光能力和电子传递能力来维持光合能力,从而避免机体受损;而在10 mg·L-1和50 mg·L-1ACT浓度组中,α值和ETRmax值的显著降低可能是因为水华微囊藻在高浓度ACT胁迫下,捕光能力和电子传递能力减弱,导致藻类机体受到损伤。所有ACT浓度组中,水华微囊藻的Ik值呈上升趋势且与对照组有显著性差异,可能是因为当ACT浓度增大时,水华微囊藻的生长受到胁迫,而耐受能力增强。已有研究表明,在除草剂的作用下,藻类的光合作用能力下降。例如,异丙隆会抑制斜生栅藻和衣藻PSⅡ的活性[33-34]。Deblois等[35]的研究表明,阿特拉津会影响藻类的电子输运、初级生产和光调节过程。Ni等[36]的研究表明,藻类的α值和ETRmax值会随着除草剂硝磺草酮浓度的增加而降低,表明藻类的光合能力受到抑制。
藻蛋白和藻胆蛋白都随着ACT浓度的增加呈下降趋势。蛋白含量的降低说明有毒物质能够抑制蓝藻蛋白质的合成[37]。Chia等[38]的研究表明,类毒素会抑制铜绿微囊藻蛋白质的合成。藻胆蛋白包含藻蓝蛋白、别藻蓝蛋白和藻红蛋白,它们能附着在类囊体上,其作用是将光能传递给Chla,从而进行光合作用[39]。ACT染毒后蛋白质含量的降低可能与光合作用速率降低有关,因为当光合作用受到抑制会导致用于蛋白合成的碳骨架的缺乏[40]。本研究结果表明,ACT对藻胆蛋白的抑制作用顺序为别藻蓝蛋白>藻蓝蛋白>藻红蛋白。楼春[41]的研究表明,酰胺类农药对铜绿微囊藻藻胆蛋白的抑制作用也表现为同样的顺序。林必桂等[42]的研究表明,赖氨酸对铜绿微囊藻藻胆蛋白各组分有不同的抑制作用,使微囊藻的光合作用系统受到破坏。因此,推测ACT会抑制水华微囊藻蛋白质的合成,使蛋白质含量减少,导致水华微囊藻对光能的捕获能力降低,造成光合作用受到抑制,致使藻类营养供给不足,这又进一步使得蛋白质的合成受到抑制。
本研究中藻细胞的超微结构观察结果表明,对照组的类囊体是封闭的圆盘,围绕核仁区域并与之平行,而ACT暴露后,类囊体减少并且排列发生变化,与细胞壁垂直,这可能是一种保护细胞免受超氧阴离子攻击的机制[43],类囊体中存在捕光色素,当类囊体受到损伤时,藻类生长和光合作用也会受到抑制。气泡为水生原核生物提供浮力,气泡壁是由蛋白质形成的,ACT染毒后藻细胞气泡减少可能是由于蛋白质的合成受到抑制且气泡壁被破坏[44]。染毒后细胞内也会出现较多的脂质颗粒,这可能也是藻细胞在受到胁迫时自身的解毒机制[45]。藻青素小粒是一种氮储存物,染毒后数量减少,可能是因为藻细胞在胁迫条件下的生长和分裂过程消耗了细胞内部的氮供应[46]。糖原是蓝藻光合作用的产物,主要存在于光合片层之间,ACT染毒后的水华微囊藻中的糖原减少,这可能是因为负责降解这种多糖的酶过度产生,或者是参与糖原生产和储存的酶数量减少[47]。
综上所述,在低浓度(0.1 mg·L-1和1 mg·L-1)ACT的胁迫下,水华微囊藻Chla含量虽然有所下降,但其能够通过增强捕光能力和电子传递能力使其光合作用不受影响;在高浓度(10 mg·L-1和50 mg·L-1)ACT的胁迫下,水华微囊藻Chla含量、捕光能力、光能转化效率和相对电子传递速率均下降,从而导致藻体光合作用能力下降。此外,ACT的胁迫会导致藻蛋白和藻胆蛋白含量下降,且别藻蓝蛋白最为敏感,蛋白含量的下降会影响光能的传递。与此同时,ACT对藻细胞内部类囊体造成的损伤也会导致捕光色素含量降低,这也是导致光合作用能力下降的重要因素。综合本研究中各项指标测量结果可知,Chla含量对ACT的胁迫最为敏感,但要整体评估藻体光合能力,还需结合藻体叶绿素荧光参数及相关蛋白含量等参数。
