五溴联苯醚(BDE-99)和羟基五溴联苯醚(5-OH-BDE-99)经由THRβ影响斑马鱼胚胎眼部色素的沉着
2020-02-03李嘉伟尹晓宇周旖妮杨景峰董武
李嘉伟,尹晓宇,周旖妮,杨景峰,董武
内蒙古民族大学动物科学技术学院,内蒙古自治区毒物监控及毒理学重点实验室,通辽 028000
多溴联苯醚(PBDEs)是一类含溴原子的芳香族化合物,根据溴原子在苯环上的取代位置和个数的不同,多溴联苯醚共有209种同分异构体,由于其独特的理化性质,PBDEs是世界上使用最广泛的阻燃剂之一[1],在工业制造过程中,PBDEs被人为添加到复合材料中,使其不易燃烧。目前,PBDEs被广泛应用于电子电器设备、自动控制设备、建筑材料和纺织品等的制造中[2]。虽然,PBDEs作为阻燃剂使用成本低廉,但是其在环境中不易降解而长期存在,使其被归类为新型持久性环境有机污染物[3]。近年来,PBDEs所造成的影响被越来越多的国内外研究者重视,在动物体内、水环境中和土壤中均检测出有PBDEs的存在。Brown等[4]在美国加利福尼亚州沿海水域中鱼体内检测出43种PBDEs,浓度达到了302 ng·g-1。在英国内陆水域鱼体中PBDEs的检出量也达到了8 ng·kg-1[5]。除了在水生生物中检测出PBDEs,在陆生生物体中也检测出不同浓度的PBDEs含量。Guo等[6]在禽类消化液中检测出BDE-209高达715 μg·g-1;Boyles和Nielsen[7]在不同年龄性别的浣熊肝脏组织中也发现了有PBDEs的存在;甚至有研究者在野生大熊猫血液中也检测出了PBDEs的存在[8]。在最新研究中,PBDEs在母乳中也被检测出来[9]。PBDEs作为新型有机污染物在环境中的持久存在,可能会对人体尤其是胎儿产生危害[10]。
已有研究表明,PBDEs具有一系列毒性作用,包括内分泌紊乱[11]、肝脏毒性[12]、生殖毒性、神经毒性[13-14]和发育毒性[11,15-16]。Balch等[17]在非洲爪蛙覆膜内注射BDE-47、BDE-99以及DE-71,发现3种物质会对非洲爪蛙皮肤色素沉着有影响,并且会产生变态反应;而在腹腔注射BDE-47、BDE-99以及DE-71后发现变态反应的机制可能与甲状腺激素与转运蛋白的结合有关。在Macaulay等[18]的研究中提到,甲状腺激素部分介导斑马鱼的变态转变,而羟基化BDE(OH-BDEs)会破坏甲状腺的信号介导,从而延缓斑马鱼的发育,也会对斑马鱼鳔、鱼鳍及色素沉着产生影响。在Macaulay等[11]的另一项关于OH-BDEs的研究中,斑马鱼胚胎暴露于6-OH-BDE后发现,6-OH-BDE使斑马鱼眼部色素沉着降低,并使THRβmRNA表达降低,表明6-OH-BDE会对斑马鱼早期发育产生不利影响。Zezza等[1]也提到了BDE-47、BDE-99和BDE-209会使THRβmRNA表达量下降,从而导致斑马鱼发育异常。目前国内外学者并没有充分研究和对比BDE-99和5-OH-BDE-99对斑马鱼眼部色素及甲状腺激素的影响及其相关关系。
斑马鱼作为实验动物模型,具有快速、敏感和容易操作等特点,且其可利用资源极其丰富,因而被广泛应用。使用斑马鱼胚胎评价PBDE的毒性及其作用机制,具有独特优势。本研究中,针对BDE-99和5-OH-BDE-99进行了对比研究,评估二者对斑马鱼眼部色素以及相关甲状腺受体的影响,探讨眼部色素与THRβ的关联。为BDE-99及5-OH-BDE-99的毒性研究提供一定的参考数据。
1 材料与方法(Materials and methods)
1.1 斑马鱼胚胎收集
成年AB系斑马鱼(Daniorerio),在循环水养殖系统中进行繁育(北京爱生科技发展公司),雌雄鱼分开进行饲喂,每天14 h∶10 h的光∶暗周期。养殖温度(28±1) ℃,pH值7.0~7.6。实验时挑选出优质健康的性成熟斑马鱼,按照雌雄斑马鱼1∶2的比例放入交配缸中,等到第2天早上开灯,斑马鱼见光后开始产卵,并收集胚胎,放入斑马鱼培养液(ZR液)中,并放置在28 ℃培养箱中孵化。
1.2 暴露方法
BDE-99和5-OH-BDE-99购买于Accustandard,纯度>99.5%,通过二甲基亚砜(DMSO)溶解来制备浓度为1 mmol·L-1的储备溶液作为原液。暴露溶液通过用鱼类养殖系统水从原液中进行梯度稀释,DMSO的最终浓度<0.1%。斑马鱼胚胎暴露于1、10和100 nmol·L-13种浓度的BDE-99和5-OH-BDE-99,暴露从4 hpf开始直到观察为止。
1.3 THRβ重组蛋白的制备
将斑马鱼甲状腺受体THRβ-LBD通过组氨酸标记后(作为带有N-末端His标记的蛋白),亚克隆到pET-21b,在大肠杆菌BL21细胞中过表达(Rosetta (DE3)pLysS cells (Novagen)),于500 mL LB培养基中培养(100 μg·mL-1的氨苄西林和34 μg·mL-1氯霉素),温度控制在18 ℃,加入1 mmol·L-1IPTG诱导蛋白并持续在18 ℃下培养20 h。4 000 g离心30 min收集细胞,可在-80 ℃冷冻保存。用5 mL裂解缓冲液重悬细胞(50 mmol·L-1Tris、pH 8.0、300 mmol·L-1NaCl、12 mmol·L-12-巯基乙醇、10%甘油和不含EDTA的蛋白酶抑制剂)并在冰上进行超声处理(15 s超声,4次)。裂解物在14 000 g、4 ℃下离心10 min,之后将上清液加载到Ni-NTA树脂(Qiagen)上,甲状腺受体用250 mmol·L-1咪唑洗脱。蛋白浓度通过Bradford分析法(BioRad)测定。通过SDS-PAGE和Western blot(单克隆抗体C3,Covance)评估甲状腺素受体纯度(图1)。
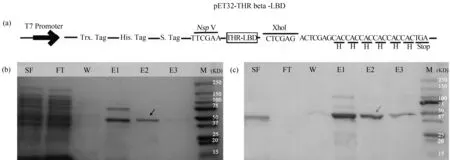
图1 THRβ-LBD准备和确认注:(a) THRβ-LBD设计;(b) SDS-page;(c) 免疫印迹,箭头表示净化THRβ。Fig. 1 Preparation and confirmation for THRβ-LBDNote: (a) THRβ-LBD design; (b) SDS-page; (c) Western blot, arrows indicate purified THRβ.
1.4 偏振光及其竞争性结合检测
利用Levy-Bimbot等[19]的方法,使用JZ01探针(0.5 nmol·L-1)和甲状腺激素受体(TR)结合,可以直接通过偏振光(fluorescence polarization, FP)检测FP强度与THRβ浓度的关系。JZ01提供了一种简便的、非辐射性的竞争性比较,TR作为检测结合力的配体。将JZ01在DMSO中的溶解,制备0.7 mmol·L-1的储备液,将其用缓冲液(50 mmol·L-1磷酸钠、150 mmol·L-1NaCl、1 mmol·L-1DTT、1 mmol·L-1EDTA、0.01% Nonidet P-40和10%甘油;pH 7.2)稀释。TR溶液配制成为0.3~1 000 nmol·L-1的不同浓度。90 μL TR溶液的等分试样与10 μL的0.5 nmol·L-1JZ01溶液混合,室温下孵育1 h,通过96孔板进行检测,每个反应进行3个重复。偏振光强度在Fusion读板仪上测量(Perkin-Elmer, excitation (485 nmol·L-1), emission (535 nmol·L-1))。制备1 nmol·L-1~1 μmol·L-1的卵白蛋白溶液作为对照。
1.5 整体原位杂交
当斑马鱼胚胎达到实验所需要的发育阶段,将其固定在4%(w/V)多聚甲醛(产品编号158127-500G,Sigma)的磷酸盐缓冲溶液(PBS)中(pH 7.4)过夜,用PBS清洗后浸泡于100%甲醇中,可放置于-20 ℃冰箱中储存。整体原位杂交(WISH)是按照Dong等[20]的方法进行。基本原理是斑马鱼胚胎与1 161个碱基对斑马鱼甲状腺激素受体β(THRβ)的反义杂交链结合。然后使用以下引物进行克隆并且做THRβ探针(正向引物为5’-ATGTCAGAGCAAGCAGACAAATGC-3’;反向引物为5’-TTCCTGGAAGTGTTTGAAGAC-3’),在64 ℃杂交过夜后,胚胎用2×SSC(300 mmol·L-1NaCl(产品编号S7653-5KG,Sigma),30 mmol·L-1柠檬酸钠(产品编号71497-250G,Sigma),pH 7.0),然后用0.2×SSC分别洗3次,每次30 min。接下来的胚胎是用2%的封闭剂封闭(Roche, Mannheim, Germany;产品编号10057177103)。使用2 mL 10% 封闭缓冲液加8 mL马来酸配成封闭液,对DIG抗体进行3 000×稀释,然后在4 ℃用3 000×稀释的DIG抗体与碱性磷酸酶偶联(Roche, Mannheim, Germany;产品编号11082736103)。最后进行显色反应,通过与BM-Purple底物(Roche, Mannheim, Germany;产品编号11442074001)发色。
1.6 色素强度的测定
用OLYMPUS光学显微镜(IX73)、数码相机(DP80)和映像软件(cellSens Standard)记录THRβmRNA表达。调整到显微镜能够清晰辨认THRβ表达位点,并且在Zfish图集上选择适当年龄的斑马鱼(http://zfatlas.psu.edu/progress.php)。为了量化THRβ表达的强度,由Image J分析软件(National Institutes of Health Bethesda, USA)分析得到强度的总和。接下来,将轮廓移到相邻的区域/组织,确定强度。使用总强度除以ROI像素面积,计算平均强度。
1.7 总RNA提取、cDNA生成和基因表达分析
使用TRIzol试剂处理完整的胚胎,从整体斑马鱼胚胎中提取总RNA(Grand Island;产品编号12183-555)。RNA样品的质量通过测量260/280 nm处的吸收率。纯化的总RNA立即用于cDNA合成。cDNA的产生是用高容量cDNA反转录试剂盒(Applied Biosystems Inc;产品编号4368814)进行,方法按照厂家说明书进行,cDNA样本使用前将其保持在-20 ℃冷冻。使用TaqMan进行基因表达测定和基因表达分析(Applied Biosystems Inc;产品编号4331182)。反转录加入0.2 ng cDNA后进行反应与TaqMan Universal PCR Master Mix混合,并使用Applied Biosystems 7900HT进行PCR检测,用Sequence Detection System 2.0软件分析。样品的THRβ基因(正向引物为5’-TGTCTCTTCGAGCAGCAGTG-3’,反向引物为5’-GCCACCTCTGAATCGTCCAA-3’)表达数据使用18s RNA作为内参基因(正向引物为5’-TCGCTAGTTGGCATCGTTTATG-3’,反向引物为5’-CGGAGGTTCGAAGACGATCA-3’),以此补偿在胚胎之间RNA量的内在变异性。
1.8 统计分析
所有表达数据均表示为平均值±SEM,使用GraphPad Prism software进行统计分析。差异的显著性使用单向方差分析。P<0.05的情况下被认为是统计学上的差异显著。
2 结果(Results)
BDE-99和5-OH-BDE-99对斑马鱼胚胎眼部色素有强烈抑制作用,为研究这种抑制机制,首先定量了斑马鱼胚胎眼部色素强度,之后探讨了引起色素降低的起因。笔者发现与三碘甲状腺原氨酸(T3)结合的甲状腺素受体THRβ的功能失调是主要原因之一。其中,一种原因是BDE-99或5-OH-BDE-99都与T3竞争性结合THRβ,造成T3功能的紊乱,另一个原因BDE-99或5-OH-BDE-99都可以造成THRβ基因表达的降低。
2.1 BDE-99和5-OH-BDE-99对斑马鱼眼部色素的抑制作用
在实验室条件下,正常斑马鱼眼部色素沉着开始于22 hpf,之后色素沉着水平逐渐增加,到96 hpf达到最大值。选择36 hpf作为测量和比较的参考点。在这项研究中,笔者最初选择斑马鱼整体色素来定量,但发现不便于检测。眼睛色素沉着整体均匀,容易定量检测,故选择了眼部作为评价的标准。BDE-99和5-OH-BDE-99暴露显著降低了胚胎36 hpf时眼睛色素沉着(图2)。相对于对照组,1、10和100 nmol·L-1的BDE-99染毒组中眼睛色素沉着分别减少18.2%(P>0.5)、31.3%(P<0.05)和32.3%(P<0.05)(图2(a)~图2(d))。同样,1、10和100 nmol·L-15-OH-BDE-99暴露也可显著减少眼睛色素沉着,分别降低了9%(P>0.05)、36.3%(P<0.05)和46.1%(P<0.05)(图2(e)~图2(g))。当胚胎发育到60 hpf,眼睛色素沉着仍然与36 hpf有相似降低趋势。
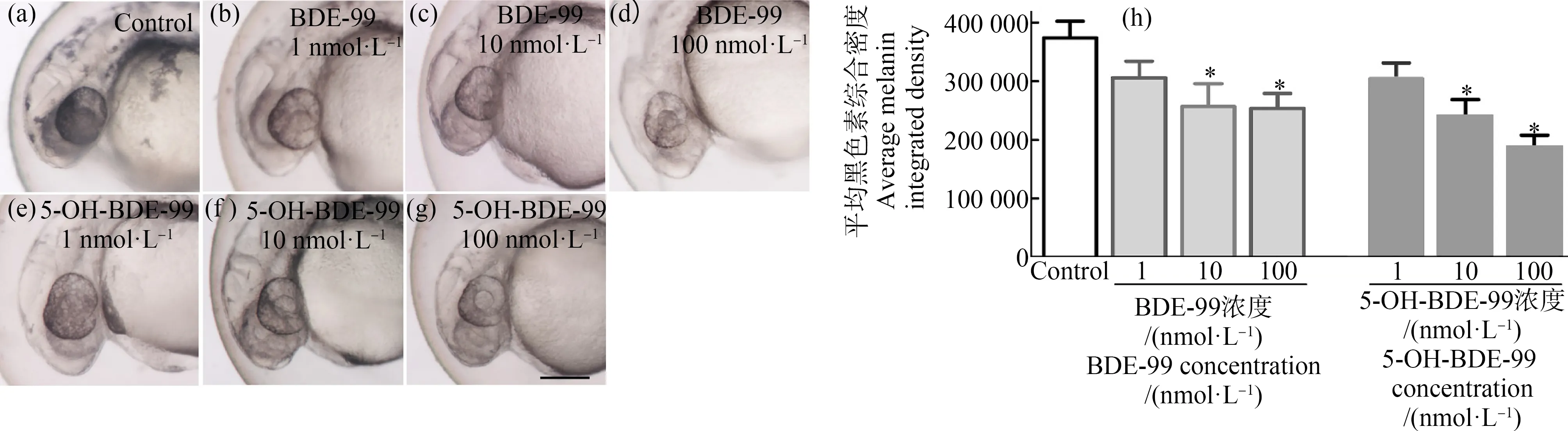
图2 多溴联苯醚(PBDEs)降低眼睛色素沉着强度注:胚胎暴露于BDE-99或5-OH-BDE-99(4~36 hpf);用ImageJ对眼部色素沉着水平进行量化;(a) 对照组,(b)~(d) BDE-99暴露组,(e)~(g) 5-OH-BDE-99暴露组,(h) 每组30个胚胎的色素强度(综合密度)的柱状图;*表示每个浓度组分别与对照组相比,差异有统计学意义(P<0.05)。Fig. 2 Polybrominated diphenyl ethers (PBDEs) decrease pigmentation intensity in eyesNote: Embryos were exposed to BDE-99 or 5-OH-BDE-99 from 4 to 36 hpf; eye pigmentation levels were quantified by ImageJ; (a) control group, (b)~(d) BDE-99 exposure groups, (e)~(g) 5-OH-BDE-99 exposure groups; (h) histograms of pigment intensity (integrated density) established from quantification of 30 embryos per group; *indicate significant differences (P<0.05).
2.2 THRβ与BDE-99和5-OH-BDE-99的结合作用
为检测BDE-99和5-OH-BDE-99与THRβ的竞争性结合能力[21],用JZ01作为探针与THRβ结合发出的偏振光强度与THRβ的浓度呈现正相关。而竞争性配体T3能够让这种增强的偏振光降低(图3(b))。类似地,BDE-99和5-OH-BDE-99也能够让偏振光降低,尤其是5-OH-BDE-99与T3具有极其相似的曲线趋势,表明5-OH-BDE-99具有与T3相互竞争的可能性。

图3 THRβ与BDE-99和5-OH-BDE-99的结合作用注:(a) 用THRβ 和卵清蛋白对照对JZ01(0.5 nmol·L-1)的偏振光滴定;(b)~(c) 用三碘甲状腺原氨酸(T3) (10 nmol·L-1),BDE-99 (10 nmol·L-1)和5-OH-BDE-99(10 nmol·L-1)进行JZ01 (0.1 nmol·L-1)和THRβ (20 nmol·L-1)的竞争性滴定;LBD表示配体结合域;THRβ -LBD ligand浓度单位为mol·L-1。Fig. 3 Binding effect of THRβ with BDE-99 and 5-OH-BDE-99Note: (a) fluorescence polarization titration of JZ01 (0.5 nmol·L-1) with THRβ and ovalbumin control; (b)~(c) competitive titration of JZ01 (0.1 nmol·L-1) and THRβ (20 nmol·L-1) with triiodothyronine (T3) (10 nmol·L-1), BDE-99 (10 nmol·L-1), and 5-OH-BDE-99 (10 nmol·L-1); LBD stands for ligand binding domain; the unit of THRβ -LBD ligand concentration is mol·L-1.
2.3 BDE-99和5-OH-BDE-99对THRβ基因表达的影响
为检测BDE-99和5-OH-BDE-99对斑马鱼胚胎THRβ的影响,将4 hpf斑马鱼胚胎暴露于BDE-99和5-OH-BDE-99溶液中直至胚胎发育到30 hpf或 60 hpf后实施处理。分别使用WISH和RT-PCR检测了THRβmRNA表达。WISH方法的检测结果证明了暴露于1、10和100 nmol·L-1BDE-99和5-OH-BDE-99的斑马鱼胚胎,其THRβmRNA表达显著降低,表达位置主要位于脑室周围区域(前脑)。RT-PCR定量检测结果显示,THRβmRNA表达随BDE-99和5-OH-BDE-99暴露浓度的增加而降低(1、10和100 nmol·L-1)。在30 hpf时,2种化合物都表现为显著降低效应(P<0.05)(图4(h)),THRβmRNA表达均降低至70.6%以下(P<0.05)。在60 hpf时(图4(i)),暴露于BDE-99的斑马鱼胚胎,THRβmRNA表达随着浓度增加(1、10和100 nmol·L-1)都表现降低,具有统计学意义(P<0.05),均降低至72.2%以下。在60 hpf时,暴露于5-OH-BDE-99的斑马鱼胚胎,THRβmRNA表达在10 nmol·L-1和100 nmol·L-1剂量下显著降低(P<0.05),与对照组相比,浓度均降低至53.7%以下,而1 nmol·L-1剂量下没有显著差异(P>0.05)。
3 讨论(Discussion)
本研究结果表明,斑马鱼胚胎暴露于BDE-99或5-OH-BDE-99,导致斑马鱼眼部色素沉着减少,THRβ表达降低,尤其是5-OH-BDE-99在体外能够与THRβ有效结合,这表明BDE-99和5-OH-BDE-99有可能在体内与T3有竞争性结合而产生不利作用,进而造成甲状腺激素调解失调。甲状腺激素(THs)是非常重要的一种激素,能够调节许多细胞功能[22-23],THs不仅是脊椎动物变形的诱因,也对中央神经系统起到至关重要的作用[24-27]。THRα与THRβ介导THs的调节,THRβmRNA表达量降低致使THs分泌减少,造成机体发育迟缓以及其他影响[28]。
3.1 眼部色素沉着降低
Arbogast等[29]报道了THRβmRNA在小鼠视网膜中的表达,免于因甲状腺激素水平的波动使视网膜受到影响,起到保护视网膜的作用。此外,THRβmRNA在啮齿动物胚胎的视网膜外核层中表达[30],Dong等[20]使用6-OH-BDE-47对斑马鱼进行暴露,发现了色素降低的类似现象,这可能是视网膜细胞凋亡的原因,并进一步阐明凋亡机理可能是PBDE导致THRβmRNA表达量下降造成的。色素沉积的降低与甲状腺素受体有密切关联,在本研究中也证实了这一点,THRβmRNA表达量的下降可能是眼部色素沉着降低的原因之一。当非洲爪蟾暴露于C-BDE-99(特定放射性49 Ci,即1 813 GBq·(mol·L-1)-1与BDE-99),1.5 d后在视网膜黑色素层中发现放射性物质,表明眼部区域产生了BDE-99的积累,导致色素沉着的降低[31]。在笔者的研究中,BDE-99或5-OH-BDE-99导致斑马鱼眼部色素沉着减少,推测鱼体内的BDE-99和5-OH-BDE-99最后也会在眼部积累,造成色素沉着降低,进而导致BDE-99或5-OH-BDE-99对色素沉着产生影响,但具体是否造成视网膜细胞的凋亡,还有必要进一步研究。
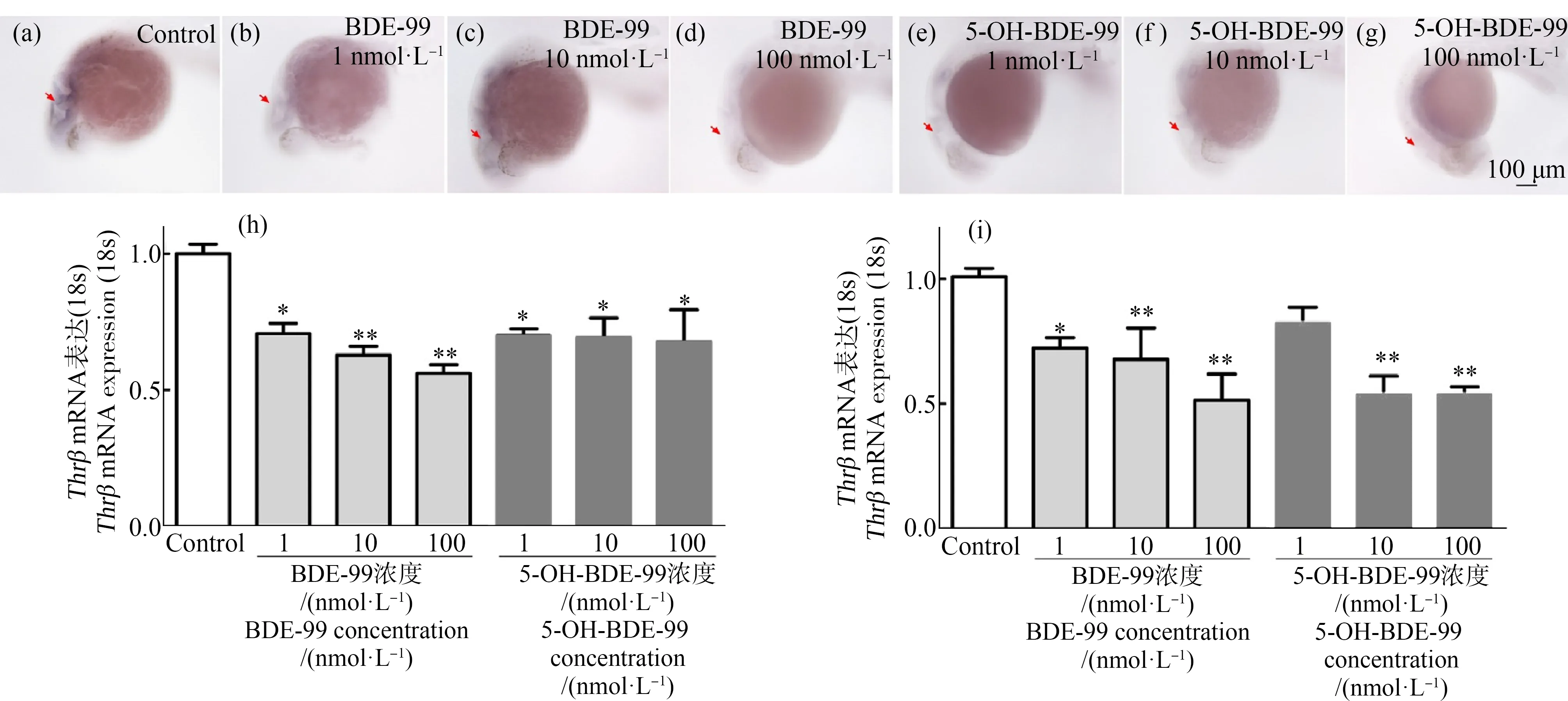
图4 BDE-99和5-OH-BDE-99降低了斑马鱼胚胎大脑中THRβ mRNA的表达注:胚胎从4 hpf暴露于BDE-99或5-OH-BDE-99至30 hpf或60 hpf;(a)~(g)为30 hpf斑马鱼胚胎;(a)为对照组,(b)~(g)为暴露组,与对照相比,暴露组中胚胎大脑出现突出蓝色,显示出在1、10和100 nmol·L-1浓度组THRβ mRNA表达降低,红色箭头指示表达的定位;(h)、(i)表示分别在30 hpf和60 hpf时THRβ的qRT-PCR结果的柱状图,1、10和100 nmol·L-1 BDE-99和5-OH-BDE-99暴露组与对照显著不同;*表示每个浓度组分别与对照相比,差异有统计学意义(P<0.05);使用3个重复,每个重复20个胚胎。Fig. 4 BDE-99 and 5-OH-BDE-99 decreased THRβ mRNA expression in the brain of zebrafish embryoNote: Embryos were exposed from 4 hpf to 30 hpf or 60 hpf to BDE-99 or 5-OH-BDE-99; (a)~(g) shows the zebrafish embryo at 30 hpf; (a) is control group, (b)~(g) are exposure groups; compared to control group, the prominent blue coloration was observed in the brain of embryos exposed to BDE-99 or 5-OH-BDE-99, showing that theTHRβ mRNA expression was decreased at 1, 10 and 100 nmol·L-1 respectively; red arrows indicate localization of expression; (h), (i) show histogram of the quantitative PCR (qRT-PCR) for THRβ at 30 hpf and 60 hpf, respectively; the results of the 1, 10 and 100 nmol·L-1 BDE-99 and 5-OH-BDE-99 exposure groups were significantly different from the control; *P<0.05 indicates the significant differences from the control; 3 replicates of 20 embryos each were used.
3.2 色素沉着与甲状腺激素的关联
Wu等[32]使用BDE-99对斑马鱼染毒之后发现,BDE-99使斑马鱼体内T3含量下降,甲状腺素(T4)含量上升,并且造成转录组水平发生改变,后代存活率降低,体长和畸形率升高。这说明,母本斑马鱼暴露于BDE-99会导致后代发育毒性和甲状腺功能衰竭。这与笔者的研究结果相符,BDE-99或5-OH-BDE-99造成斑马鱼眼部色素沉着以及THRβmRNA表达量下降,也进一步证实了THRβ与眼部色素沉着之间的联系。
综上所述,研究发现,暴露于BDE-99或5-OH-BDE-99造成斑马鱼胚胎眼中的黑色素色素沉着强度降低,这种降低可能是由于BDE-99或5-OH-BDE-99与T3竞争性地与THRβ结合,造成甲状腺素的调节紊乱。
