BDE-47慢性暴露对小鼠顶叶皮质、海马和丘脑的影响
2020-02-03庄娟张佳琪汤潇马心如张丽娅李梦秋
庄娟,张佳琪,汤潇,马心如,张丽娅,李梦秋
1. 江苏省高校区域现代农业与环境保护协同创新中心,淮阴师范学院,淮安 223300 2. 江苏省环洪泽湖生态农业生物技术重点实验室,淮阴师范学院生命科学学院,淮安 223300 3. 江苏省药用植物生物技术重点实验室,江苏师范大学,徐州 221116
多溴联苯醚(PBDEs),是一种重要的阻燃剂,在化工、建材和电子等领域都有广泛应用。因PBDEs只添加于产品中,很容易释放到环境,成为全球性污染[1]。PBDEs具有化学结构稳定和生物蓄积性强的特点,可经食物链逐级放大后进入人体[2]。最受关注的是PBDEs对神经系统的危害性。研究表明,PBDEs对儿童具有潜在的神经发育毒性,可影响儿童智力[3]。动物实验证实了PBDEs对神经系统的危害[4-5]。顶叶皮质、海马和丘脑组织都与学习记忆有关[6-8]。众多的研究表明,PBDEs可影响海马组织[9],但对顶叶皮质和丘脑的影响尚不清楚。2,2’,4,4’-四溴联苯醚(BDE-47)是生物体内含量最多、毒性最强的PBDEs之一。笔者之前的研究已证实,BDE-47慢性暴露可导致小鼠学习记忆能力下降[5,10]。本研究主要探究BDE-47慢性暴露对学习记忆相关脑区——顶叶皮质、海马和丘脑组织的影响及作用机制,为进一步探明BDE-47神经毒机制提供实验依据。
1 材料与方法(Materials and methods)
1.1 实验动物
20只7周龄C57BL/6J小鼠购于北京维通利华实验动物技术有限公司。饲养温度(22±1) ℃,湿度50%±10%,光照时间7:30—19:30。自由进水和进食。
1.2 主要试剂和仪器
BDE-47购自Chem. Service公司(美国),纯度>99%;异氟烷购自深圳瑞沃德生命科技有限公司(中国);尼氏(Nissl)染色液购自上海碧云天生物技术有限公司(中国);抗NLRP3和Iba1抗体购自Novus公司(美国);In Situ Cell Death Detection Kit细胞死亡试剂盒购自Roche公司(美国);Trizol试剂盒购自Invitroge公司(美国);Takara反转录试剂盒和SYBR预混Ex Taq购自宝生物工程(大连)有限公司(中国)。
CM1850冰冻切片机购自Leica公司(德国);IX71荧光显微镜购自Olympus公司(日本);ViiA 7实时荧光定量PCR仪购自Steponeplus公司(美国)。
1.3 小鼠染毒处理
笔者之前的实验表明,20 mg·kg-1BDE-47处理8周可导致小鼠海马组织损伤和学习记忆能力下降[5,10]。本实验BDE-47暴露剂量和暴露方法按照笔者之前报道的方法进行[10]。BDE-47溶解于玉米油,配制浓度为20 mg·kg-1。小鼠分2组,每组10只,分别用玉米油和BDE-47灌胃,每日处理一次,共处理8周。实验结束后,小鼠禁食过夜后用异氟烷深度麻醉,取出脑组织,多聚甲醛4 ℃固定2 h。蔗糖梯度脱水后,脑组织进行冰冻切片,切片厚度为12 μm,获取相应区域的脑片。
1.4 尼氏染色
脑组织切片尼氏染色在室温下进行,染色5 min,去离子水洗3 min,无水乙醇蘸过后用二甲苯透明5 min,盖上盖玻片后用于观察。
1.5 免疫荧光染色
免疫荧光染色按照笔者之前报道的方法进行[5]。切片用含10%驴血清的封闭液室温封闭1 h。用抗NLRP3(1∶300)或Iba1(1∶500)抗体,4 ℃孵育过夜。二抗于室温下孵育1 h后,DAPI染核;荧光显微观察,挑取典型区域进行图像采集。
1.6 实时定量聚合酶链反应(PCR)
用Trizol试剂盒提取相应脑组织总RNA,按照Takara反转录试剂盒说明,以1 μg RNA为模板用于反转录互补DNA。用Takara SYBR预混的Ex Taq进行荧光定量实时PCR反应。IL-1β引物(5’-3’):AAATACCTGTGGCCTTGGGC,引物(3’-5’):CTTGGGATCCACACTCTCCAG。IL-6引物(5’-3’):GTCCTTCCTACCCCAATTTCCAA,引物(3’-5’):GAATGTCCACAAACTGATATGCTTAGG。GAPDH为内参,检测目的mRNA含量。
1.7 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)染色
脑切片先用胰蛋白酶37 ℃处理10 min。然后采用TUNEL反应混合液(Roche公司,美国)于37 ℃作用1 h,DAPI核染;荧光显微观察,凋亡细胞在520 nm激发光下发绿色荧光,挑取典型区域进行图像采集。
1.8 统计方法
实验数据使用SPSS 11.5统计软件One-Way ANOVA进行单因素方差分析和Tukey’s显著性分析,P<0.05为显著性差异。
2 结果(Results)
2.1 尼氏染色
脑组织经尼氏染色后,显微镜下选取与学习记忆相关的顶叶皮质、海马CA1区和丘脑组织进行观察并获取照片,结果如图1和图2所示。玉米油对照组小鼠顶叶皮质、海马和丘脑组织神经元形态饱满,细胞质较多,体积大,染色均匀,海马CA1区锥体细胞排列整齐有序;BDE-47暴露小鼠相应区域神经元细胞形态固缩不规则,细胞质少,细胞胞体小,海马CA1区锥体细胞排列散乱不规则。
2.2 NLRP3免疫荧光染色结果
脑组织经NLRP3特异性免疫荧光染色后,荧光显微镜下对顶叶皮质、海马CA1区和丘脑组织NLRP3的表达情况进行观察并拍照。结果表明,在小鼠脑组织内,NLRP3在顶叶皮质、海马CA1区锥体细胞层和丘脑区域都有表达,主要表达在细胞质。与对照组相比,BDE-47处理组小鼠顶叶皮质、海马CA1区锥体细胞和丘脑区域NLRP3表达均增强(图3~图5)。
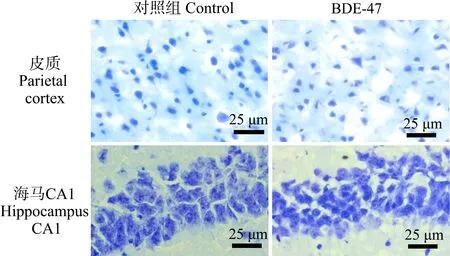
图1 小鼠顶叶皮质和海马显微结构图(焦油紫染色)Fig. 1 The representative images of the parietal cortex and hippocampus regions of mice (stained with crystal violet)
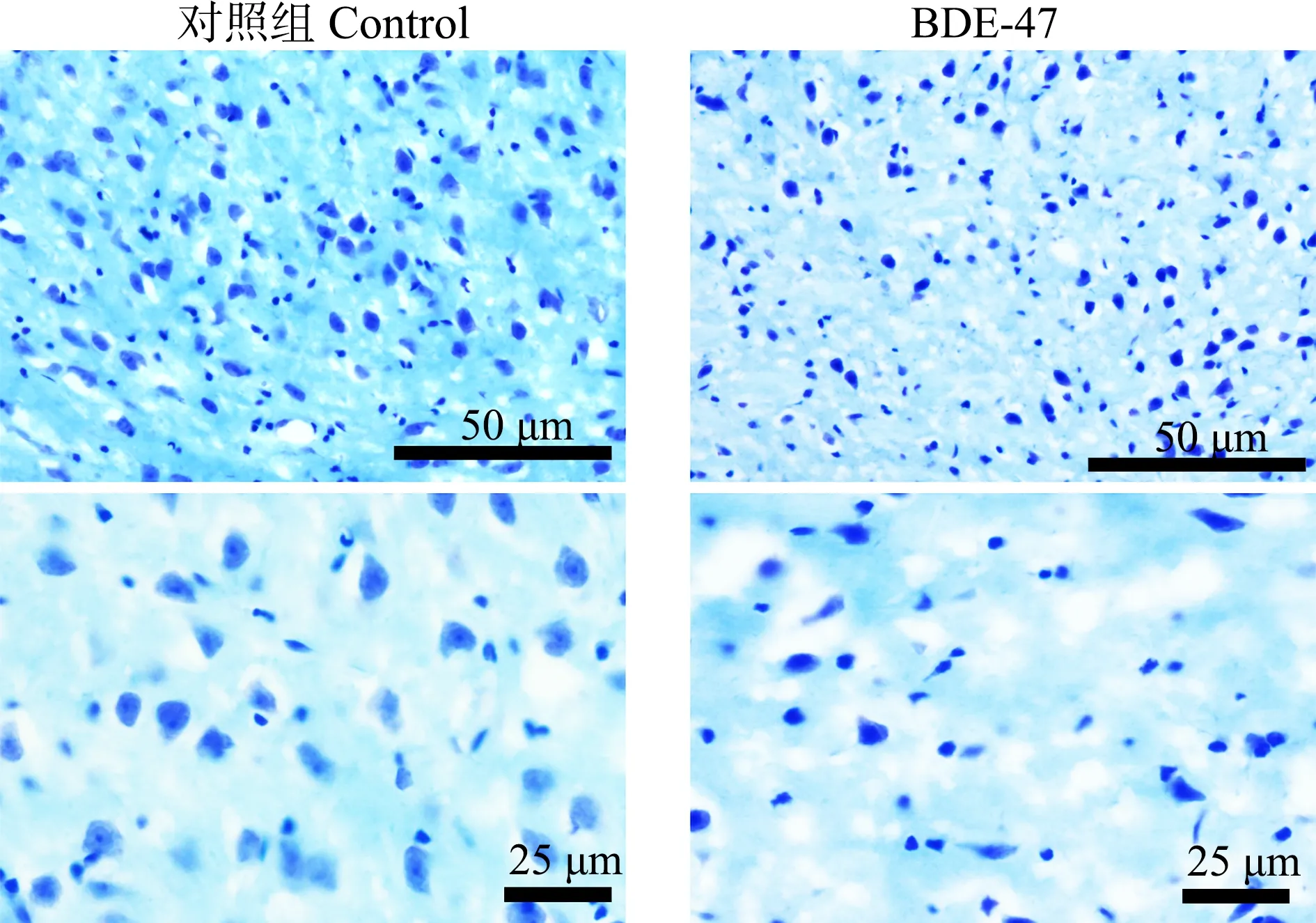
图2 小鼠丘脑组织显微结构图(焦油紫染色)Fig. 2 The representative images of the thalamus region of mice (stained with crystal violet)
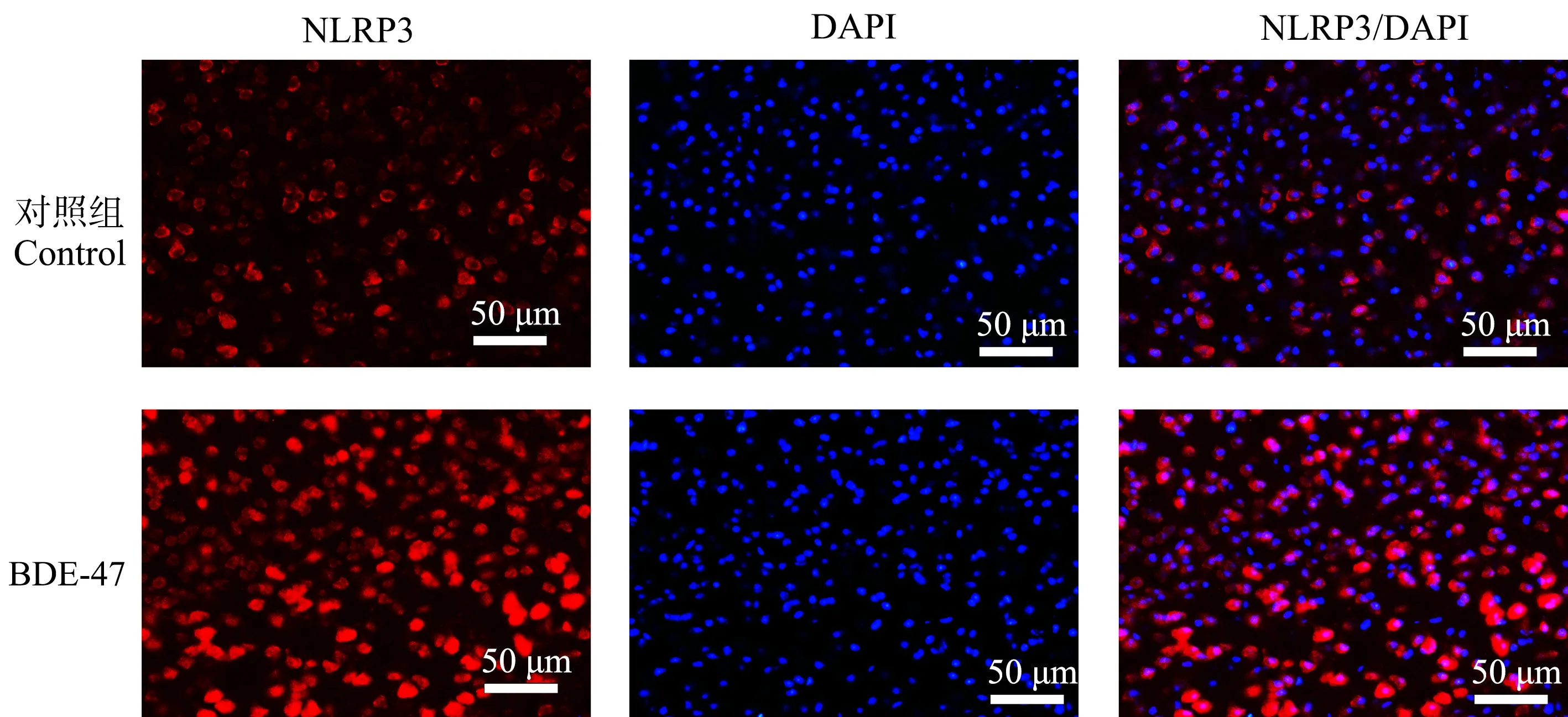
图3 小鼠顶叶皮质NLRP3免疫荧光染色结果Fig. 3 The representative images of NLRP3 immunofluorescence staining in the parietal cortex region of mice
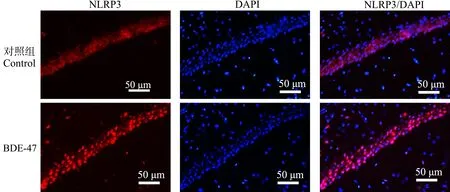
图4 小鼠海马组织NLRP3免疫荧光染色结果Fig. 4 The representative images of NLRP3 immunofluorescence staining in the hippocampus region of mice
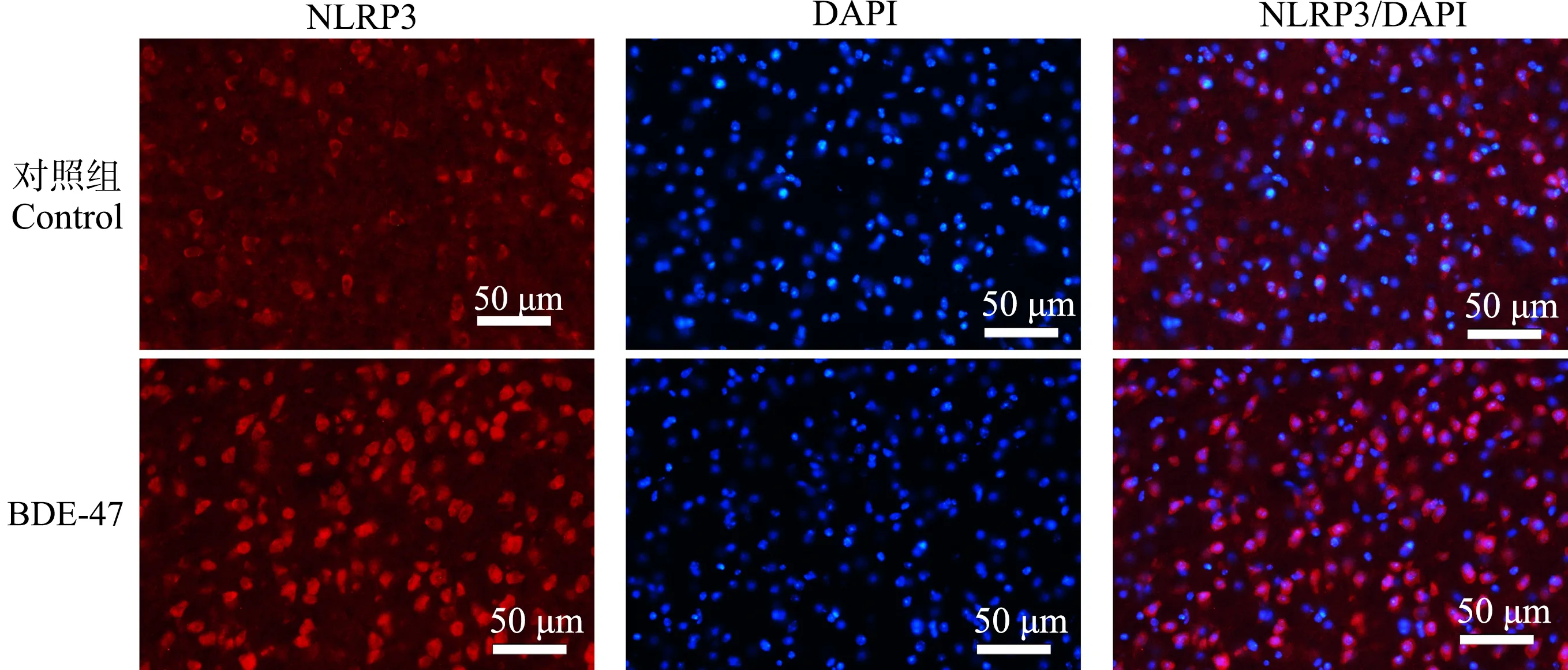
图5 小鼠丘脑组织NLRP3免疫荧光染色结果Fig. 5 The representative images of NLRP3 immunofluorescence staining in the thalamus region of mice
2.3 Iba1免疫荧光染色结果
Iba1是神经系统中小胶质细胞的标记蛋白。脑组织经Iba1特异性免疫荧光染色后,在荧光显微镜下对顶叶皮质、海马CA1区和丘脑组织中小胶质细胞的形态和分布进行观察并拍照。结果表明,在对照组小鼠脑组织内,小胶质细胞多呈短棒状,胞体较小,在顶叶皮质内分布较多,在海马CA1区次之,在丘脑内分布稀少。慢性BDE-47暴露后,小鼠顶叶皮质、海马CA1区和丘脑内Iba1信号增强;小胶质细胞形态发生改变,胞体增大(图6~图8)。这些结果表明,BDE-47可激活小鼠顶叶皮质、海马和丘脑组织内的小胶质细胞。
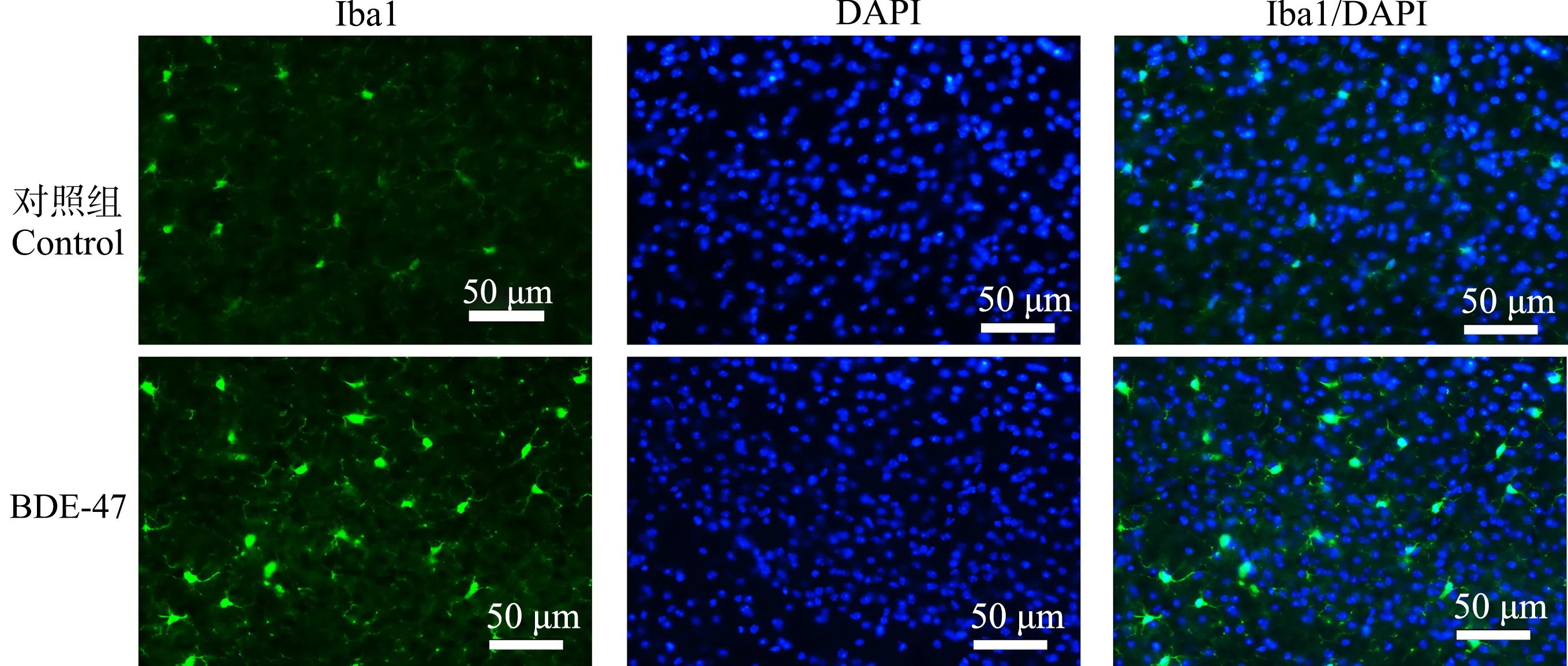
图6 小鼠顶叶皮质Iba1免疫荧光染色结果Fig. 6 The representative images of Iba1 immunofluorescence staining in the parietal cortex region of mice
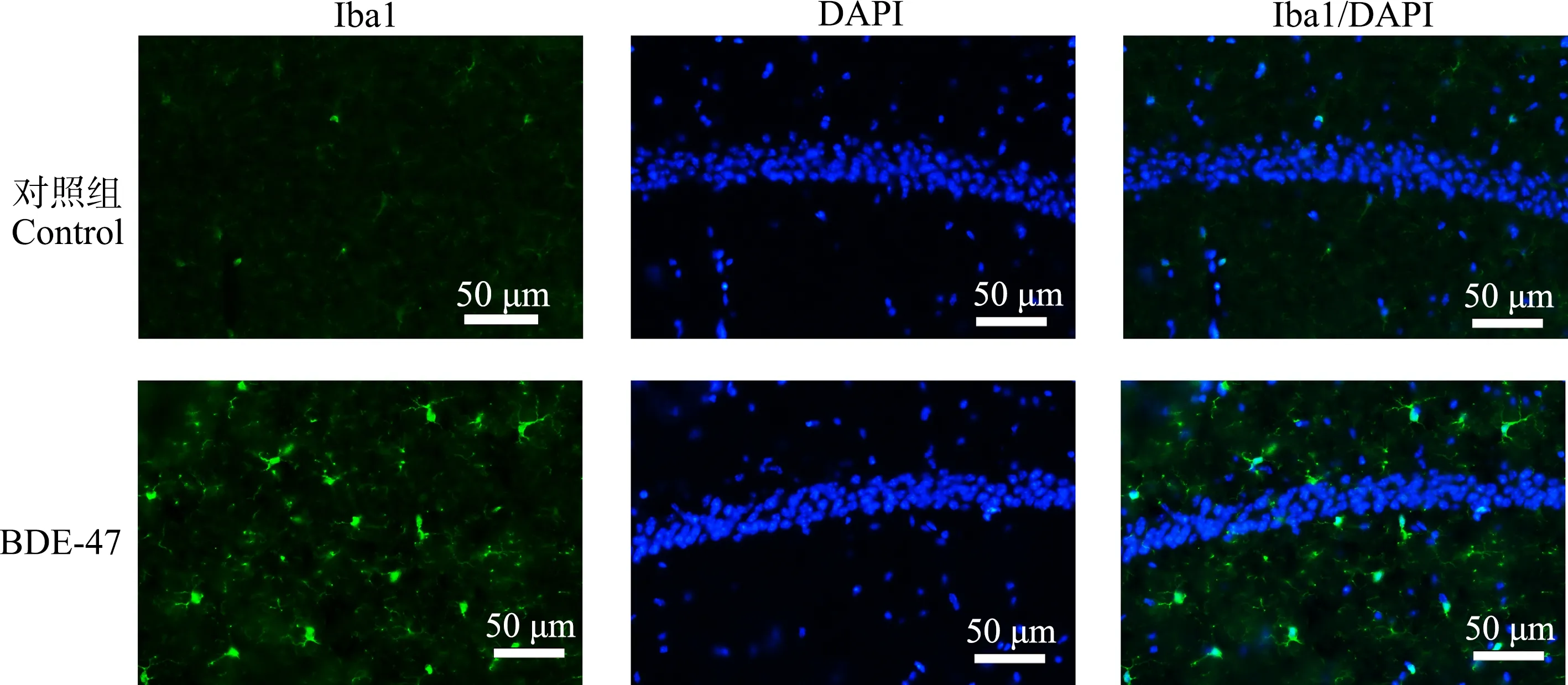
图7 小鼠海马组织Iba1免疫荧光染色结果Fig. 7 The representative images of Iba1 immunofluorescence staining in the hippocampus region of mice
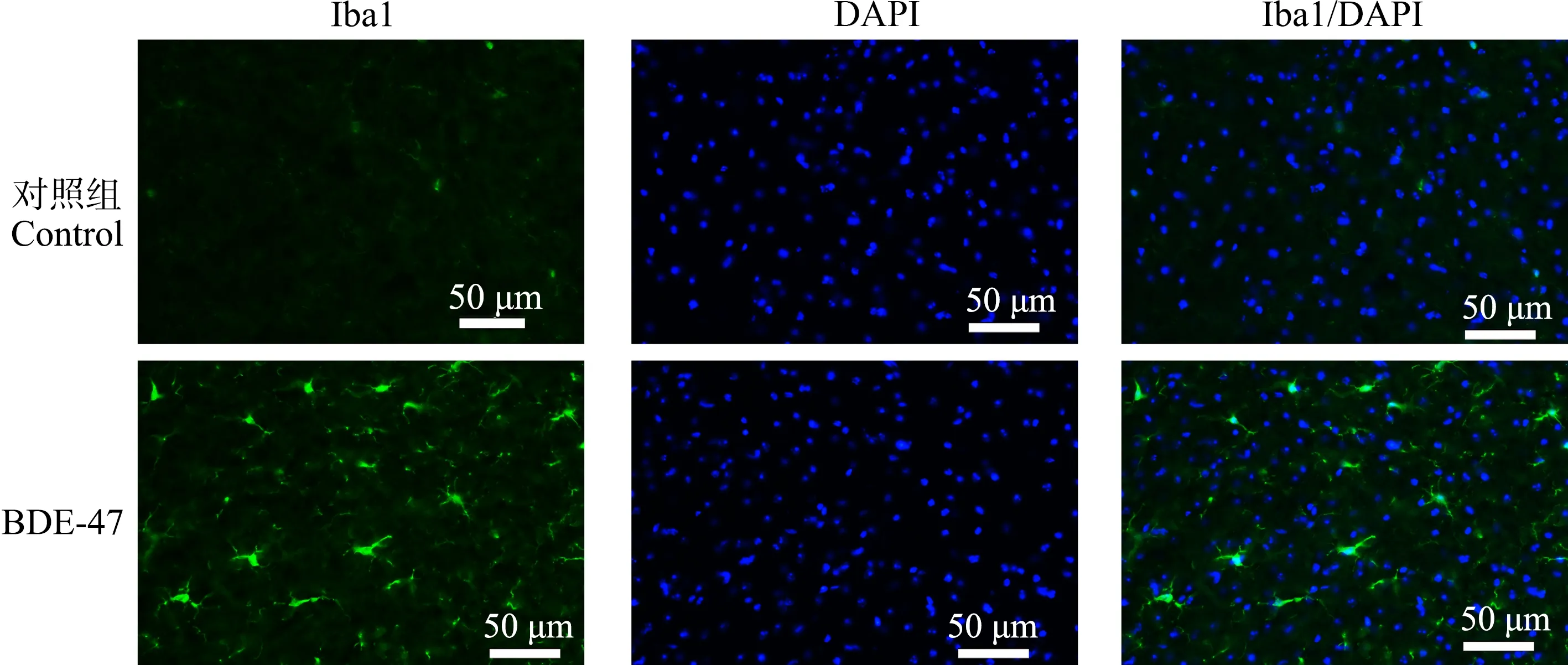
图8 小鼠丘脑组织Iba1免疫荧光染色结果Fig. 8 The representative images of Iba1 immunofluorescence staining in the thalamus region of mice
2.4 炎症因子表达情况
实时定量PCR结果如图9所示,与对照组相比,BDE-47暴露显著促进了小鼠顶叶皮质、海马和丘脑组织炎症因子IL-1β(顶叶皮质P<0.01;海马P<0.05,丘脑P<0.05)和IL-6 (顶叶皮质P<0.01;海马P<0.05,丘脑P<0.05)基因的表达。
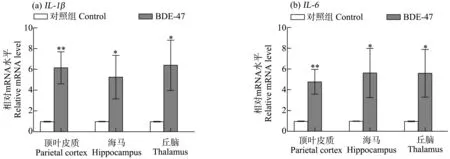
图9 BDE-47对小鼠顶叶皮质、海马和丘脑组织IL-1β和IL-6基因表达的影响(n=3)注:与对照组相比,*P<0.05、**P<0.01。Fig. 9 BDE-47 enhances the mRNA expression of IL-1β and IL-6 in the parietal cortex, hippocampus and thalamus of mice (n=3)Note: *P<0.05, **P<0.01 versus the control group.
2.5 TUNEL染色结果
脑组织TUNEL染色后,在荧光显微镜下对顶叶皮质、海马CA1区和丘脑组织中TUNEL阳性细胞进行观察并拍照。结果如图10所示,对照组小鼠的相应脑区TUNEL阳性细胞很少。经BDE-47暴露后的小鼠顶叶皮质、海马CA1锥体细胞层和丘脑组织TUNEL阳性细胞增多。
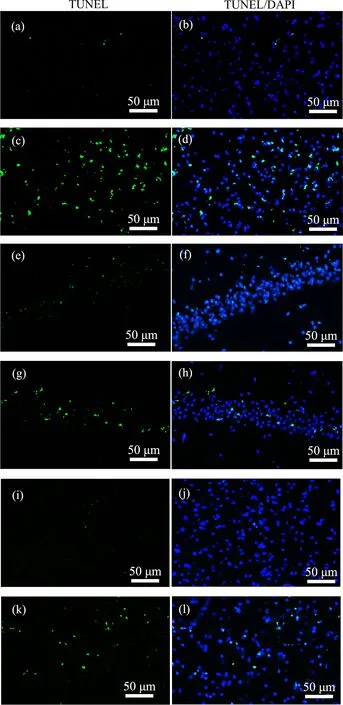
图10 小鼠顶叶皮质、海马和丘脑组织TUNEL染色结果注:(a)和(b)为对照组顶叶皮质;(c)和(d)为BDE-47组顶叶皮质;(e)和(f)为对照组海马组织;(g)和(h)为BDE-47组海马组织;(i)和(j)为对照组丘脑组织;(k)和(l)为BDE-47组丘脑组织。Fig. 10 Representative images of the fragmented DNA (TUNEL assay) in the parietal cortex, hippocampus and thalamus regions of miceNote: (a) and (b) show parietal cortex of control mice; (c) and (d) show parietal cortex of BDE-47-treated mice; (e) and (f) show hippocampus of control mice; (g) and (h) show hippocampus of BDE-47-treated mice; (i) and (j) show thalamus region of control mice; (k) and (l) show thalamus region of BDE-47-treated mice.
3 讨论(Discussion)
神经毒性是PBDEs影响人类健康的重要方面。发育期遭受PBDEs暴露的婴幼儿表现为智力和行为异常[3]。实验证据表明,PBDEs暴露导致的学习记忆能力下降与海马组织受损有关[9]。顶叶皮质在学习及记忆提取过程中具有重要作用[6]。以往的研究表明,BDE-71[11]和BDE-99[12]可影响大脑皮质神经递质系统,BDE-209暴露可改变小鼠大脑皮质的氧化状态[13]。但BDE-47暴露是否影响皮质尚不清楚。此外,丘脑也是参与认知功能的重要脑区[8],但PBDEs是否对丘脑有损伤尚未知晓。笔者之前的实验结果表明,BDE-47慢性暴露可引起小鼠学习记忆能力下降。本实验用尼氏染色法检测学习记忆相关脑区——顶叶皮质、海马和丘脑组织的组织病理学变化。结果表明,成年小鼠经慢性BDE-47暴露后,学习记忆的关键脑区——海马组织的CA1区锥体细胞排列紊乱,神经元皱缩变小。此外,其顶叶皮质和丘脑组织神经细胞细胞质少,胞体变小,形态固缩不规则,这表明,慢性BDE-47暴露不仅影响海马组织,还可损伤顶叶皮质和丘脑组织。
慢性神经炎症是造成神经元功能损伤的重要原因[14],而NLRP3炎症体与慢性神经炎症的发生和发展有关[15]。NLRP3通过与ASC-caspase-1结合形成促炎平台,产生IL-1β和IL-18炎症因子。笔者之前的研究结果表明,慢性BDE-47暴露导致的小鼠海马组织损伤与NLRP3炎症体激活有关[10]。本实验结果与前期结果相一致,慢性BDE-47暴露促使小鼠海马CA1区NLRP3荧光信号增强。同时,炎症因子IL-1β和IL-6基因表达水平相应上升。此外,笔者发现,BDE-47暴露后,小鼠顶叶皮质和丘脑组织也出现NLRP3荧光信号变强以及IL-1β和IL-6基因表达升高的现象。小胶质细胞是中枢神经系统内固有的免疫效应细胞,介导中枢神经系统损伤的内源性免疫反应[16]。当脑神经系统紊乱或发生炎症时,小胶质细胞被迅速激活,表现为胞体增大,细胞呈圆形或杆状。Iba1是小胶质细胞的标记蛋白,小胶质细胞被激活时,Iba1的表达量上调[17]。本实验结果表明,BDE-47可导致小鼠顶叶皮质、海马和丘脑组织Iba1免疫荧光信号上调,表明小胶质细胞被激活。这些结果表明,NLRP3炎症体活化介导的神经炎症反应可能与BDE-47暴露致小鼠顶叶皮质、海马及丘脑组织损伤有关。
笔者和其他学者均发现,BDE-47的神经毒作用机制与神经细胞凋亡异常增强有关[10,18]。众多的研究证据表明,NLRP3炎症体激活介导的慢性炎症是促进神经细胞凋亡的重要因素[19]。本实验研究表明,虽然对照组小鼠顶叶皮质、海马和丘脑组织也存在TUNEL阳性细胞,但数量很少。BDE-47暴露导致小鼠顶叶皮质、海马和丘脑组织TUNEL阳性细胞增多,这说明,BDE-47通过促进神经细胞凋亡最终导致顶叶皮质、海马和丘脑组织损伤。
总之,本研究结果提示,慢性BDE-47暴露可损伤小鼠顶叶皮质、海马和丘脑组织,其毒性机制可能与NLRP3炎症体激活介导的慢性神经炎症及神经细胞凋亡有关。
