有机硒F0代暴露对子代软骨发育的影响
2020-02-03楚文庆葛葳王欢杨景峰董武
楚文庆,葛葳,王欢,杨景峰,董武
内蒙古民族大学动物科技学院,内蒙古毒物监控及毒理学重点实验室,通辽028000
硒元素是人体和动物必需的微量元素,具有独特的生物学功能,在有机体的生长、发育和预防疾病过程中,发挥着极其重要的作用[1]。硒具有较高的抗氧化作用,其中有机硒生物利用率较无机硒高,且有较低的毒性,从而得到了广泛的应用[2-3]。有机硒已成功应用在饲料领域,常将有机硒作为添加剂来补充必需微量元素硒,提高牲畜生产能力。随着硒与人类健康关系的深入研究,含硒药物的研发也成为国内外学者研究的热点,研究主要集中于有机硒在抗肿瘤、抗炎和抗高血压等方面的作用[4-5]。然而,对有机硒的毒性效应和作用机制的研究尚显不足。
目前,硒对环境的污染和危害已多见报道。已有研究表明,部分湖水中硒浓度达到20 μg·L-1,鱼类饵料(无脊椎动物)中的硒的质量浓度达到4~13 mg·kg-1(以湿质量计)[6]。Muscatello和Janz[7]通过对鱼群进行分析,发现鱼体出现鳃肿胀、贫血、眼球突出以及脊椎、头、嘴和鳍条等发生畸形现象;同时发现有机硒造成了鱼类下一代的畸形和缺陷。美国北卡罗来纳州的Belews湖硒污染事件,是因为火力发电厂的燃煤中含有大量的硒元素,排放后造成了周边河流的污染,从20世纪70年代中期开始,含硒污水便源源不断排入河流,通过河流进入湖中;相比之下,周边非硒污染的水体,硒质量浓度约为Belews湖的1/10~1/20,生物体内的硒质量浓度约为Belewas湖内生物体的1/10~1/50,在Belews湖中生存的20种鱼中,除了食蚊鱼存活外,其他鱼类均已灭亡;由此可见,硒污染造成了严重的毒性效应[1]。1986年底,电厂停止排放含硒污水,但是鱼类种群的恢复速度依旧十分缓慢;经过10年时间,鱼类种群虽然有所恢复,但仅有4种,其中,一种是仅存的食蚊鱼,一种是消失后又恢复的,另外2种是从其他环境引入的[1]。有关有机硒对水生生物的生态毒性研究有待深入[8]。
青鳉鱼(medaka)作为一种重要的水生动物模型,在特定条件下,可以通过控制饲料和水中有毒物质的暴露水平进行毒性实验。青鳉鱼早期发育时,身体透明且发育速度适中,因此,可以有充足的时间,对发育状况进行详细的观察和检测[9-11]。使用成年青鳉鱼考察有机硒饲料对其子代(F1)的影响,有独特的优势[12-13]。青鳉鱼属于异性繁殖,其个体卵泡的卵黄发生过程和相关卵母细胞的成熟需要72 h以上[14-15],暴露的时间至关重要[16]。在此期间,为成熟的卵母细胞提供营养和微量元素的饲料可能与观察到的结果有关联[12,16]。因此,本研究以青鳉鱼为实验动物模型,用含有机硒的饲料饲喂F0代亲本(父本单独、母本单独,以及父本、母本同时),对比研究不同暴露条件对F1代幼鱼早期发育的影响,包括胚胎孵化率、幼鱼存活率、畸形类型和畸形率,并通过基因转录水平进行验证。通过上述研究可以获得有机硒的传代毒性数据,为有机硒的健康和生态风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 青鳉鱼的培育
青鳉鱼由内蒙古民族大学毒物监控及毒理学重点实验室提供。将成鱼饲养在28 ℃的封闭循环水系统中,14 h∶10 h的光照/黑暗交替,每天喂食3次商业干饲料(Pen-tair Aquatic Eco-Systems,Apopka,美国佛罗里达州)和2次卤虫。青鳉鱼繁育已经超过3 a,孵化率达到85%以上。已经成功用于对各种脏器的毒性研究,包括病理组织学和基因水平的研究等[17]。
1.2 饲料制备
在预实验中,分别测试了含2、10和50 μg·g-1干重(即1 g普通干饲料中含有2、10和50 μg有机硒)有机硒的饲料对青鳉鱼胚胎的影响。其中,含2 μg·g-1有机硒的饲料没有产生显著影响,死亡率增高不明显;10 μg·g-1处理组中出现畸形的胚胎超过20%;50 μg·g-1处理组中死亡胚胎个数增加。因此,笔者选择5 μg·g-1的有机硒浓度进行进一步测试,并选择暴露时间为14 d。
制备含有5 μg·g-1干重硒代-L-甲硫氨酸(西格玛,美国,纯度98%)的干燥饲料,具体方法如下。首先,配制含有1 mg·mL-1有机硒的储备溶液,溶剂为MilliQ水(Millipore,Milli-Q INTEGRAL 5 A10 Water Purification System,美国)。然后,在玻璃培养皿中倒入超过20 g的干燥饲料,并用刮刀彻底混合以确保液体均匀分布。接着,用刮刀将混合物在培养皿的底部展开,以增加表面积促进干燥,再将培养皿置于4 ℃的封闭容器中保存。为促进饲料干燥,每天将饲料分开并搅拌,露出额外的表面区域进行干燥。当饲料颗粒处于或非常接近其原始大小后,再继续干燥1周。在喂食时将饲料储存在密闭容器中,以防止水分进入。
1.3 F0代亲本暴露方案
暴露方案参照Chernick等[18]的方法进行。从繁育群体中随机选择性成熟雄性和雌性青鳉鱼(6~9个月),将雄性和雌性分离并观察1周,通过确认可存活的胚胎来确定个体的生殖状态。将选定的鱼转移到实验缸,并参考自然环境冬季的光照条件保持9 h∶15 h的光照/黑暗时间。在3 L的鱼缸中分别放入雄性(5 只·缸-1)和雌性(3 只·缸-1),在24 ℃条件下孵育。实验缸内水体使用前曝气并过夜,配制成千分之一盐水。把鱼随机分配到4个组:(1)母本暴露,父本未暴露;(2)母本未暴露,父本暴露;(3)母本暴露,父本暴露;(4)母本未暴露,父本未暴露(对照)。每组处理3个重复。
实验之前,鱼在饲养缸内适应3 d,喂食时间表为每天3次,在前2次喂食期间补充无节虫幼体卤虫。在适应期后,根据该时间表将鱼喂养14 d,每天加入约1%体重的对照饲料,卤虫液体量减少到每次补充3滴,以确保完全摄入干燥的饲料。暴露14 d后,将成年鱼轻轻地从罐中取出并冲洗,将罐彻底清洗,并将补充的其他性别的成鱼混合到育种组中。在繁殖期间,鱼类保持相同的饲喂时间表并控制饲料用量,卤虫溶液的量恢复正常以促进产卵。每日虹吸脏污及粪便,以保持水体清洁,并减少缸内废物中积累的有机硒。观察成鱼的正常活动、喂养状况和应激迹象。
1.4 F1代卵的收集和观察
成鱼暴露实验结束后,在每次喂食后约20 min时从缸底部虹吸,每天收集含胚卵,连续6 d,或者在每天结束时直接收集卵块。将胚胎放在湿润的纸巾上轻轻滚动以分离并清洁,然后转移到标有收集日期和罐号的培养皿(VWR International,美国)。对未受精和受精的胚胎进行分别计数,并将前者丢弃。受精鱼卵置于0.1%(W/V)人工盐溶液中,每天更换溶液,并在28 ℃的培养箱中保持14 h∶10 h的光照/黑暗循环,在缓慢移动的振荡器上晃动,直至孵化。
根据Iwamatsu[19]的方法,在立体显微镜(Nikon SMZ1500, USA)下每天检查每个培养皿中的个体发育情况。畸形种类根据文献[17,20-21]中所用的标准确认,这些类别包括死亡率、孵化时间、颅颌畸形、颌骨大小和形状的变化,特别是头部畸形、心囊与卵黄囊水肿情况、眼睛是否对称、色素是否沉积、脊索畸形、血液流通速度,以及在孵化后个体中鳔是否扩充等各种表型,列出各种表型,计算出表型总和。拍摄受精后3、6和10 d的幼鱼,比较对照组与暴露组胚胎的变化(Nikon, DXM1200,NIS-Elements 3.20.01,日本)。
1.5 软骨染色
幼鱼用质量比为10%的甲醛溶液固定24 h后,用质量比为0.1%的Alcian blue 8 GX、体积比为80%的甲醇和体积比为20%的醋酸染色6 h,然后用体积比为75%、50%的酒精以及蒸馏水各浸泡3 h,再用0.05%的胰酶饱和四硼酸盐、质量比为1%的KOH和体积比为30%的H2O2各处理1 h,最后在体积比为70%的甘油中保存并观察。
1.6 苏木-伊红染色
使用质量比为10%的中性缓冲甲醛溶液固定青鳉鱼胚胎于4 ℃过夜。分别用酒精脱水、二甲苯脱水透明后,用石蜡进行包埋处理。包埋后的标本作成5 μm的切片,脱石蜡,然后进行苏木精-伊红(HE)染色,用光学显微镜对标本进行观察。
1.7 RNA的提取及基因实时定量PCR(RT-PCR)测定
RNA提取:采用Trizol法制备总RNA,用Trizol (赛默飞世尔科技(上海)有限公司)裂解细胞后,加入氯仿并离心使之分为水相和有机相2层;转移RNA所在的水相,并用异丙醇沉淀RNA,经体积比为80%的乙醇洗涤后用水(RNase free)溶解;制备的RNA样品用核酸定量分析仪检测OD260、OD260/OD280的值,并计算RNA产量。
反转录:在体系中加入5×Buffer 4 μL、5 mmoL·L-1dNTP 4 μL、反转录抑制剂1 μL、AMV (5 U·μL-1)反转录酶2 μL、特异下游引物1 μL、模板5 μL,最后加焦碳酸二乙酯水(DEPC水)至20 μL;在42 ℃下保持60 min后,冰水中冷却2 min。
Sybr Green Ι RT-PCR方法的建立:在25 μL反应体系中,加入Sybr Green Ι PCR反应混合液12.5 μL、上下游引物各1 μL、cDNA 1 μL、水9.5 μL;在95 ℃下保持10 min,然后在95 ℃下保持15 s,60 ℃、1 min条件下反应40个循环。
内参基因选择以及计算:试验采用18s作为内参基因,采用2-△△CT方法来计算基因表达的相对变化。
1.8 统计分析
对10 dpf (days post fertilizaion)的存活率(或孵化、鳔的膨胀情况)进行个体异常发育的评估。使用非参数单向Kruskal-Wallis分析暴露组的显著差异。在P≤0.05时,差异显著。
2 结果(Results)
母本、父本单独暴露、以及母本、父本同时暴露于有机硒后,所产鱼卵的生存率显著低于对照组,分别是对照组的50%以下(P<0.01),并且死亡率随时间推移不断增加(图1(a))。在各个有机硒暴露组都出现了不同程度的畸形,如心囊水肿、卵黄囊水肿、血液停滞、视网膜色素沉积减弱、鳔开启障碍、单眼、颅面畸形、下颌突出和脊索弯曲(图2~图4)等。经过统计,父本、母本单独暴露组,以及母本、父本同时暴露组,与对照组相比,总畸形率分别是对照组的4倍、9倍和9.2倍(P<0.01),且母本单独暴露组比父本单独暴露组差异更明显(图1(b))。
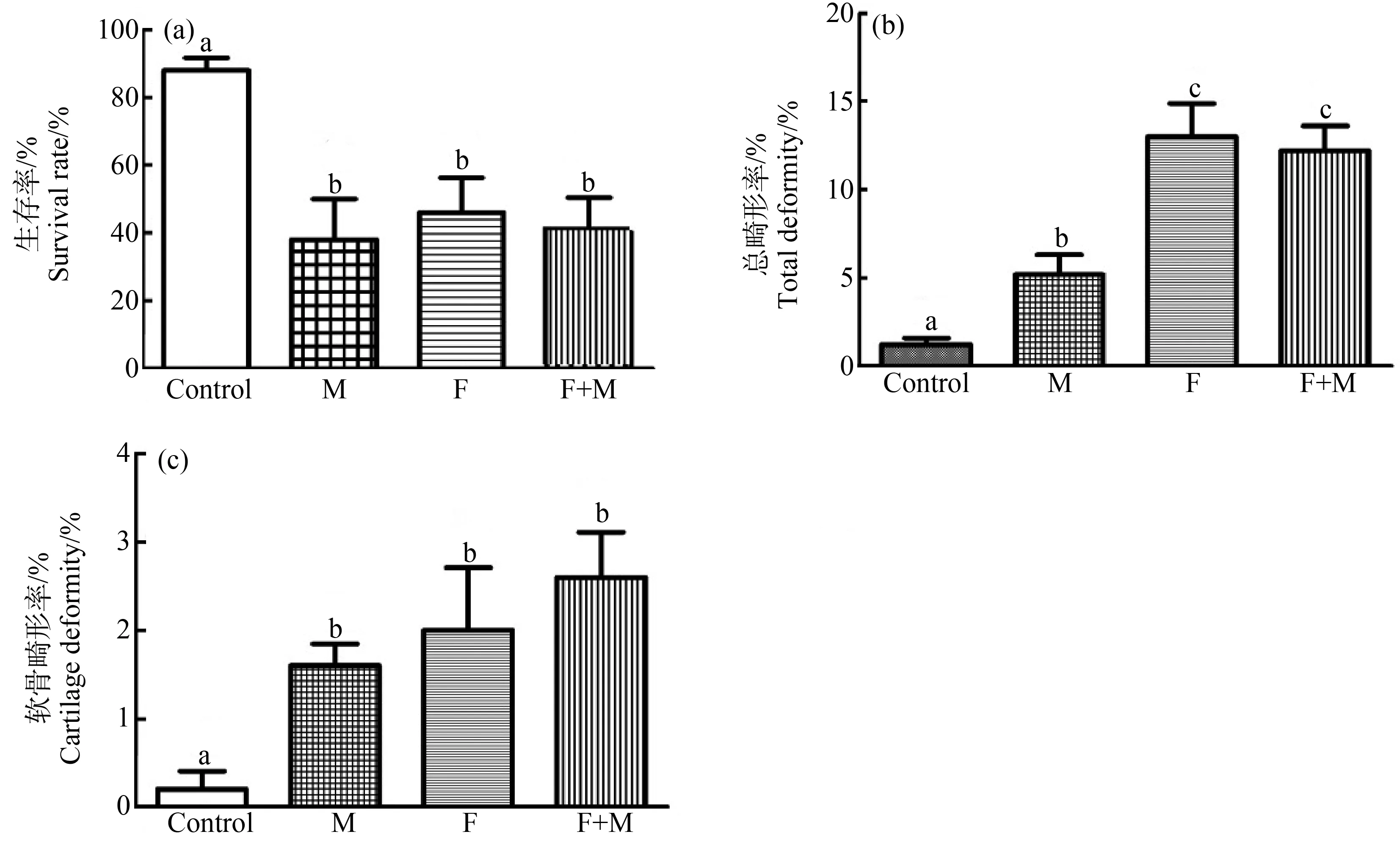
图1 有机硒暴露引起F1代青鳉鱼胚胎死亡率、总畸形率和软骨畸形率增高注:M为父本单独暴露组,F为母本单独暴露组,F+M为母本、父本双方同时暴露组;不同字母表示差异显著(P<0.05);有机硒饲喂14 d后,连续收集青鳉鱼卵5次,发育至10 d后进行综合统计分析。Fig. 1 Seleno-L-methionine (Se-Met) causes increased mortality, total deformity and cartilage deformity in medaka embryos of the F1 generationNote: M. Paternal exposure group, F. Maternal exposure group, F+M. Maternal and patental exposure group; the different letters indicate significant difference (P<0.05); male-only, female-only, and male and female of F0 parental medaka were fed with Se-Met for 14 d, and medaka embryos were continuously collected for 5 times; after 10 d of development, comprehensive statistical analysis was performed.

图2 有机硒引起F1代青鳉鱼胚胎畸形注:当给父本单独(M)、母本单独(F)或者父本和母本双方同时(M+F)饲喂有机硒14 d后,让其交配产卵,连续收集青鳉鱼卵5次,发育至3 d和6 d进行镜下观察;箭头在(f)、(g)和(h)图中分别指示管状心脏、停止的血流和单眼发育。Fig. 2 Se-Met causes deformity in medaka embryos of the F1 generationNote: Male-only (M), female-only (F), and male and female (F+M) of F0 parental medaka were fed with Se-Met for 14 d, medaka embryos were continuously collected for 5 times, and microscopic observation at 3 d and 6 d; the arrows indicate the tubular heart, stopped blood, and monocular development in (f), (g), and (h), respectively.
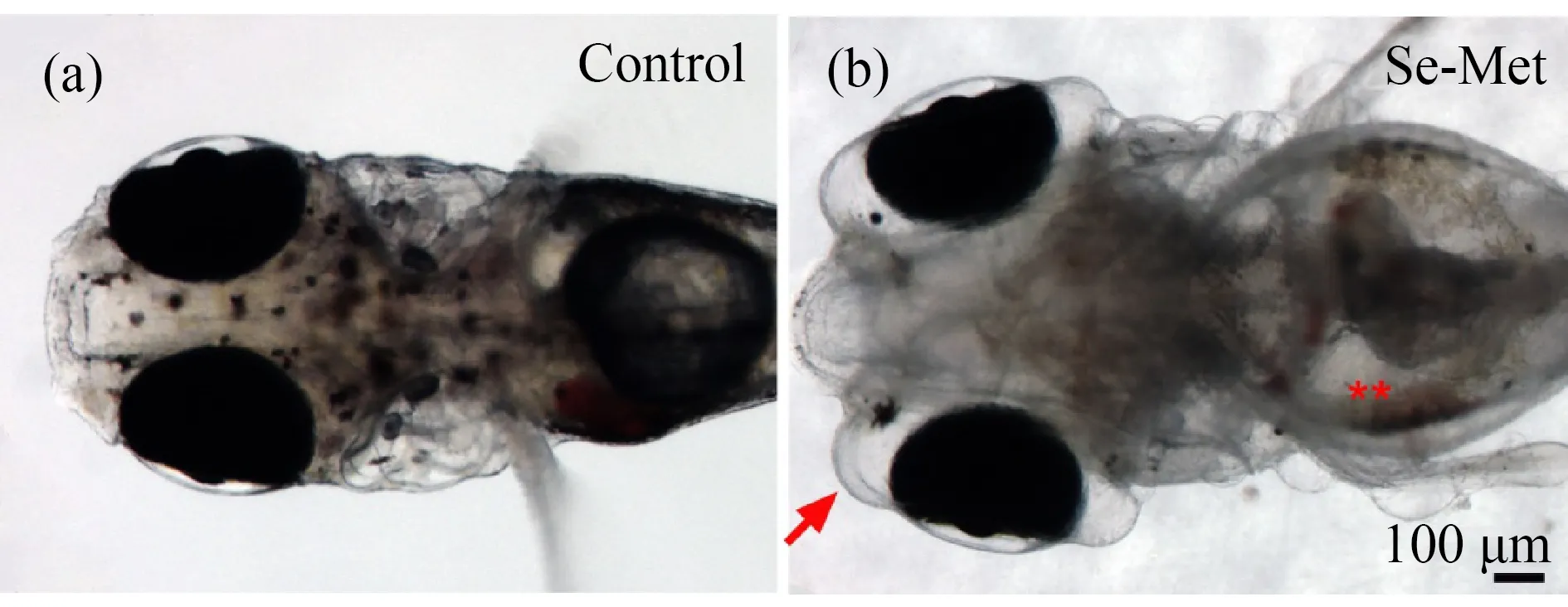
图3 有机硒引起F1代青鳉鱼幼鱼水肿注:(a) 对照组,(b) 母本、父本双方同时暴露组;有机硒饲喂14 d后,连续收集青鳉鱼卵5次,发育至10 d进行镜下观察;(b)中箭头指示眼球周边水肿,**指示卵黄囊水肿。Fig. 3 Se-Met causes edema in larva of the F1 generation medakaNote: (a) control group, (b) exposure group (male and female); male and female of F0 parental medaka were fed with Se-Met for 14 d, medaka embryos were continuously collected for 5 times, and microscopic observation at 10 d; arrows in (b) indicate edema around the eyeball, and **indicates edema of the yolk sac.
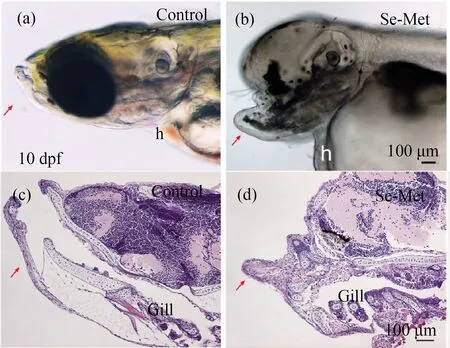
图4 有机硒引起F1代青鳉鱼幼鱼下颌突出注:(a)和(c) 对照组,(b)和(d)母本、父本双方同时暴露组;有机硒饲喂14 d后,连续收集青鳉鱼卵5次,发育至10 d进行镜下观察;h表示心脏,红色箭头指示畸形的下颌。Fig. 4 Se-Met causes jaw protrusion in larva of the F1 generation medakaNote: (a) and (c) control group, (b) and (d) exposure group (male and female); male and female of F0 parental medaka were fed with Se-Met for 14 d, medaka embryos were continuously collected for 5 times, and microscopic observation at 10 d; h indicates heart, and the red arrow indicates the deformed lower jaw.
在众多畸形中,下颌骨延伸尤为突出(图4(b)和(d)),与对照组相比,头部发育畸形和下颌畸形的发生率在各暴露组具有显著差异(P<0.05),父本、母本单独暴露组,以及母本、父本双方同时暴露组中畸形率分别为对照组的7倍、9倍和10倍(P<0.01)(图1(c)),其中,母本单独暴露组和母本、父本双方同时暴露组比父本单独暴露组的畸形发生率更高。经过组织切片结果确认,下颌鳃弓出现显著的增生(图4(b)和(d))。经过软骨染色,也能够检测到下颌与颅面软骨的变形(图5(f)、(g)和(h))和脊索弯曲(图5(c)和(d))。
为查明软骨畸形出现的机制,本研究进行了软骨关联基因的检测,包括SOX9a、SOX9b和Collagen2a1。结果表明,SOX9a的表达在各个组间没有显著差异,但各暴露组都有增高的趋势,而SOX9b基因表达在父本单独暴露时没有显著差异,母本单独暴露以及母本、父本双方同时暴露时都出现显著的增高,分别是对照组的2.6倍和2.57倍(P<0.05)(图6(a)和(b))。SOX9s下游基因,与软骨合成直接相关的Collagen2a1,在各个暴露组都出现显著的表达增高,都达到对照组的4倍以上(P<0.05)(图6(c))。

图5 有机硒对F1代青鳉鱼幼鱼骨骼的影响注:M为父本单独暴露组,F为母本单独暴露组,F+M为母本、父本双方同时暴露组;有机硒饲喂14 d后,连续收集青鳉鱼卵5次,发育至10 d进行阿尔新兰软骨染色,镜下观察;红色箭头指示下颌。Fig. 5 Effect of Se-Met on the larva’s bone of the F1 generation medakaNote: M. Paternal exposure group, F. Maternal exposure group, F+M. Maternal and patental exposure group; male-only, female-only, and male and female of F0 parental medaka were fed with Se-Met for 14 d, medaka embryos were continuously collected for 5 times, and Alcian blue cartilage staining was performed when the embryo developed to 10 d; the red arrow indicates the lower jaw.
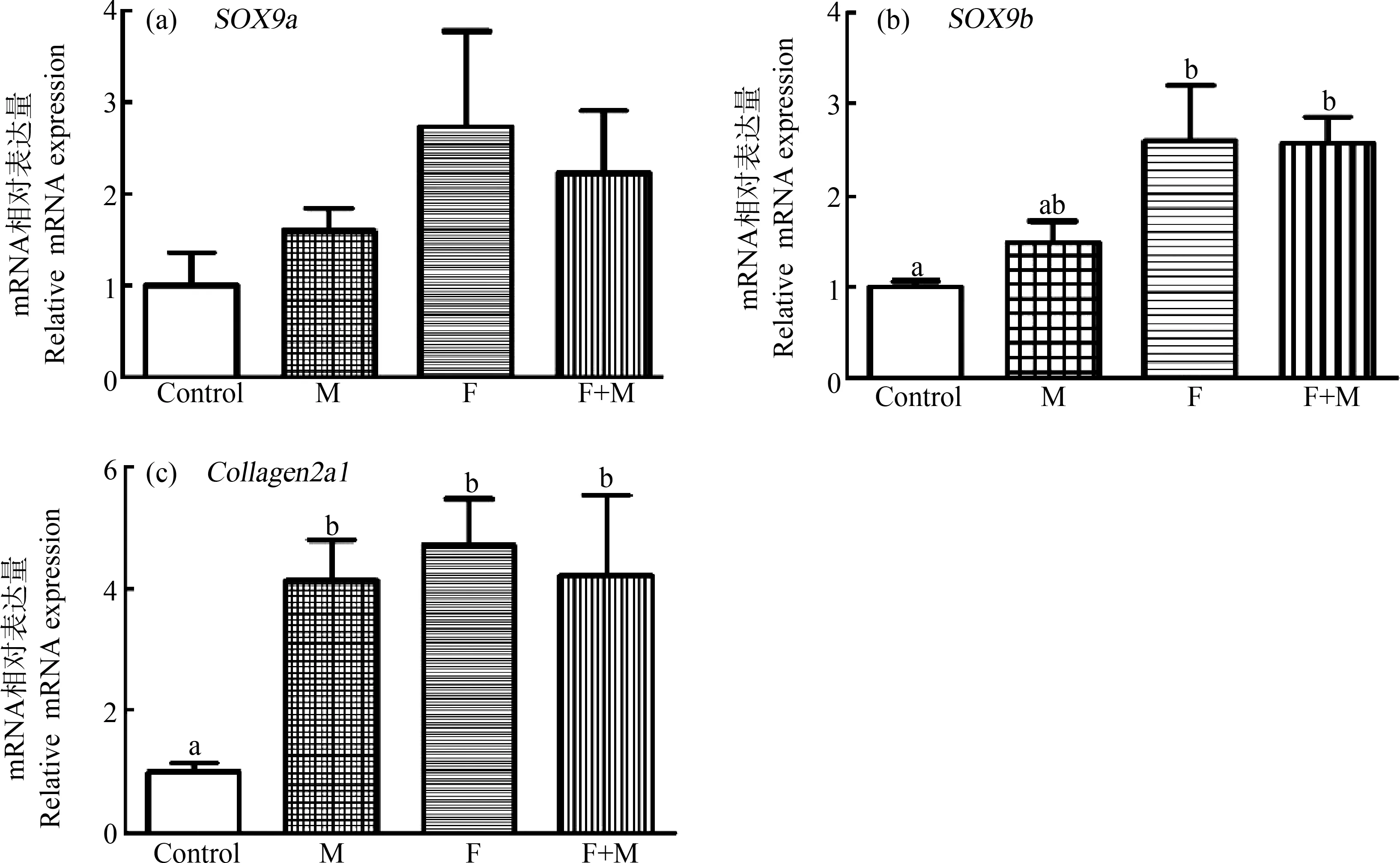
图6 有机硒诱导F1代青鳉鱼幼鱼骨骼关联基因表达的增加注:M为父本单独暴露组,F为母本单独暴露组,F+M为母本、父本双方同时暴露组;不同字母表示差异显著(P<0.05);有机硒饲喂14 d后,连续收集青鳉鱼卵5次,发育至10 d后进行RT-PCR。Fig. 6 Se-Met induces an increase in bone-associated gene expression in the larva of the F1 generation medakaNote: M. Paternal exposure group, F. Maternal exposure group, F+M. Maternal and patental exposure group; the different letters indicate significant difference (P<0.05); male-only, female-only, and male and female of F0 parental medaka were fed with Se-Met for 14 d, and medaka embryos were continuously collected for 5 times, and RT-PCR was performed when the embryo developed to 10 d.
3 讨论(Discussion)
单独喂饲母本、父本,或同时饲喂母本、父本有机硒,均会造成F1代生存率的降低,后代畸形的发生率显著增加,尤其是造成了不同形态的软骨畸形和发育障碍;这种软骨发育障碍,与SOX9b和Collagen2a1 mRNA表达的升高有密切关联。F1代畸形率增高强度依次为母本、父本同时饲喂组,母本单独饲喂组,父本单独饲喂组。其中,父本单独暴露组出现畸形的种类较多。结果表明,不同性别饲喂过量有机硒,其后代的畸形种类和畸形率是不同的。过量饲喂有机硒对母本和父本都有生殖和发育毒性。
小型鱼幼鱼心囊水肿以及卵黄囊水肿是一种常见的毒性症状,出现在很多污染物质的暴露效应中。有机硒的暴露同样造成心囊、卵黄囊水肿[13,17,22]。笔者在3 d和6 d时,观察到严重的心囊水肿(图2(c)和(f)),在10 d时观察到卵黄囊水肿(图3(b))。同时观察到血液停滞图2(g)),这与之前的报道一致[18]。
F1代青鳉幼鱼出现高频率颅面畸形,以及下颌的凸起或者变形。尤其发生在母本、父本青鳉成鱼同时饲喂高浓度有机硒的暴露组中,其次是单独母本或者父本饲喂高浓度有机硒暴露组。类似的颅面畸形和下颌畸形在黑鳟中也观察到,虽然这种畸形不直接致命,但会影响口腔开合,也可能会影响呼吸[23]。这种特异性颅面畸形表型也提示有机硒饲喂对母本和父本骨骼基因表达产生一定影响[24]。
本研究结果表明,有机硒能够促进SOX9a、SOX9b和Collagen2a1基因的转录表达。骨骼发育中SOX9家族基因是成骨细胞/软骨细胞的关联基因,SOX9还可以结合并激活Collagen2基因的转录,其表达产物被认为是转基因小鼠中软骨细胞分化的早期标志物[25]。青鳉鱼有2种SOX9基因(SOX9a和SOX9b),在软骨组织中表达[26]。初步可以推测,由于软骨组织的产生增加,SOX9a和SOX9bmRNA的表达水平升高造成了下颌骨突出、脊索和尾部畸形弯曲。
有机硒经由小肠进入血液,再次进入肝脏和骨骼肌,但没有观察到有机硒在卵巢或睾丸中蓄积[27]。这也许是因为暴露时间短尚没有造成大量的有机硒累积。Thomas和Janz[28]报道了斑马鱼成熟鱼卵中的有机硒并没有集中在卵巢中的现象。有机硒也可直接经由青鳉鱼母本渗透到鱼卵中[12]。有关鱼卵中有机硒的浓度和分布,仍需进一步研究。组织切片分析结果表明,有机硒可能造成精原细胞质量降低和精子凋亡[29]。
综上所述,与青鳉鱼母本或父本单独暴露组相比,母本、父本同时暴露组会有更多个体出现畸形,并有更多的外观表型种类。父本单独饲喂有机硒组出现了非常多的特异表型,这说明,父本暴露也会有很大风险。有机硒的过量摄入对青鳉鱼F1代的毒性与软骨发育通路障碍相关。
