蜂毒肽基因原核表达载体的构建及重组蛋白生物活性作用的研究
2020-02-02王文佳田维毅梁建东何光志
王文佳,田维毅,蔡 琨,王 平,梁建东,何光志
贵州中医大学基础医学院,贵阳 550002
蜂毒是蜜蜂科昆虫中华蜜蜂(ApisceranaFabricius)等工蜂尾部螫刺毒腺和副腺分泌出的具有芳香气味的淡黄色透明毒液,属于祖国医学中传统动物药的一种[1]。临床广泛用于风湿性关节炎、腰痛、血栓及肿瘤等疾病治疗[2-5]。目前蜂毒的自然生产远不能满足用药需求,并且其常规采集方法是电击取毒,这种方式对人体呼吸道有强烈的刺激作用,也不利于生态环境。不断发展的生物工程技术为蜂毒的获得提供了一条新途径[6]。蜂毒是含有多种生物学活性的复杂混合物[7],主要含有蜂毒肽(melittin)、活性酶、生物胺和其它酸类物质等,在临床使用中可见严重过敏反应。蜂毒肽约占蜂毒干重的50%,具有较高的生物活性,有抗炎、镇痛、抗菌、抗病毒及抗肿瘤等作用[8],不是常规蜂毒过敏诊断分子[9],有望成为新的抗菌肽药物。其分子量小,基因序列短,易于合成和转染,适合作为目的基因,可利用基因工程技术获得。但蜂毒肽可溶解细胞膜,所以不易直接用细胞表达活性蜂毒肽。利用异源细胞进行蜂毒肽重组蛋白的表达,并从中选择高效表达系统,是基因工程生产蜂毒肽的关键技术之一。笔者团队通过人工合成蜂毒肽基因,构建蜂毒肽融合蛋白的表达载体,转入原核细胞中进行诱导表达,改进分离纯化技术,提取目的蛋白蜂毒肽,进行体外抑菌试验及抗肿瘤试验等生物活性检测。为蜂毒肽的基因工程生产提供实验基础。
1 主要材料与试剂
1.1 主要试剂
粉碎缓冲液(50 mM Tris,300 mM NaCl,0.1% Triton X-100,5%甘油,1 mM DTT,pH=8.0);结合缓冲液(50 mM Tris,300 mM NaCl,5%甘油,pH =8.0);清洗缓冲液(50 mM Tris,300 mM NaCl,5%甘油,20 /50 mM咪唑,pH=8.0);洗脱缓冲液(50 mM Tris,300 mM NaCl,5%甘油,500 mM咪唑,pH=8.0);四甲基偶氮唑盐(MTT)(美国Phamacia公司);磷酸盐缓冲液(PBS)(江苏瑞楚生物科技有限公司);DMEM培养基(美国HyClone公司);胎牛血清(FBS)(浙江天杭生物科技股份有限公司);0.02%EDTA /0.25%胰蛋白酶(北京迈晨科技有限公司);二甲基亚砜(DMSO)(北京索莱宝科技有限公司)。
1.2 试剂盒
SDS-PAGE试剂盒(上海生工生物工程股份有限公司);SK3071非干扰型蛋白浓度测定试剂盒(上海生工生物工程股份有限公司);RNA抽提试剂盒(批号:B012005018,北京百泰克生物技术有限公司);RT试剂盒(批号:lot#B050002018,北京百泰克生物技术有限公司);2×Taq PCR MasterMix(批号:Cat#KT201,北京百泰克生物技术有限公司);96孔培养板(美国Corning公司);T25细胞培养瓶(美国Corning公司)。
1.3 载体、菌种及细胞
pGEX6p-1载体,引物,由上海生工生物工程股份有限公司合成;金黄色葡萄球菌、铜绿假单胞菌、伤寒沙门菌及大肠埃希菌,由贵州中医药大学形态实验室教研室提供;人乳腺癌MCF-7细胞,购于中国典型培养物保藏中心。
1.4 主要实验设备
多功能电泳仪(型号:powerpac TM Basic,美国BIO-RAD公司);低速大容量离心机(型号:TD5A-WS,湖南湘立科学仪器有限公司);洁净工作台(型号:CJ-1D,天津市泰斯特仪器有限公司);梯度PCR仪(型号:T100 thermal cycle,美国BIO-RAD公司);高速离心机(型号:Thermo Scientific SORVALL LEGEND MICRO 21R,美国Thermo公司);凝胶成像仪(型号:Bio-RAD chemiDocTM XRS+,美国Thermo公司);CO2培养箱(型号:USA3131,美国Thermo公司);自动酶标仪(型号:1510 型,美国Thermo公司);倒置相差显微镜(型号:DSZ2000X型,日本Olympus公司);全自动高压灭菌锅(型号:SX-700,日本TOMY公司)。
2 方法
2.1 表达菌株的构建和蛋白诱导条件的优化
根据Genebank中公布的蜂毒肽基因(melittin)序列(NM001011607),委托上海生工生物工程股份有限公司合成基因片段,插入pGEX6p-1载体。取1 μL重组的pGEX6p-1质粒转化BL21(DE3),42 ℃热击90 s后冰上静置5 min后,加入700 μL培养基,37 ℃培养45 min,涂平板(100 μg/mL氨苄青霉素),37 ℃培养过夜。次日,挑取单个菌落(表达BL21(DE3))转入4 mL LB培养基,加入100 μg/mL氨苄青霉素,37 ℃,220 rpm培养过夜。培养所得菌液,按1∶100比例分别接种于8支试管(4 mL LB培养基,内含100 μg/mL氨苄青霉素),37 ℃,220 rpm培养。当OD值达到0.6左右时,添加0.2 mM的IPTG,设定的表达温度时间梯度分别为16 ℃过夜、25 ℃过夜、30 ℃过夜、37 ℃ 5 h后终止表达,阴性对照不加诱导剂IPTG,4 °C,5 000 rpm,离心5 min,用PBS缓冲液收集菌体。所得菌体进行SDS-PAGE检测,选择诱导蛋白表达的最佳条件进行下一步实验。
2.2 pGEX6p-melittin表达纯化
培养所得菌液,按1∶100分别转种于试管(4 mL LB培养基,100 μg/mL氨苄青霉素),37 ℃,220 rpm培养。当OD值达到0.6左右时,添加0.2 mM的IPTG,25 ℃,220 rpm,培养过夜,4 °C 5 000 rpm离心5 min收集菌体。用Buffer(50 mM Tris,300 mM NaCl,0.1%Triton X-100,5 mM DTT,10%甘油,pH8.0)破碎溶解,超声碎菌(冰浴,功率500 W,25 min,每超声2 s,暂停6 s为一个循环)。碎菌后,4 ℃,12 000 rpm,离心20 min,取上清液,亲和层析。取GST填料5 mL,用Binding Buffer 10倍柱床体积,流速5 mL/min,清洗平衡柱子。样品(上清液)上柱,流速2 mL/min,收集穿透液。Binding Buffer 10倍柱床体积,流速10 mL/min,清洗柱子。Elution Buffer洗脱,流速2 mL/min,收集洗脱液。进行SDS-PAGE电泳分析,将10 mM还原性谷胱甘肽洗脱组分别透析到1×PBS,2 mM DTT,pH7.4透析液中,过夜。冷冻重组蛋白液获得干燥粉5 mg备用。
2.3 SDS-PAGE电泳、蛋白浓度分析
所获得重组蛋白进行SDS-PAGE电泳。按照SDS-PAGE凝胶试剂盒说明书分别制备12%的分离胶和5%的浓缩胶,待胶体凝固后取下胶板安置于垂直电泳槽中,电泳液注满电泳槽,取重组蛋白10 μL加入样品孔,以蛋白Marker为参照标准。加90 V电压至溴酚蓝指示剂进入分离胶后,电压升高至160 V,待指示剂近胶体底部时取出凝胶进行灰度分析,检测重组蜂毒肽的纯度,使用SK3071非干扰型蛋白浓度测定试剂盒检测重组蜂毒肽的浓度。
2.4 免疫印迹
取方法2.2纯化蛋白经SDS-PAGE后,转印硝酸纤维素薄膜进行转膜,采用鼠源抗His-tag抗体(1∶3 000)一抗与兔抗鼠IgG抗体(1∶3 000)二抗(参照说明书使用剂量)进行免疫印迹分析。使用AEC底物显色试剂(按照试剂盒说明书制备)完全浸润转印膜,常温,10 min,去离子水冲,洗终止反应,观察记录结果。
2.5 药敏试验
2.5.1 表达蛋白液和菌悬液的制备
将纯化重组蛋白液的冷冻干燥粉加无菌蒸馏水稀释至50 mL(重组蛋白0.5 g/mL,pH7.2)备用。将6 mm圆形滤纸片浸泡于重组蛋白液中,阴性对照浸泡无菌蒸馏水,2 h后40 ℃烘干各待试纸片备用。
黄色葡萄球菌、铜绿假单胞菌、伤寒沙门菌及大肠埃希菌分别转种于普通液体培养基中6 h后,分别转入普通液体培养基18 h复苏增菌后,再分别接种于普通营养琼脂平板,37 ℃,18 h。分别挑取平板所培养菌落,各自放入3 mL生理盐水(振荡混匀),以0.5号麦氏比浊管为标准,制备菌液。
2.5.2 抑菌实验
用无菌棉签分别蘸取以上4种菌液均匀涂布于MH药敏琼脂平板。将待试纸片贴于平板上,每个平板均匀放置重组蛋白纸片3片,无菌蒸馏水纸片1片作为阴性对照,37 °C,培养20 h,测量纸片周围抑菌环直径。上述作3个平行样,取3次平均值为最终抑菌直径。
2.6 抗肿瘤实验
培养4代人乳腺癌MCF-7细胞进行肿瘤抑制实验,设阴性对照组、不同浓度重组蛋白组、空白组。称取1 mg重组蛋白用高糖型细胞培养液(DMEM-H),不加胎牛血清(FBS),稀释得到50、25、12.5、6.25、3.125 mg/L共5个浓度备用。取对数生长期的MCF-7细胞,用磷酸盐缓冲液(PBS)进行冲洗,加入0.02%细胞消化液(EDTA /0.25%胰蛋白酶)1 mL,37 ℃,3 min,镜下观察约80% MCF-7细胞变圆时,移液器取DMEM-H (含10% FBS)培养液3 mL反复吹打,收集后离心,再用DMEM-H(含10%FBS)培养液调整为4×104个/mL单细胞悬液。取96 孔板各孔加入100 μL,培养12 h后细胞贴壁长满底部,加入不同浓度重组蛋白各100 μL,对照组加DMEM-H培养液稀释(不含FBS)100 μL,空白组无细胞,加DMEM -H培养液,含10% FBS和不含FBS各100 μL,每组设3个平行孔,37 ℃,5%CO2孵化箱培养。分别培养12、24、36、48、72 h后,取出,每孔加入5 mg/mL四甲基偶氮唑盐(MTT)(PBS配制浓度)20 μL,继续培养4 h,弃培养液,每孔加二甲基亚砜(DMSO)150 μL,上低速摇床10 min,静置20 min,酶标仪490 nm测各孔吸光度OD值,测定重组蛋白的相对活力。
2.7 统计学处理
3 结果
3.1 重组蛋白的表达及定位
重组蛋白最佳表达条件为:25 ℃温度,IPTG浓度为0.2 mM。通过SDS-PAGE电泳对重组蛋白进行纯度分析,结果在25~35 kDa之间出现明显的条带,表明加入异丙基硫代半乳糖苷(IPTG)后有目的蛋白表达,与预期基因序列表达蛋白分子量与31.9 kDa基本一致(见图1)。
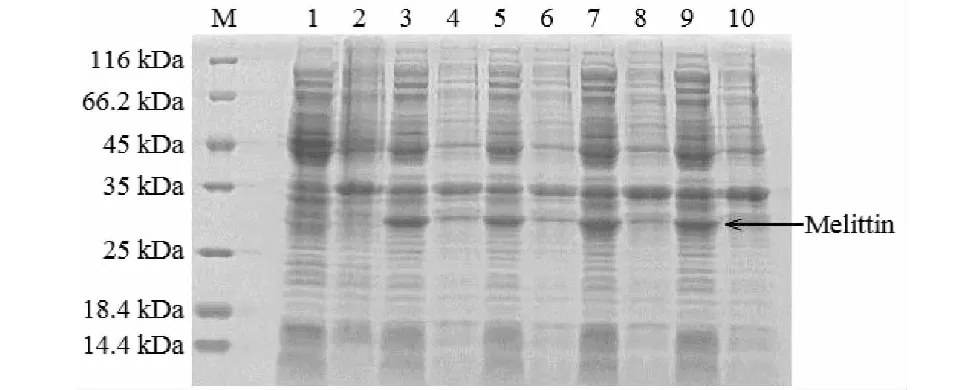
图1 表达蛋白SDS-PAGE及表达定位Fig.1 SDS-PAGE and location of expressed protein注:IPTG,0.2 mM;M:Protein Marker;1.PGEX6P-1空载体诱导上清;2.PGEX6P-1空载体诱导上清沉淀;3.16 ℃过夜诱导沉淀;4.16 ℃过夜诱导上清;5.25 ℃过夜诱导沉淀;6.25 ℃过夜诱导上清;7.30 ℃过夜诱导沉淀;8.30 ℃过夜诱导上清;9.37 ℃过夜诱导5 h沉淀;10.37 ℃过夜诱导5 h上清。Note:IPTG,0.2 mM;M:Protein Marker;1.PGEX6P-1supernatant of empty body induction;2.PGEX6P-1 precipitation of supernatant induced by empty body;3.16 ℃overnight induced precipitation;4.16 ℃ overnight induction supernatant;5.25 ℃ overnight induced precipitation;6.25 ℃ overnight induction supernatant;7.30 ℃overnight induced precipitation;8.30 ℃overnight induced precipitation;9.37 ℃precipitation was induced overnight for 5 h;10.37 ℃supernatant was induced overnight for 5 h.
3.2 纯化蛋白检测、灰度分析及免疫印迹
使用GST亲和层析对重组蛋白进行收集,通过SDS-PAGE电泳在相应位置(31.9 kDa)出现明显条带,表明重组蛋白成功得到了纯化(见图2)。将重组蛋白的SDS-PAGE胶,通过ChemiDocTM XRS+system.,进行灰度分析,其纯度为90.4%(见图3)。通过SK3071非干扰型蛋白浓度测定试剂盒测定重组蛋白浓度,测定蛋白时的体积为30 μL,BSA浓度为2 mg/mL,计算得蛋白浓度为0.6 mg/mL(见图4)。
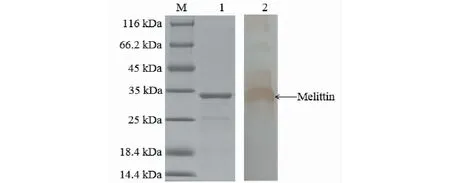
图2 重组蛋白纯化免疫印迹分析Fig.2 The recombinant protein purification for Western blot analysis注:1.目的蛋白;2.蜂毒肽印迹。Note:1.Target protein; 2.Melittin imprinting.
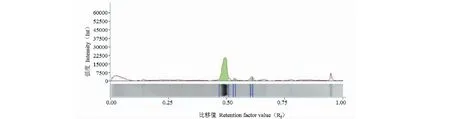
图3 重组蛋白灰度分析图Fig.3 Gray analysis chart of recombinant protein
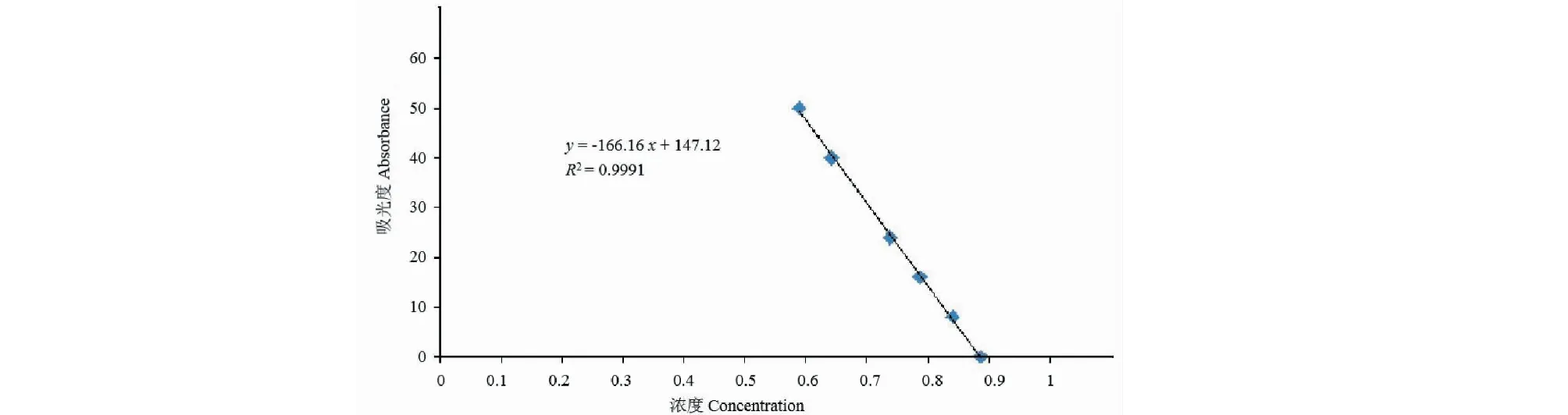
图4 重组蛋白定量分析图Fig.4 Quantitative analysis chart of recombinant protein
3.3 抑菌试验
重组蛋白对金黄色葡萄球菌有高度敏感性(15.2 mm),对大肠埃希菌有中度敏感性(12.9 mm),对铜绿假单胞菌(6.7 mm)和伤寒沙门菌(8.4 mm)有低度敏感性。结果见表1。

表1 重组蛋白对各试验菌的抑制作用Table 1 Inhibitory effect of recombinant protein on experimental bacteria
3.4 抗肿瘤作用
5个浓度重组蛋白50、25、12.5、6.25、3.125 mg/L作用于MCF-7细胞,在12、24、36、48、72 h对MCF-7细胞生长均有稳定抑制作用,与对照组相比有显著差异(P<0.05)。结果显示重组蛋白的浓度越高,作用时间越长,其抑制肿瘤的作用越强。结果见表2、图5。
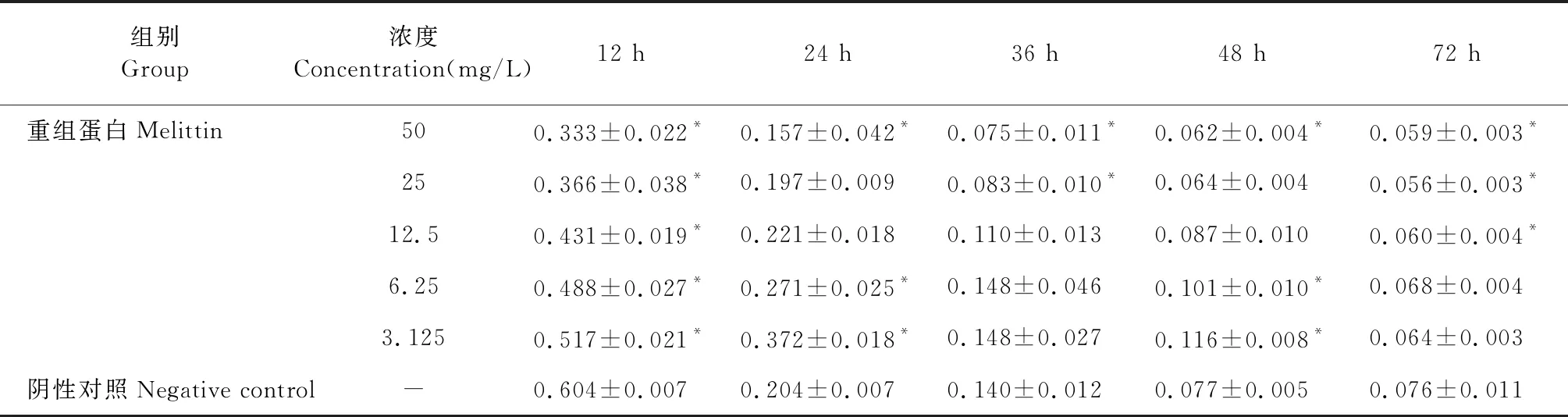
表2 重组蛋白对MCF-7细胞的生长影响(相对活力)Table 2 Effect of recombinant protein on the growth of MCF-7 cells(relative vitality)
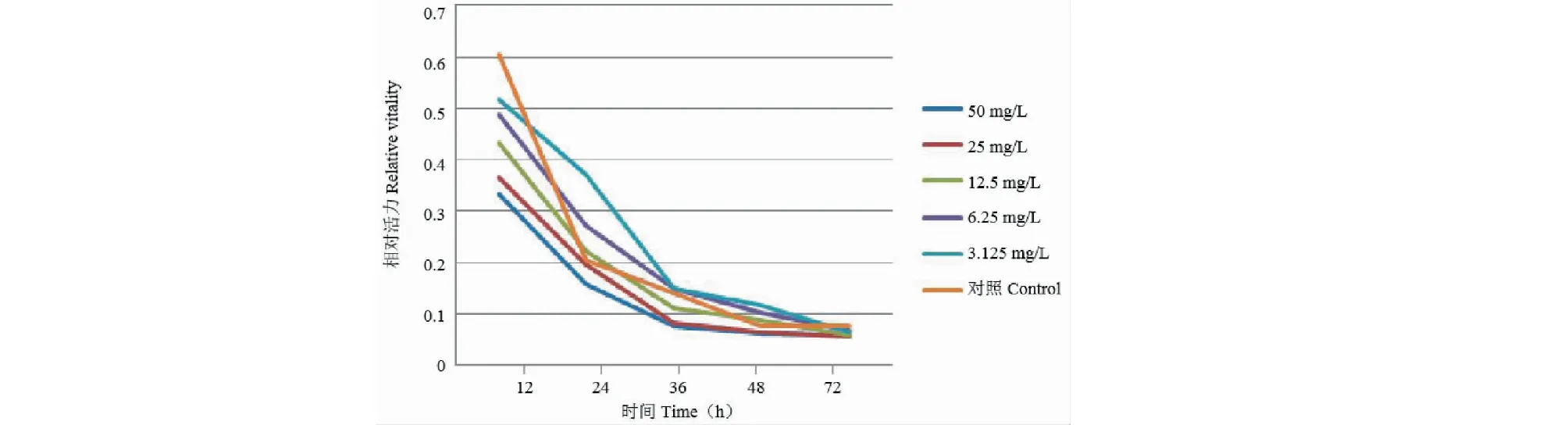
图5 重组蛋白对MCF-7细胞的生长影响曲线图Fig.5 Effect of recombinant protein on growth of MCF-7 cells
4 讨论
蜂毒肽是蜂毒主要生物活性成分,也是一种抗菌肽。抗菌肽(antimicrobial peptides)广义上是指生物防御系统中产生的,广泛存在于微生物、动物及植物体内[10],具有抵御外界微生物侵害,清除体内突变细胞的一类带正电荷的两亲性小分子抗菌肽,是生物先天免疫的重要组成成分。研究发现抗菌肽具有广谱抗菌活性,多数抗菌肽不仅能杀死细菌,而且对真菌、原生动物、病毒以及肿瘤细胞具有细胞毒性[11,12]。具有高效性、抗原性弱、稳定性好等特性。因此,抗菌肽是新一代抗生素的理想替代者,具有极好的市场开发前景[13,14]。目前获取蜂毒肽的方法主要有化学合成、从粗蜂毒中分离纯化和生物工程法3种[15]。其中化学合成获得蜂毒肽纯品的成本太高,不适合蜂毒肽的批量生产。从粗蜂毒中分离纯化蜂毒肽纯品是目前主要获得途径,运用色谱原理进行分离纯化,随着色谱技术的提升以及与其他提取工艺的联合,操作成本降低,产量和纯度有所提高,但原材料主要是通过电击蜜蜂获取,这种方式对蜂源有要求,且不利于生态环境。随着生物工程技术的发展,为蜂毒肽的获得提供了新途径。利用基因工程菌表达目的蛋白,然后收集纯化表达蛋白,从而得到蜂毒肽纯品。
蜂毒肽由26个氨基酸残基组成,中间区域是疏水性氨基酸残基,还含有脯氨酸残基和精氨酸残基,使其成为一个强碱性肽,分子量为2.84 kDa,基因序列为NH2-Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln-COOH。其基因序列短,易于合成和转染,适合作为目的基因。但蜂毒肽是两亲性分子,其中亲水氨基酸残基的分布不均匀且本身分子量小,可与带负电荷的细胞在膜表面结合,形成孔隙破坏生物膜引起细胞内容物渗漏,并随着渗透性增强,最终导致细胞裂解[16]。故直接在感受态细胞中表达蜂毒肽对其有毒性,统计发现在宿主细胞中单独表达的报告并不多且表达量不高[17]。解决此难题是基因工程生产蜂毒肽的关键技术之一。从异源表达系统中获得有活性的蜂毒肽,以融合蛋白的形式表达是解决矛盾的方法之一。融合表达可降低蜂毒肽对宿主细胞的毒性,增加产物的稳定性,切除其承载部分就能得到目的蛋白,也是抗菌肽常用的表达策略。研究采用人工合成melittin基因,并构建pGEX6p-1-melittin载体,转入BL21(DE3)中进行诱导表达,采用SDS-PAGE电泳纯化重组蛋白和灰度分析测定蛋白浓度,结果证明基因工程方法可获得稳定的蜂毒肽。进一步对所获得重组蛋白进行抑菌实验及抗肿瘤实验等生物活性检测,同时证明重组的蜂毒肽仍保留原有的生物活性。
科学利用基因工程技术生产蜂毒肽,根据其电荷特性、结构特点构建新型表达载体,实现蜂毒肽融合蛋白在单细胞生物中的稳定表达,即可以规避蜂毒中其它成分如磷酸脂酶A、透明质酸酶所引起的过敏反应[18],又可以突出蜂毒的抗炎、抗菌、抗病毒、抗辐射及抗肿瘤等多种药理学作用[19]。本实验为基因工程生产蜂毒肽提供实验理论依据。而选择蜂毒肽高效表达系统,改进分离纯化技术,可为蜂毒肽的基因工程批量生产朝着低成本、高表达、更方便的方向发展,同时也为毒性药物生产提供一种可行性。
