德拉马尼治疗耐多药结核病的研究进展
2020-01-17张珊珊陈玲
张珊珊,陈玲
最新全球结核病报告显示,2017 年全球范围内约有1 000 万例新发结核病患者,其中2/3 集中于包括印度(占27%)、中国(占9%)、印尼(占8%)等在内的8 个国家,我国新发结核病患者数量居世界第二位;此外,新发结核病患者中约55.8 万人为耐利福平结核病(rifampicin resistancetuberculosis,RR-TB),而在RR-TB 患者中约82%为耐多药 结 核 病(multi-drug resistant tuberculosis,MDR-TB),我国新发RR-TB/MDR-TB 患者数量居世界第二位,约占全球新发RR-TB/MDR-TB 患者总数的13%[1]。由于MDR-TB 治愈率仅为55%,总体治疗转归情况不容乐观[1],因此MDR-TB仍是目前全球公共卫生危机和卫生安全威胁之一,临床迫切需要耐受性良好、疗程短且安全的新型抗结核药物。
德拉马尼(delamanid)和贝达喹啉(bedaquiline)是过去50 年成功开发的两种新型抗结核药物[2],其中德拉马尼由于良好的临床前特征而被选择进入临床试验以评估其药物动力学、安全性和有效性。2014 年4 月,欧洲药品局(EMA)批准德拉马尼用于治疗成人MDR-TB。本文主要综述了德拉马尼的作用机制及抗菌活性、临床前研究及临床试验、毒副作用及药物-药物相互作用、耐药机制等,以提高临床对德拉马尼的认识并为合理应用该药提供参考。
1 作用机制及抗菌活性
德拉马尼是一种硝基咪唑类衍生物,又称OPC-67683,其主要通过抑制结核分枝杆菌细胞壁成分甲氧基分枝菌酸及酮基分枝菌酸的合成而发挥杀菌作用,对处于复制、休眠期的结核分枝杆菌及胞内结核分枝杆菌均具有强效杀灭作用。由于革兰阳性菌、革兰阴性菌及哺乳动物细胞并不存在分枝菌酸,分枝菌酸仅存在于分枝杆菌中,因此德拉马尼对革兰阳性、革兰阴性杆菌没有杀菌/抑菌作用[3],但有利于减少结核分枝杆菌耐药性。
动物实验结果显示,与其他抗结核药物相比,德拉马尼口服生物利用度较高,约为50%[4]。德拉马尼t1/2为30~38 h 并可直接通过血液去除,而其代谢产物t1/2为121~322 h 并主要通过粪便排泄,尿液清除率较低[5]。在新陈代谢方面,德拉马尼的独特之处在于其主要通过血浆白蛋白及由细胞色素P450(CYP450)参与的多种代谢途径而非通过肝脏代谢,且其代谢产物无抗结核分枝杆菌作用,因此德拉马尼肝毒性较小[2]。
研究表明,口服德拉马尼后4~8 h 血药浓度达到峰值,且短时间德拉马尼暴露显示出强大的体外杀伤能力并对结核分枝杆菌具有强抑制作用,因此这可能是德拉马尼间歇治疗的优势之一[5];通过给予小鼠C14标记的德拉马尼发现,德拉马尼可广泛分布在包括中枢神经系统、眼、骨、胎盘等在内的多种组织且组织中德拉马尼浓度与血浆德拉马尼浓度相似或更高,提示德拉马尼能透过脑、视网膜及胎盘血液屏障,对肺外结核具有潜在的治疗价值[6]。
2006 年,一项针对67 例药物敏感或耐药结核病患者结核分枝杆菌株的研究首次指出德拉马尼最低抑菌浓度(minimum inhibitory concentration,MIC)为0.006~0.024 mg/L[3];2011—2014 年有研究人员对来自经德拉马尼初次治疗的结核病患者的10 种野生型结核分枝杆菌菌株进行了测试,结果显示德拉马尼对野生型结核分枝杆菌菌株的MIC 为0.016 mg/L,对耐多药及广泛耐药结核分枝杆菌菌株的MIC 为0.005~0.040 mg/L,对敏感表型结核分枝杆菌菌株的MIC 为0.013 mg/L,但对德拉马尼获得性耐药、广泛耐药结核分枝杆菌菌株的MIC 则>0.320 mg/L,表明德拉马尼对敏感和耐药结核分枝杆菌菌株的不同亚群具有不同的抗菌活性[7]。
2 临床前研究及临床试验
临床前研究表明,德拉马尼抗菌谱较窄,主要包括结核分枝杆菌和非结核分枝杆菌,但其具有强有力的抗结核分枝杆菌作用;单独使用德拉马尼对结核病小鼠及豚鼠复制、非复制期或细胞内结核分枝杆菌均具有杀灭作用,而药物敏感或MDR-TB 动物模型联用德拉马尼则能加速结核分枝杆菌的死亡并提高痰培养结果转阴率,因此德拉马尼进入临床试验阶段[2]。
德拉马尼相关临床试验始于2003 年,目前已有超过1 200 例受试者参与,包括Ⅰ期临床试验(12 个试验,2003—2006 年)、Ⅱ期临床试验(6 个试验,2007—2012 年)、一项在MDR-TB 患者中进行的Ⅲ期临床试验(2013—2017 年)及2 项正在MDR-TB 患儿中进行的Ⅲ期临床试验[2]。
德拉马尼Ⅰ期临床试验未出现严重不良事件并确定了Ⅱ期临床试验德拉马尼剂量,即100 mg/次、2 次/d 和200 mg/次、2 次/d[2]。德拉马尼Ⅱ期临床试验主要关注痰培养结果转阴率,结果发现MDR-TB 患者经德拉马尼(100~200 mg/次,2次/d)治疗2 个月后痰培养结果转阴率升高约50%、治愈率为45.4%(接受安慰剂者治愈率为29.6%),治疗6 个月后治愈率为74.5%(接受安慰剂者治愈率为55.0%)、病死率为2.9%(接受安慰剂者病死率为12.0%);广泛耐药结核病患者经德拉马尼治疗2、6 个月治愈率分别为44.4%、64.7%[8-11]。此外,德拉马尼对标准化和临床分离的结核分枝杆菌菌株显示出强有力的体外抗菌活性,且不会对利福平、异烟肼、乙胺丁醇及链霉素产生拮抗作用[12]。德拉马尼期Ⅲ期临床试验采用双盲、安慰剂对照,研究对象来自伊斯坦尼亚、拉脱维亚、立陶宛、摩尔达维亚、菲律宾、秘鲁、南非共7 个国家,旨在评估德拉马尼作为新增药物的为期6 个月的优化背景治疗方案对成人MDR-TB 患者的安全性和有效性,但由于Ⅲ期临床试验是在优化背景治疗方案基础上加用德拉马尼而非新的药物组合、缺少德拉马尼与其他新型抗结核药物的比较、含德拉马尼和其他新型抗结核药物联合方案的疗效研究,因此世界卫生组织(World Health Organization,WHO)发表的立场声明表示,根据WHO 推荐不能组成有效方案时可将德拉马尼加入MDRTB 患者的长期治疗方案[2]
3 毒副作用及药物-药物相互作用
德拉马尼常见毒副作用为恶心、呕吐、眩晕,三者发生率约分别为38.3%、33.0%、30.2%。GLER 等[8]研究表明,采用德拉马尼200 mg/次、2 次/d 治疗的MDR-TB 患者Q-T间期延长发生率(13.1%)高于采用德拉马尼100 mg/次、2 次/d 治疗者及接受安慰剂者(3.8%)。目前研究认为,德拉马尼导致Q-T 间期延长的主要原因与其血浆代谢产物DM-6705 有关,而由于DM-6705 的产生由白蛋白调节,因此伴有低蛋白血症(血清白蛋白水平<28 g/L)者禁用德拉马尼[5]。迄今为止,尚无有关德拉马尼导致肝损伤等的临床报道,但在MDR-TB 小鼠、兔子、大鼠模型中发现,德拉马尼可通过抑制维生素K1的产生而降低凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ水平并延长凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT);此外,MDR-TB 大鼠乳汁德拉马尼峰值浓度是血液德拉马尼峰值浓度的4 倍,且其代谢产物会导致大鼠胎儿畸形[5]。
4 耐药机制
德拉马尼是一种前体药物,需Ddn 基因(Rv3547)参与生成依赖去氮杂黄素辅助因子F420 的硝基还原酶,该反应将F420H2 简化为F420、F420 依赖的6-磷酸葡萄糖脱氢酶(fgd1)同时将F420 还原为F420H2 并进入下一个还原周期,而fbiA基因(Rv3261)、fbiB 基因(Rv3262)及fbiC 基因(Rv1173)均参与合成F420;生物激活的产物即德拉马尼的脱氮形式并没有抗结核分枝杆菌活性,因此只能推测德拉马尼在生物活化过程中产生的一些不明活性中间体对结核分枝杆菌具有杀灭作用[13]。
德拉马尼的激活机制涉及Ddn 基因、fgd1 基因(Rv0407)、fbiA 基因、fbiB 基因及fbiC 基因,因此上述基因任一基因突变均会引起结核分枝杆菌对德拉马尼耐药。德拉马尼天然耐药率为6.44×10-6~3.95×10-5,药敏试验结果显示,744 例单用德拉马尼治疗的MDR-TB 患者的临床分离结核分枝杆菌菌株天然耐药率仅为1.3%[2];通过对临床分离的结核分枝杆菌菌株突变进行研究共发现4 种基因突变,包括Ddn 基因、fgd1 基因、fbiA 基因及fbiC 基因[4]。目前发现的10 株对德拉马尼耐药的结核分枝杆菌菌株中5 株为Ddn 基因非同义突变[13-14],2 株为fbiC 基因氨基酸替代[15],2 株未发现可能导致德拉马尼耐药的上述5 个基因突变[15],1 株为fbiA 基因无义突变[14],详见表1。
HOFFMANN 等[16]通过对1 例38 岁获得性耐药藏族难民进行研究发现,其在使用德拉马尼之前已对氯法齐明、贝达奎林、环丝氨酸、卷曲霉素、对氨基水杨酸、乙胺丁醇等出现耐药,而分别于使用德拉马尼治疗前、使用德拉马尼治疗失败后分离的两个结核分枝杆菌菌株最可能为fbiA 基因D49Y 突变。
5 小结与展望
德拉马尼代谢方式独特,有利于减少肝毒性,与其他二线抗结核药物相比具有更好的耐受性及更高的安全性,是一种很有应用前景的新型抗结核药物。临床研究证实,德拉马尼无论是在体内还是在体外均具有较高的抗菌活性,可有效缩短MDR-TB 患者疗程[3],有可能在MDR-TB 的治疗方面发挥重要作用。目前,旨在评估德拉马尼在儿童MDR-TB 中的药代动力学、安全性、有效性的Ⅰ期临床试验(NCT01856634)正在进行中[18-19];关于德拉马尼和贝达喹啉组合使用的另两项试验结果预计将在2020 年或2021 年发布并将提供更快速、更有力的第四阶段安全数据;相关国际合作研究的重点则是德拉马尼最佳使用方案,包括口服治疗方案、更短疗程的治疗方案及结核分枝杆菌高危接触者毒副作用的预防等[20-22]。
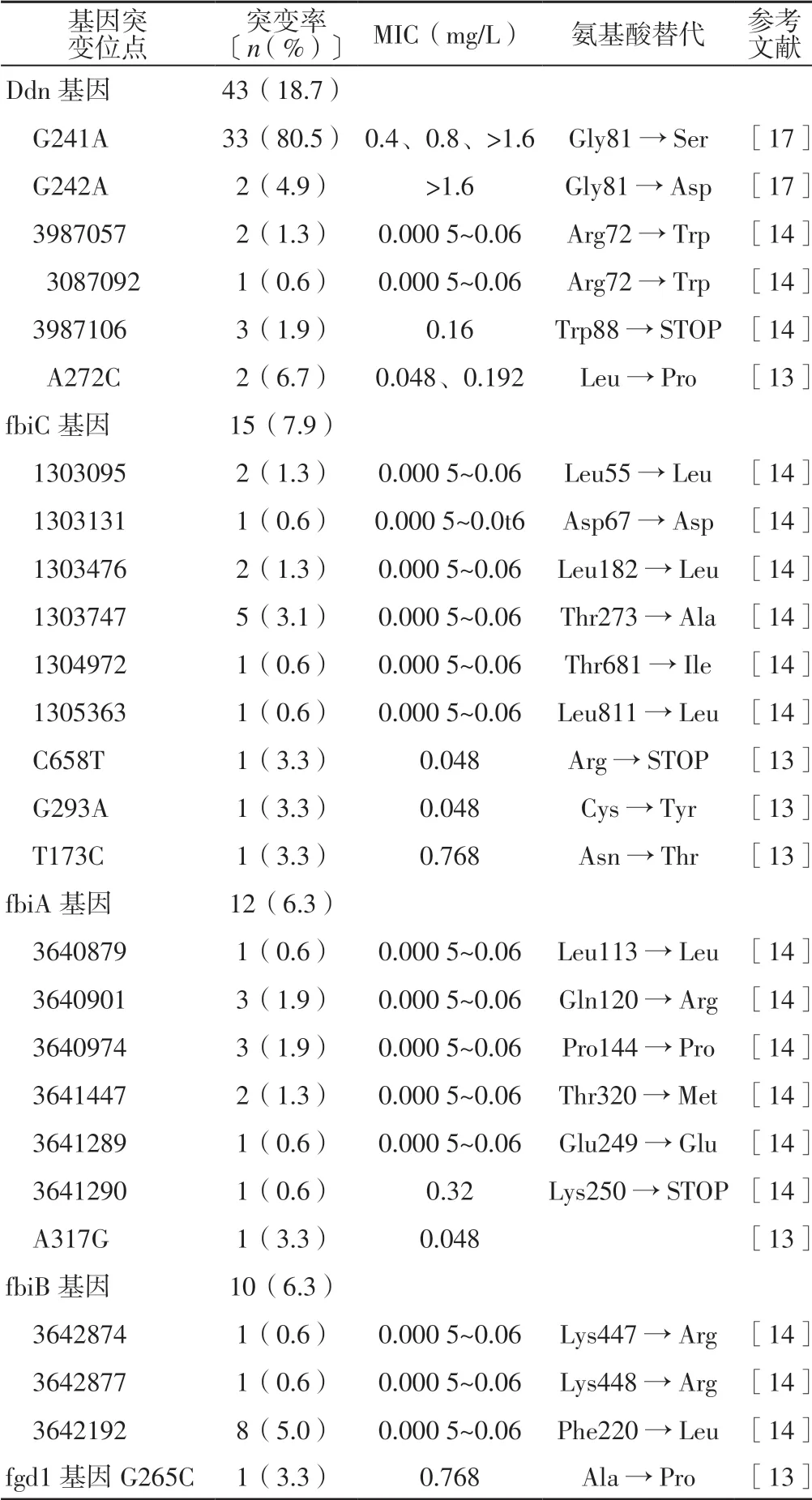
表1 德拉马尼耐药基因突变位点及MICTable 1 Drug resistance related gene mutation sites and MIC of delamanid
