右丙亚胺预防乳腺癌患者蒽环类药物化疗所致心脏毒性有效性的Meta 分析
2020-01-17郑丽顾玲琪袁年平沈倩影刘锐刘露露张琳
郑丽,顾玲琪,袁年平,沈倩影,刘锐,刘露露,张琳
《2015 年中国癌症统计数据》[1]显示,乳腺癌是我国女性发病率最高的恶性肿瘤,并位居女性所有癌症死亡率第五名。蒽环类药物是目前临床上治疗乳腺癌的最常用药物[2],其不仅在乳腺癌术后辅助化疗中占据重要地位,还是乳腺癌新辅助化疗的一级推荐药物[3-4],但蒽环类药物可引起骨髓抑制和心脏毒性等毒副作用,其中以心脏毒性最为严重,因此使用蒽环类药物治疗期间必须至少每3 个月评估1 次左心室射血分数(LVEF)[5]。
VAN DALEN 等[6]研究表明,右丙亚胺(dexrazoxane,DZR)可有效预防蒽环类药物所致心脏毒性,但该研究未对恶性肿瘤患者进行分类且未纳入我国相关临床试验。目前,有关DZR 预防乳腺癌患者蒽环类药物化疗所致心脏毒性有效性及安全性的系统评价较少见。本研究采用Meta 分析方法,旨在评价DZR 预防乳腺癌患者蒽环类药物化疗所致心脏毒性有效性,以期为临床医师、药师选用DZR 预防乳腺癌患者蒽环类药物化疗所致心脏毒性提供循证医学证据。
1 资料与方法
1.1 检索策略 计算机检索中国知网、万方数据知识服务平台、中国生物医学文献数据库(CBM)、PubMed、Cochrane Central Register of Controlled Trials 及EMBase 等数据库,检索时间从建库至2019 年5 月,检索方式为主题词与自由词结合。中文检索词:“右丙亚胺”“右雷佐生”“蒽环类”“乳腺癌”;英文检索词:“dexrazoxane”“ICRF-187”“ADR-529”“anthracyclines”“breast cancer”“breast carcinoma”。
1.2 文献纳入与排除标准
1.2.1 文献纳入标准 (1)研究类型:临床随机对照试验(RCTs),语种限中英文。(2)研究对象:首次确诊为乳腺癌且无其他恶性肿瘤病史患者。(3)干预措施:对照组患者采用以蒽环类药物为基础的化疗方案,干预组患者在对照组治疗基础上预防性使用DZR。(4)结局指标:主要结局指标:临床或亚临床心脏毒性发生率,化疗后心肌肌钙蛋白T(cardiac troponin T,cTnT)、脑 钠 肽(brain natriuretic peptide,BNP)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)水平及左心室射血分数(left ventricular ejection fraction,LVEF);次要结局指标:无进展生存期(progressionfree survival,PFS)、总生存期(overall survival,OS)、完全应答率(complete response rate,CR)及部分应答率(partial response rate,PR)。
1.2.2 文献排除标准 (1)对照组患者使用其他预防心脏毒性的药物;(2)动物实验;(3)重复文献。
1.3 文献筛选与资料提取 由两名评价员根据文献纳入与排除标准独立检索数据库并筛选文献,如遇分歧则通过讨论协商解决;需要注意的是,同一课题组不同阶段的研究报告,如果观察指标一致则纳入最新研究报告。由两名评价员独立提取资料并交叉核对,内容包括第一作者、发表年份、国家、疾病信息、例数、干预措施及结局指标。
1.4 质量评价 按照Cochrane 系统评价员手册5.1.0 版偏倚风险评估工具评价纳入文献的方法学质量[7]。
1.5 统计学方法 采用RevMan 5.3 软件进行Meta 分析,计数资料采用RR 或HR 及其95%CI 表示,计量资料采用MD及其95%CI 表示。各文献间统计学异质性分析采用χ2检验,检验水准α=0.10,并采用I2定量分析统计学异质性,P ≤0.10、I2≥50%提示各文献间有统计学异质性,采用随机效应模型进行Meta 分析;P>0.10、I2<50%提示各文献间无统计学异质性,采用随机效应模型进行Meta 分析。采用Harbord 检验分析发表偏倚。以P<0.05 为差异有统计学意义。
2 结果
2.1 检索结果 初步检出317 篇文献,根据文献纳入与排除标准最终纳入10 篇文献[8-17],其中6 篇[12-17]来自中国、2篇[8,10]来自美国(文献[10]包括两项RCT)、1 篇[9]来自意大利、1 篇[11]来自捷克;共包含1 672 例患者,其中干预组833 例、对照组839 例。文献筛选流程见图1,纳入文献的基本特征见表1。
2.2 纳入文献的质量评价 10 篇文献中6 篇[8-11,14,16]报告了随机方法的产生,4 篇[12-13,15,17]仅提及随机但未描述随机方法;3 篇文献[8-10]正确描述了分配隐藏;1 篇文献[11]为开放标签,1 篇文献[10]实施双盲,两篇文献[8-9]实施单盲,6篇文献[12-17]盲法不清楚;8篇文献[8-14,16]完整报告了研究结果;除1 篇文献[10]无其他偏倚外,其他文献均不清楚其他偏倚来源,详见图2。
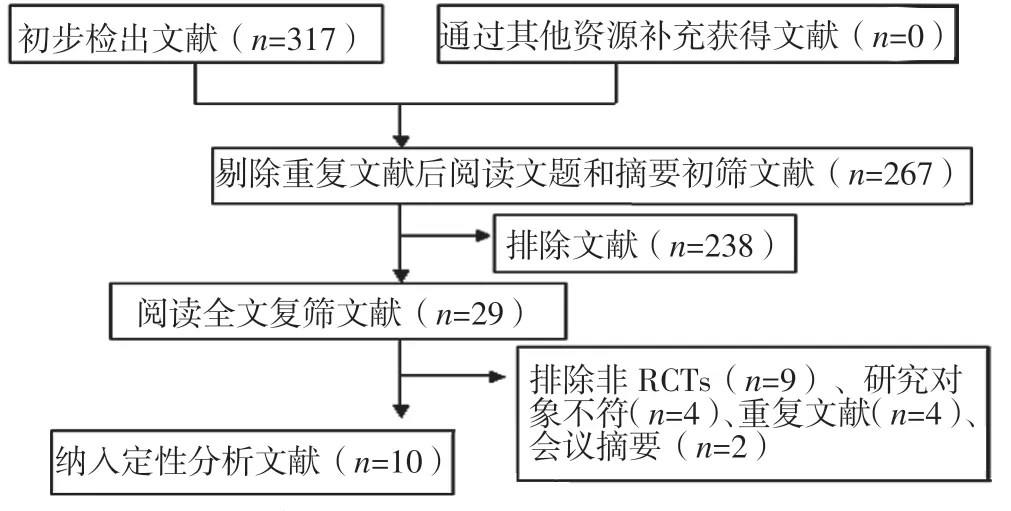
图1 文献筛选流程Figure 1 Literature screening process
2.3 Meta 分析结果
2.3.1 临床和亚临床心脏毒性发生率 7 篇文献[8-13,15]报道了临床心脏毒性发生率,各文献间无统计学异质性(I2=0,P=0.58),采用固定效应模型进行Meta 分析;结果显示,干预组患者临床心脏毒性发生率低于对照组,差异有统计学意义〔RR=0.17,95%CI(0.09,0.32),P<0.000 01,见图3〕。6 篇文献[8-12,15]报道了亚临床心脏毒性发生率,各文献间无统计学异质性(I2=30%,P=0.20),采用固定效应模型进行Meta 分析;结果显示,干预组患者亚临床心脏毒性发生率低于对照组,差异有统计学意义〔RR=0.33,95%CI(0.26,0.43),P<0.000 01,见图3〕。
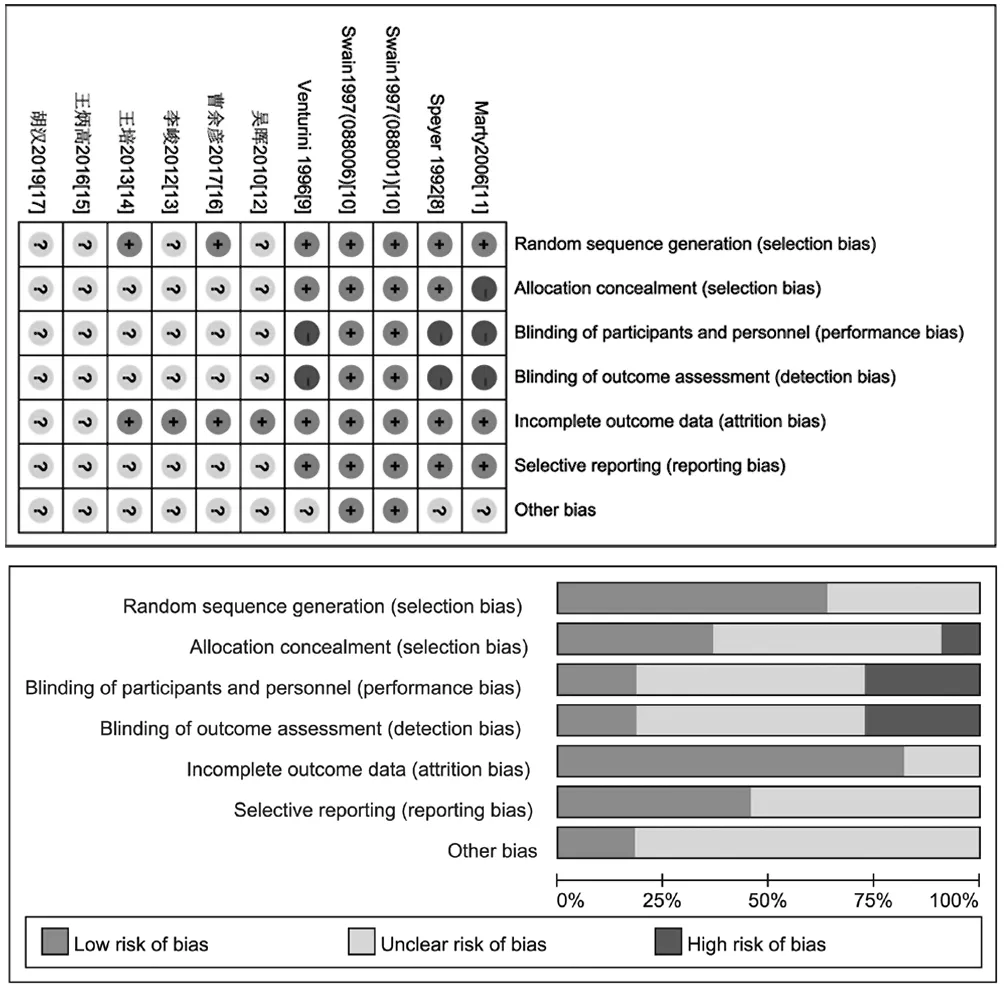
图2 Cochrane 偏倚风险评估结果Figure 2 Cochrane assessment result for the risk of bias
2.3.2 化疗后cTnT、BNP、CK-MB 水平 3 篇文献[13-14,16]报道了化疗后cTnT 水平,各文献间有统计学异质性(I2=91%,P<0.000 1),采用随机效应模型进行Meta 分析;结果显示,干预组患者化疗后cTnT 水平低于对照组,差异有统计学意义〔MD=-18.27,95%CI(-22.52,-14.03),P<0.000 01,见图4〕。3 篇文献[14,16-17]报道了化疗后BNP 水平,各文献间有统计学异质性(I2=94%,P<0.000 01),采用随机效应模型进行Meta分析;结果显示,干预组患者化疗后BNP水平低于对照组,差异有统计学意义〔MD=-70.14,95%CI(-94.51,-45.76),P<0.000 01,见图4〕。两篇文献[13,16]报道了化疗后CK-MB水平,两篇文献间无统计学异质性(I2=0,P=0.83),采用固定效应模型进行Meta 分析,结果显示,干预组患者化疗后CK-MB 水平低于对照组,差异有统计学意义〔MD=-7.92,95%CI(-12.31,-3.53),P=0.000 4,见图4〕。

图3 对照组和干预组患者临床和亚临床心脏毒性发生率比较的森林图Figure 3 Forest plot for comparison of incidence of clinical and subclinical cardiac toxicity between control group and intervention group

表1 纳入文献的基本特征Table 1 Basic features of the involved literatures
2.3.3 化 疗 后LVEF 4 篇 文 献[13-14,16-17]报 道 了 化 疗 后LVEF,各文献间有统计学异质性(I2=97%,P<0.000 01),采用随机效应模型进行Meta 分析;结果显示,干预组患者化疗后LVEF 高于对照组,差异有统计学意义〔MD=0.11,95%CI(0.05,0.16),P<0.000 1,见图5〕。
2.3.4 PFS 和OS 3 篇文献[8,10-11]报道了PFS,各文献间有统计学异质性(I2=68%,P=0.03),采用随机效应模型进行Meta 分析;结果显示,两组患者PFS 比较,差异无统计学意义〔HR=0.97,95%CI(0.73,1.29),P=0.84,见图6〕。3篇文献[8,10-11]报道了OS,各文献间无统计学异质性(I2=0,P=0.68),采用固定效应模型进行Meta 分析;结果显示,两组患者OS 比较,差异无统计学意义〔HR=1.04,95%CI(0.88,1.23),P=0.65,见图6〕。
2.3.5 CR 和PR 4 篇文献[8-11]报道了CR,各文献间无统计学异质性(I2=0,P=0.60),采用固定效应模型进行Meta 分析;结果显示,两组患者CR 比较,差异无统计学意义〔RR=1.04,95%CI(0.68,1.57),P=0.86,见 图7〕。4 篇 文 献[8-11]报道了PR,各文献间无统计学异质性(I2=0,P=0.82),采用固定效应模型进行Meta 分析;结果显示,两组患者PR 比较,差异无统计学意义〔RR=0.88,95%CI(0.74,1.05),P=0.17,见图7〕。
2.4 发表偏倚 Harbord 检验结果显示,报道临床心脏毒性发生率的文献无明显发表偏倚(t=1.01,P=0.35)。
3 讨论
蒽环类药物是乳腺癌新辅助化疗方案的重要药物,可提高患者病理完全缓解率。MULROONEY 等[18]研究结果显示,与未接受蒽环类药物化疗的患者相比,接受蒽环类药物累积剂量≥300 mg/m2的患者临床、亚临床心脏毒性发生风险升高23倍,提示蒽环类药物存在严重的心脏毒性,但目前研究表明,部分不含蒽环类药物的新辅助化疗方案尚不能改善患者远期生存结局[3]。蒽环类药物导致的心脏毒性呈剂量依赖性,第1 次使用就可能造成心脏损伤,因此尽早监测并积极预防蒽环类药物化疗所致心脏毒性具有重要意义[19]。

图4 对照组和干预组患者化疗后cTnT、NT-proBNP 及CK-MB 水平比较的森林图Figure 4 Forest plot for comparison of cTnT,NT-proBNP and CK-MB between control group and intervention group after chemotherapy
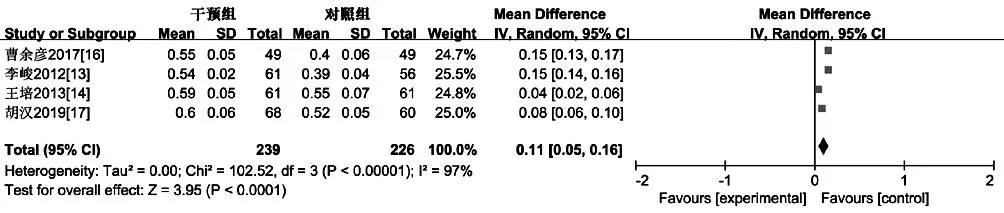
图5 对照组和干预组患者化疗后LVEF 比较的森林图Figure 5 Forest plot for comparison of LVEF between control group and intervention group after chemotherapy

图6 对照组和干预组患者PFS 和OS 比较的森林图Figure 6 Forest plot for comparison of PFS and OS between control group and intervention group

图7 对照组和干预组患者CR 和PR 比较的森林图Figure 7 Forest plot for comparison of CR and PR between control group and intervention group
《中国抗癌协会乳腺癌诊治指南与规范(2017 年版)》[5]指出,乳腺癌患者使用蒽环类药物化疗期间发生有临床症状的心脏毒性或无症状但LVEF<45%或LVEF 较基线值下降>15%,则需要检测cTnT,必要时停药并充分评估患者心脏功能,且后续治疗应慎重。2017 年美国临床肿瘤学会(ASCO)《成人癌症幸存者心功能障碍预防和监测临床实践指南》[20]建议,对接受大剂量蒽环类药物化疗的患者应考虑使用DZR或持续输注脂质体制剂,但尚无证据证明上述方法可有效降低接受低剂量蒽环类药物化疗患者的心脏毒性发生风险。《中国抗癌协会乳腺癌诊治指南与规范(2017 年版)》[5]指出,尽管早期有临床试验显示,同时使用DZR 和蒽环类药物可能会降低化疗的客观有效率,但Meta 分析结果显示,DZR 并未降低化疗效果,反而可降低约70%的心力衰竭发生率。
左心室收缩功能是评估化疗药物所致心脏毒性的常用方法,而LVEF 与心肌收缩能力有关,心肌收缩能力越强则每搏输出量越多、LVEF 越高;cTnT 是目前判定心肌梗死的常用生物学标志物,具有较高的灵敏度和特异度[21];BNP 是判定心力衰竭的重要指标,而CK-MB 是心肌损伤的特异性标志物。本Meta 分析结果显示,干预组患者临床心脏毒性发生率、亚临床心脏毒性发生率及化疗后cTnT、BNP、CK-MB 水平低于对照组,而化疗后LVEF 高于对照组,提示DZR 可有效降低乳腺癌患者蒽环类药物化疗所致心脏毒性;本Meta 分析结果还显示,两组患者PFS、OS、CR 及PR 间无统计学差异,提示DZR 不影响乳腺癌蒽环类药物化疗效果。
现有文献证据表明,DZR 可有效减轻乳腺癌患者蒽环类药物化疗所致心脏毒性,且不会影响蒽环类药物化疗效果;但本Meta 分析仍存在以下不足:(1)纳入的文献大部分未实施双盲,方法学质量较低;(2)纳入的文献多缺乏长期随访数据,可能影响Meta 分析结果的可靠性。因此,DZR 预防乳腺癌患者蒽环类药物化疗所致心脏毒性的有效性尚需高质量、大样本量研究进一步证实。
