miR-424负调控PAK2基因抑制骨肉瘤细胞增殖和诱导凋亡的体外研究
2020-01-17李若飞解俊杰梁慧萍吴静
李若飞,解俊杰,梁慧萍,吴静
咸阳市中心医院骨四科1、皮肤美容科2,陕西 咸阳 712000
骨肉瘤是原发于骨髓内的高恶性肿瘤,是最常见的原发性恶性骨肿瘤,75%的患者在10~30岁发病,且好发于男性[1]。骨肉瘤易复发并且早期转移率非常高,在初诊的骨肉瘤患者中有10%~20%出现远处转移,且90%为肺转移,骨肉瘤一旦发生转移和复发就预示预后不良[2]。因此阐明骨肉瘤的发生发展机制,对改善骨肉瘤的诊断方法和提高治疗效果有重要意义。
大量研究表明,微小型RNA(microRNA,miRNA)是一类17~25 nt长短的小RNA分子,不具有蛋白编码功能。miRNA在调控细胞增殖、凋亡、肿瘤血管生成、浸润及转移中发挥着重要作用[3],通过与靶基因mRNA上特定序列结合,可以剪切靶基因的mRNA分子或抑制靶基因蛋白质翻译,从而起到调控靶基因的作用[4]。研究发现,骨肉瘤细胞中miR-424抑制细胞增殖和诱导细胞凋亡[5-6],但其具体分子机制尚不清楚。研究发现,PAK2在乳腺癌细胞中上调,抑制其表达抑制细胞增殖和转移[7]。头颈鳞癌中PAK2-c-Myc-PKM2轴是一个致癌通路,促进癌症进展[8]。PAK2基因在骨肉瘤中的表达尚无报道,本文就miR-424和PAK2对骨肉瘤细胞增殖、凋亡的影响以及miR-424是否可通过调控PAK2基因来抑制骨肉瘤细胞增殖和诱导其细胞凋亡展开研究,以期为今后骨肉瘤的治疗提供新思路。
1 材料与方法
1.1 材料 健康人成骨细胞系hFOB1.19、骨肉瘤细胞系MG63、U2-OS、SOSP-9607购于中国科学院上海生命科学研究院细胞资源中心。胎牛血清(fetal bovine serum,FBS)和DMEM培养液购于Gibco,RT-PCR相关试剂盒购于日本TaKaRa,miR-424、内参U6的引物购于美国ABI公司,LipofectamineTM2000转染试剂盒购于美国Invitrogen公司,一抗PAK2购自美国Abcam公司,总蛋白提取试剂盒购于上海生工生物工程股份有限公司,CCK-8试剂盒购于Dojindo。细胞凋亡检测试剂盒购于南京凯基公司。
1.2 方法
1.2.1 细胞培养 细胞常规培养于含10%FBS的DMEM培养液中,其中青霉素1×105U/mL,链霉素100 mg/mL。置于37℃、5%CO2的细胞培养箱中培养,选择对数生长期细胞进行后续实验。
1.2.2 Real-time PCR法检测RNA的表达 根据Trizol法抽提总RNA,按照PrimeScriptTMRT Master Mix试剂盒说明书进行操作,合成cDNA。miR-424-F:5'-CAGCAGCAATTCATGTTTTGAA-3',miR-424-R:5'-CAAAACATGAATTGCTGCTGT-3';PAK2-F:5'-TG AGCACACCATCCATGTTGG-3',PAK2-R:5'-AGGT CTGTAGTAATCGAGCCC-3';U6 作为内参,U6-F:5'-GCTTCGGCAGCACATATACTAAAAT-3'; U6-R:5'-CGCTTCACGAATTTGCGTGTCAT-3'。按照SYBR Green I PCR检测试剂盒说明书在ABI7500荧光定量PCR仪中进行PCR扩增反应,反应条件:95℃预变性30 s,95℃变性 5 s,60℃退火 32 s,70℃延伸30 s,循环40次。溶解曲线分析:95℃ 15 s,60℃ 30 s,95℃15 s。2-△△Ct法测定各基因mRNA的相对表达水平。每个样品孔重复检测3次,取均值。
1.2.3 Western bolt检测蛋白的表达 按照蛋白提取试剂盒说明书提取各实验组细胞的总蛋白。根据BCA试剂盒说明书测定蛋白浓度,取25 g蛋白上样,SDS-PAGE充分分离后,转到聚偏氟乙烯膜,室温条件下封闭液封闭1 h,加稀释后I抗,4℃条件下过夜,第二天用TBST洗膜3次,每次15 min,之后加入相应Ⅱ抗,室温条件下孵育2 h,TBST洗膜,加入显影液显影,以β-actin作内参,利用Image J软件计算条带灰度比,利用统计软件进行统计分析。
1.2.4 细胞转染 收集对数生长期的骨肉瘤U2-OS细胞,适当密度接种到6孔板上。细胞融合到70%时,根据LipofectamineTM2000转染试剂盒说明书将过表达miR-424的模拟物和其miR阴性对照转染至U2-OS细胞中,分别标记为miR-424组和miR-con组。转染5 h后换为含血清的新鲜培养基继续培养,并用RT-PCR检测转染效果(参照上述1.2.2中的方法)。后续试验中,将U2-OS细胞随机分为anti-miR-424组(转染干扰miR-424的模拟物)、anti-miR-con组(转染干扰miR-424的miR阴性对照)、si-PAK2 组(转染沉默PAK2的siRNA)、si-con组(转染沉默PAK2的阴性对照)、miR-424+pcDNA-PAK2组(miR-424模拟物与pcDNA-PAK2载体共转染)、miR-424+pcDNA组(miR-424模拟物与pcDNA空载体共转染)六组,采用上述方法转染后进行后续实验。
1.2.5 CCK-8法检测细胞活力 将对数生长期的各组U2-OS细胞消化后,以每孔5×103的密度接种于96孔板中,放于细胞培养箱中培养24 h,后加入10 L CCK-8溶液,培养箱中培养2 h,酶标仪在490 nm波长处检测各孔吸光度值。
1.2.6 流式细胞术检测细胞凋亡 收集各组待测细胞,离心漂洗去上清后,按照Annexin V-FITC凋亡试剂盒说明书进行操作。具体用缓冲液重悬细胞,轻摇至均匀,避光孵育15 min,加入适量Annexin V-FITC,避光条件下孵育15 min。采用流式细胞仪检测细胞凋亡。
1.3 统计学方法 应用SPSS22.0软件进行数据统计分析,计量数据均经正态性检验符合正态分布,以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较使用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤细胞系和健康人成骨细胞中miR-424和PAK2的表达水平比较 与健康人成骨细胞hFOB1.19相比,骨肉瘤细胞系 MG63、U2-OS、SOSP-9607中miR-424的表达量明显下降,PAK2的mRNA和蛋白的表达量明显上升,差异均有统计学意义(P<0.05),见图1和表1。
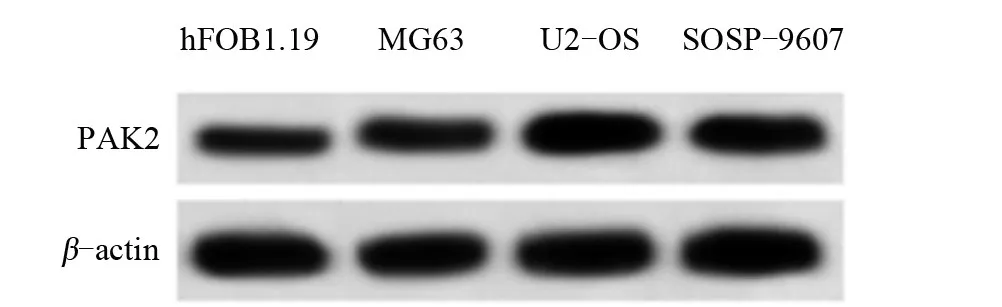
图1 骨肉瘤细胞系和健康人成骨细胞中PAK2蛋白表达
2.2 上调miR-424表达对骨肉瘤细胞U2-OS增殖和细胞凋亡的影响 与miR-con组比较,上调miR-424表达明显增加骨肉瘤U2-OS细胞中miR-424的表达量、细胞凋亡率、促凋亡蛋白Bax的表达量,显著降低48 h和72 h的细胞活力、促增殖蛋白Cyclin D1的表达量、抑凋亡蛋白Bcl-1的表达量,差异均有统计学意义(P<0.05),而24 h的细胞活力差异无统计学意义(P>0.05),见表2和图2。
表1 骨肉瘤细胞系和健康人成骨细胞中miR-424和PAK2的表达水平比较(±s,n=6)
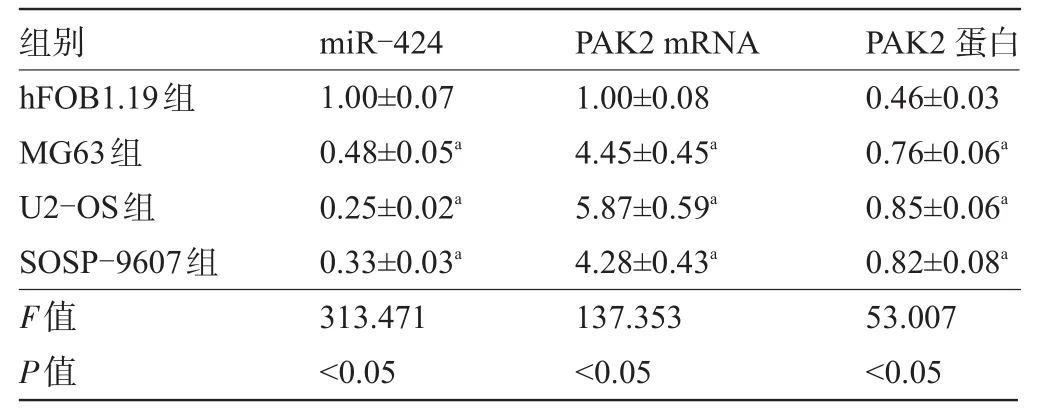
表1 骨肉瘤细胞系和健康人成骨细胞中miR-424和PAK2的表达水平比较(±s,n=6)
注:与hFOB1.19组比较,aP<0.05。
组别hFOB1.19组MG63组U2-OS组SOSP-9607组F值P值PAK2蛋白0.46±0.03 0.76±0.06a 0.85±0.06a 0.82±0.08a 53.007<0.05 miR-424 1.00±0.07 0.48±0.05a 0.25±0.02a 0.33±0.03a 313.471<0.05 PAK2 mRNA 1.00±0.08 4.45±0.45a 5.87±0.59a 4.28±0.43a 137.353<0.05
表2 上调miR-424表达对骨肉瘤细胞U2-OS增殖和细胞凋亡的影响(±s,n=6)

表2 上调miR-424表达对骨肉瘤细胞U2-OS增殖和细胞凋亡的影响(±s,n=6)
组别miR-424细胞活力(OD490 nm)细胞凋亡率(%)Cyclin D1Bcl-2Bax miR-con组miR-424组t值P值0.99±0.08 4.58±0.41 21.051<0.05 24 h 0.38±0.02 0.36±0.02 1.732 0.114 48 h 0.79±0.04 0.54±0.03 12.247<0.05 72 h 1.19±0.06 0.81±0.05 11.918<0.05 8.47±0.55 21.75±1.38 21.897<0.05 0.87±0.05 0.45±0.03 17.644<0.05 0.58±0.05 0.43±0.04 5.738<0.05 0.47±0.05 0.78±0.06 9.722<0.05
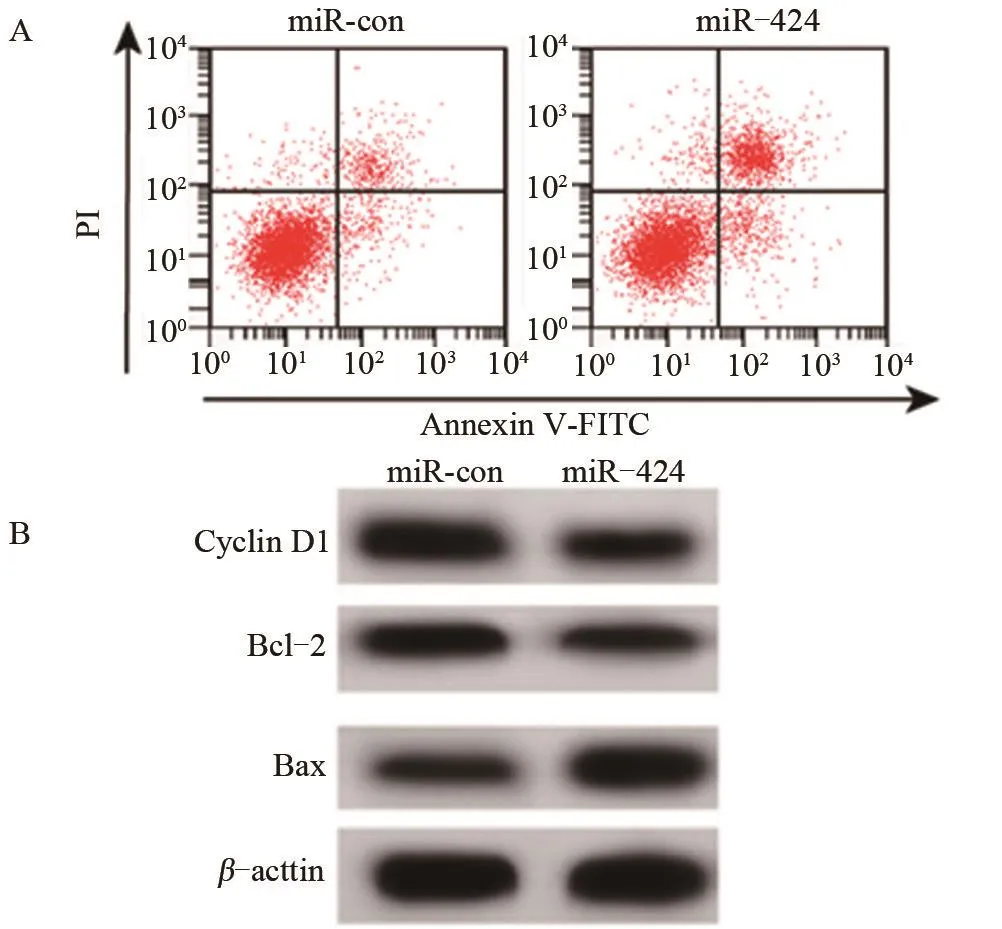
图2 骨肉瘤细胞U2-OS凋亡率及增殖和凋亡相关蛋白表达注:A,流式细胞术检测骨肉瘤细胞U2-OS凋亡;B,Western blot检测骨肉瘤细胞U2-OS中Cyclin D1、Bcl-2和Bax蛋白表达。
2.3 miR-424靶向PAK2并负向调控其表达 TargetScan(http://www.targetscan.org/)软件检测结果,miR-424和PAK2之间存在互补结合位点,见图3A。双荧光素酶报告基因试验结果表明,同miR-con与WT-PAK2共转染相比,miR-424与WT-PAK2共转染后,U2-OS细胞荧光素酶活性明显下降,差异有统计学意义(P<0.05);而miR-con、miR-424分别与MUT-PAK2共转染后,U2-OS细胞荧光素酶活性变化不明显,差异无统计学意义(P>0.05),见表3。与miR-con组相比,miR-424组中PAK2蛋白的表达量显著下降,差异有统计学意义(P<0.05);相反,anti-miR-424组中PAK2蛋白的表达量较anti-miR-con组显著升高,差异有统计学意义(P<0.05),见表4和图3B。
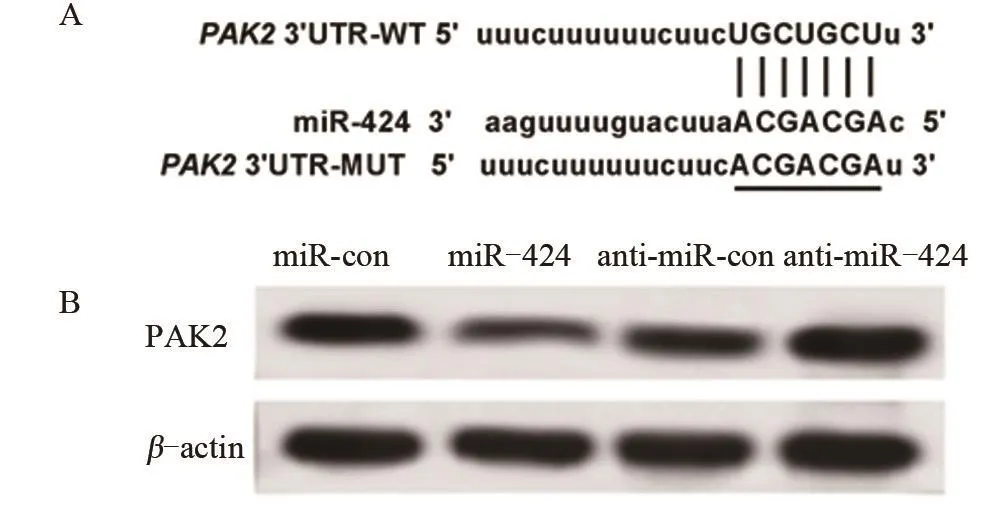
图3 miR-424与PAK2互补的核苷酸序列以及miR-424调控PAK2表达
表3 双荧光素酶报告实验(±s,n=6)
组别miR-con组miR-424组t值P值WT-PAK2 1.00±0.05 0.63±0.07 10.536<0.05 MUT-PAK2 0.96±0.09 1.08±0.12 1.960 0.079
表4 miR-424调控PAK2的表达(±s,n=6)
注:与miR-con组比较,aP<0.05;与anti-miR-con组比较,bP<0.05。
组别miR-con组miR-424组anti-miR-con组anti-miR-424组F值P值PAK2 0.81±0.04 0.38±0.05a 0.69±0.06 0.92±0.08b 92.482<0.05
2.4 下调PAK2表达对骨肉瘤细胞U2-OS增殖和凋亡的影响 与si-con组比较,下调PAK2表达明显降低48 h和72 h的细胞活力、PAK2蛋白的表达量、促增殖Cyclin D1蛋白的表达量、抑凋亡蛋白Bcl-2的表达量,显著提高细胞凋亡率、促凋亡蛋白Bax的表达量,差异均有统计学意义(P<0.05),而24 h的细胞活力差异不显著,差异无统计学意义(P>0.05),见表5和图4。
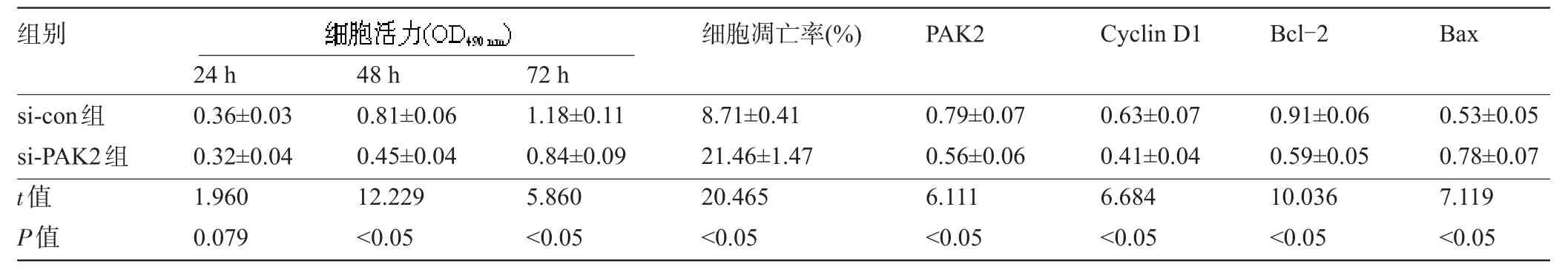
表5 下调PAK2表达对骨肉瘤细胞U2-OS增殖和凋亡的影响(x-±s,n=6)
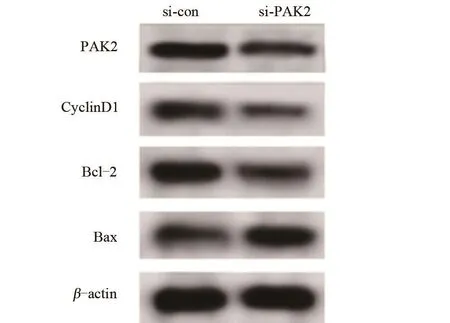
图4 骨肉瘤细胞中PAK2、Cyclin D1、Bcl-2和Bax蛋白表达
2.5 过表达PAK2能部分逆转miR-424对骨肉瘤U2-OS细胞的增殖和凋亡的影响 转染24 h后,miR-con组与miR-424组细胞的吸光度值差异不明显,差异无统计学意义(P>0.05)。转染48 h和72 h后,miR-24组较miR-con组细胞的吸光度值显著下降,细胞的凋亡率显著升高,差异均有统计学意义(P<0.05);PAK2蛋白和促增殖蛋白Cyclin D1和抑凋亡蛋白Bcl-2的表达量明显下降,促凋亡蛋白Bax的表达量明显升高,差异均有统计学意义(P<0.05)。转染24 h后,miR-424+pcDNA组与miR-424+pcDNA-PAK2组的细胞吸光度值差异不明显,差异无统计学意义(P>0.05),转染48 h和72 h后,miR-424+pcDNA-PAK2组较miR-424+pcDNA组细胞吸光度值显著升高,细胞的凋亡率显著下降;PAK2蛋白和促增殖蛋白Cyclin D1和抑凋亡蛋白Bcl-2的表达量明显升高,促凋亡蛋白Bax的表达量明显下降,差异均有统计学意义(P<0.05),见表6和图5。
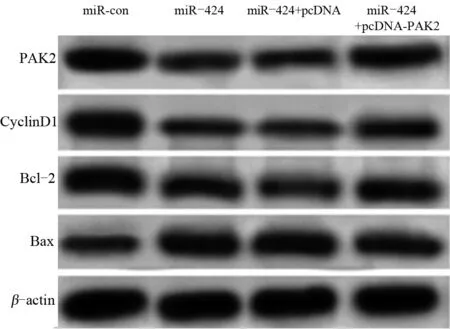
图5 骨肉瘤细胞中PAK2蛋白表达
表6 过表达PAK2逆转miR-424表达对骨肉瘤细胞U2-OS增殖和凋亡的作用(±s,n=6)
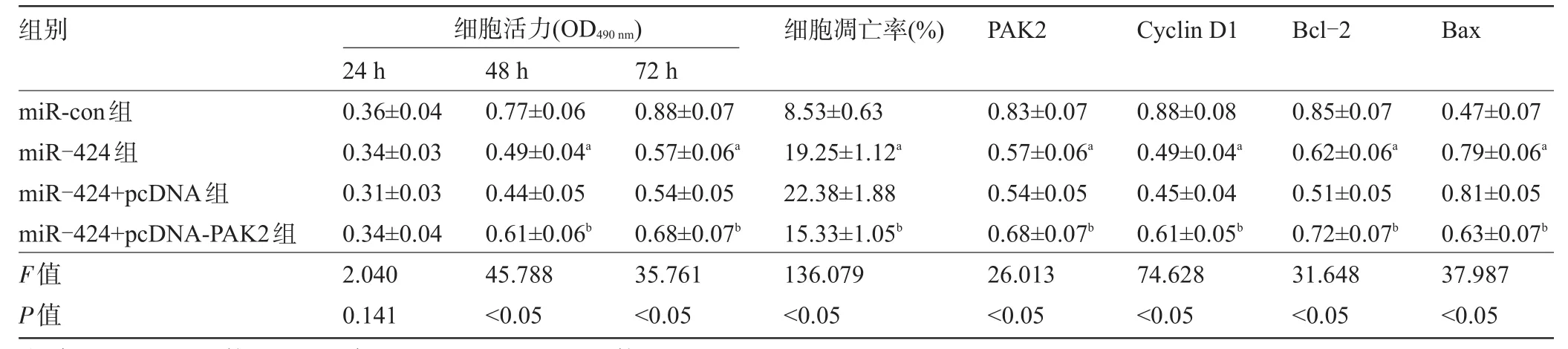
表6 过表达PAK2逆转miR-424表达对骨肉瘤细胞U2-OS增殖和凋亡的作用(±s,n=6)
注:与miR-con组比较,aP<0.05;与miR-424+pcDNA组比较,bP<0.05。
组别 细胞活力(OD490 nm)细胞凋亡率(%)PAK2Cyclin D1Bcl-2Bax miR-con组miR-424组miR-424+pcDNA组miR-424+pcDNA-PAK2组F值P值24 h 0.36±0.04 0.34±0.03 0.31±0.03 0.34±0.04 2.040 0.141 48 h 0.77±0.06 0.49±0.04a 0.44±0.05 0.61±0.06b 45.788<0.05 72 h 0.88±0.07 0.57±0.06a 0.54±0.05 0.68±0.07b 35.761<0.05 8.53±0.63 19.25±1.12a 22.38±1.88 15.33±1.05b 136.079<0.05 0.83±0.07 0.57±0.06a 0.54±0.05 0.68±0.07b 26.013<0.05 0.88±0.08 0.49±0.04a 0.45±0.04 0.61±0.05b 74.628<0.05 0.85±0.07 0.62±0.06a 0.51±0.05 0.72±0.07b 31.648<0.05 0.47±0.07 0.79±0.06a 0.81±0.05 0.63±0.07b 37.987<0.05
3 讨论
骨肉瘤是青少年最常见的恶性骨肿瘤,易发生早期转移,致死率和致残率较高[9-10]。目前对于骨肉瘤的治疗多采用手术治疗结合化疗、放疗的综合疗法,但是骨肉瘤手术治疗致残率高、假体功能差,放疗和化疗毒副作用大,并且晚期肿瘤对化疗药耐受,导致骨肉瘤患者的生存率低,治疗效果不尽人意[11]。因此,寻找一种治疗骨肉瘤效果好、可行性大且不良反应小的临床新方法已成为目前研究的热点。
近年研究表明,miRNA是肿瘤发生发展中最基本的参与者,在肿瘤进展中发挥着关键作用。miRNA主要通过与靶基因mRNA 3'非编码区(3'untranslated region,3'UTR)完全配对促使靶基因mRNA发生降解,或不完全配对抑制mRNA的翻译但不影响其稳定性,从而调控靶基因的表达,进而影响肿瘤细胞增殖、凋亡、分化、浸润及转移等[12]。miRNA可作为癌症发生发展的指标,所以探寻与癌症相关的miRNA及下游靶基因有利于癌症的诊断与治疗。刘萍等[13]发现miR-424与肿瘤的发生、发展、治疗及预后关系密切。严贝芬等[14]发现miR-424-5p通过下调Bcl-2的表达抑制人肺癌细胞的增殖,李宏敏等[15]发现miR-424能够通过调控E2F6而抑制非小细胞肺癌细胞的生长和侵袭,孙雪梅等[16]发现miR-424a通过与ARK5 mRNA 3'UTR结合抑制胶质瘤细胞的侵袭。据研究报道,miR-424在骨肉瘤细胞中抑制细胞增殖、诱导细胞凋亡[5-6],本文通过RT-PCR法和Western blot法检测发现,与健康成骨细胞相比,骨肉瘤细胞中miR-424的表达下调,提示其可能在骨肉瘤中起抑癌基因的作用。过表达miR-424细胞活性显著下降,凋亡率显著升高,且促增殖蛋白Cyclin D1、抑凋亡蛋白Bcl-2的表达量明显下降,促凋亡蛋白Bax的表达量明显升高,结果与此前研究一致,但其具体分子机制尚不清楚。
据研究报道,p21激活激酶2(PAK2)在多种肿瘤中异常表达,可参与细胞骨架重构、细胞凋亡、信号传导等,在肿瘤的发生和发展中起到重要作用[17]。PAK2在乳腺癌、胃癌、头颈鳞癌、黑色素瘤及膀胱癌等癌症中充当促癌基因的功能[18-20],但其在骨肉瘤中的作用还未有报道。本研究通过RT-PCR法和Western blot法检测,发现PAK2在骨肉瘤细胞中表达上调,沉默PAK2抑制了骨肉瘤U2-OS细胞的活性,促进细胞凋亡,且明显降低细胞中促增殖蛋白Cyclin D1、抑凋亡蛋白Bcl-2的表达量,并明显升高促凋亡蛋白Bax的表达量,其对骨肉瘤细胞的影响与miR-424恰好相反。本实验利用生物信息预测miR-424与PAK2之间的关系,结果表明miR-424与PAK2之间存在结合位点。荧光素酶基因报告试验进一步验证,发现miR-424与PAK2之间存在靶向调控关系,提示PAK2是miR-424的下游靶基因。同时,过表达miR-424明显减少PAK2的表达量,而沉默miR-424明显升高PAK2的表达量,证实miR-424可负向调控PAK2的表达。此外,研究发现PAK2可以逆转miR-424对骨肉瘤细胞增殖的抑制作用,以及对细胞凋亡的促进作用。这些结果说明miR-424抑制骨肉瘤细胞增殖,并促进细胞凋亡可能是通过靶向调控PAK2表达来实现的。
综上所述,miR-424可通过抑制PAK2的表达抑制骨肉瘤细胞的增殖、诱导其细胞凋亡。本文明确了miR-424和PAK2对骨肉瘤细胞增殖、凋亡的影响并初步探讨了miR-424可通过调控PAK2的表达发挥抗肿瘤作用的可能机制,为临床治疗骨肉瘤提供了可靠的理论依据和新的治疗思路。
