硅藻土-环糊精杂化材料的制备与吸附性能
2020-01-17曹仕文,张鸿,孟驰涵,邹新全,周炜东,郭静
曹 仕 文, 张 鸿, 孟 驰 涵, 邹 新 全, 周 炜 东, 郭 静
( 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
大量携带重金属铜离子(Cu2+)的工业废水排放至环境中,严重影响环境安全和人类健康[1-2]。研发可靠去除Cu2+等重金属污染的方法至关重要[3]。目前,重金属离子处理方法主要是化学法和物理化学法[4]。在吸附法中化学法和物理化学法可同时实现,且操作简单、效率高,因此被认为是实际应用中最有效的方法[5]。硅藻土作为一种常见吸附剂,其壁壳上大量有序排列的微孔[6-7],同时表面丰富的硅羟基使其能够大量吸附有机污染物和重金属离子而不产生有害副产物[8]。但硅藻土中常有伴生性杂质,且吸附性能有一定的局限性,吸附能力较弱,因此,对硅藻土进行改性以提升其吸附能力十分必要[9],目前针对硅藻土的改性方法主要有无机化合物-沉淀法以及有机化合物-化学包覆法[10],目前更多化学包覆法应用于重金属处理,如乌兰[11]利用硅藻土为载体,丙烯酰胺熔化包覆硅藻土制备出具有吸水性树脂材料。其中丙烯酰胺作为一种包覆材料,环糊精同样作为包覆材料,且可利用其结构中大量羟基官能团进行修饰或者聚合反应,聚合环糊精用于环境污染处理,如李仲谨等[12]采用反相乳液聚合方法交联β-环糊精得到聚合物微球,对Zn2+静态吸附实验表明微球吸附能力上升,并且吸附过程为自发放热过程。为提升硅藻土的吸附效果,且综合利用环糊精的吸附能力,作者利用化学包覆法原理,以硅藻土为载体提供稳定结构,采用乳液聚合法交联β-环糊精(β-CD)负载到硅藻土表面,利用硅藻土与β-CD结构中大量羟基基团,硅藻土结构中氢键作用,提升杂化材料的吸附效果;研究了杂化材料的化学结构、结晶性能和微观形貌,以及吸附重金属Cu2+时,动力学、等温线以及各影响因素与杂化材料关系,以期为杂化材料应用于废水处理提供依据。
1 实 验
1.1 材 料
环氧氯丙烷(ECH)、硅藻土(分析纯),Span60、Tween60(化学纯),上海麦克林生物化学有限公司;β-CD,分析纯,萨思化学技术(上海)有限公司;NaOH,分析纯,天津奥普升化工有限公司;煤油,分析纯,天津大茂化学试剂厂;硫酸铜,分析纯,天津市科密欧化学试剂有限公司。
1.2 硅藻土/β-CD杂化材料的制备
硅藻土的纯化:称取20 g 硅藻土加到1 000 mL 0.1 mol的HCl溶液中,搅拌处理3 h后取出,洗涤,干燥,采用200目筛筛出处理后的硅藻土。
硅藻土/β-CD合成:称取8 g NaOH加到20 mL 去离子水中,加入12 g β-CD,使其完全溶解,在20 ℃水浴中边搅拌边加入12.44 mL ECH。其中ECH与β-CD摩尔比为15∶1,控制时间30 min 滴加完毕,反应1.5 h后加入80 mL含有1.6 g 乳化剂的煤油,乳化剂中Tween60与Span60质量比为1∶3,同时加入0.64 g硅藻土,硅藻土与β-CD的摩尔比为1∶1,高速搅拌5 min后升温至60 ℃反应8 h。反应结束后将产物过滤并用稀盐酸、乙醇、蒸馏水进行充分洗涤,除去多余杂质,洗涤后产物放入冷冻干燥机干燥至恒重,得到硅藻土/β-CD杂化材料。
1.3 硅藻土/β-CD杂化材料表征
使用Spectrum One-B型傅里叶红外光谱仪对硅藻土/β-CD杂化材料分子结构进行表征,采用溴化钾压片法测定红外光谱,扫描波数500~4 000 cm-1。采用日本理学公司生产的D/max-3-X射线衍射仪进行测试,分析材料的结晶性能与结构。采用日本电子株式会社JSM-6460LV型扫描电子显微镜对杂化材料表面进行形貌分析。
1.4 吸附实验
以制备的样品为吸附剂对重金属Cu2+进行吸附实验。配制一定浓度的Cu2+溶液,将杂化材料加到所需实验条件的吸附烧杯中,达到吸附平衡后取上清液作为测试溶液,利用原子力发射光谱仪测试剩余Cu2+浓度。通过吸附实验分析杂化材料吸附动力学、吸附热力学等温线、吸附机理及过程;同时探讨接触时间、Cu2+初始质量浓度、材料添加量、溶液pH和温度对吸附Cu2+的影响。平衡吸附量和去除率计算公式[13-14]:
qe=(ρ0-ρe)V/m
(1)
R=[(ρ0-ρe)/ρ0]×100%
(2)
式中:qe为平衡吸附量,mg/g;ρ0、ρe分别为Cu2+溶液初始质量浓度和平衡质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g;R为去除率,%。
2 结果与讨论
2.1 硅藻土/β-CD杂化材料结构分析
图1为硅藻土/β-CD杂化材料及β-CD的红外光谱图。从图中可以看出,β-CD在1 150 cm-1附近出现C—O的伸缩振动峰,1 180 cm-1附近出现C—O—C伸缩振动吸收峰,2 920 cm-1处出现—CH2的反对称伸缩振动吸收峰;在801 cm-1处出现Si—O对称伸缩振动峰,1 200 cm-1处出现Si—O—Si的反对称伸缩振动,同时出现β-CD的特征峰。杂化材料曲线没有出现新基团特征峰,表明只进行物理复合,未发生化学反应。
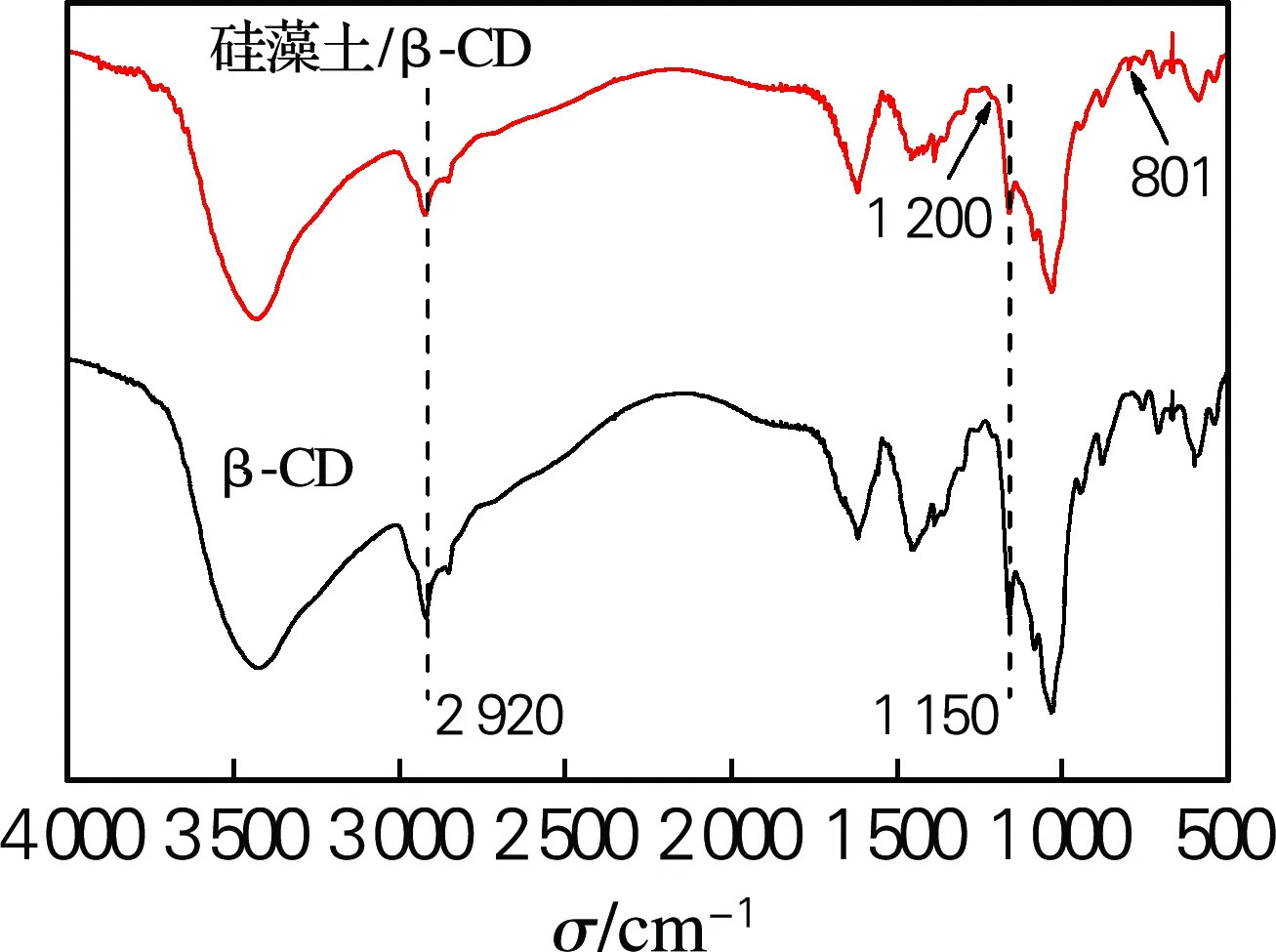
图1 β-CD及硅藻土/β-CD杂化材料红外光谱图
2.2 硅藻土/β-CD杂化材料XRD谱图分析
图2为硅藻土、β-CD和硅藻土/β-CD杂化材料XRD曲线。β-CD曲线分别在31°、45°和56°附近出现衍射特征峰,硅藻土的衍射特征峰分别在21°、35°处。而在β-CD/硅藻土杂化材料曲线中,可以看到硅藻土与β-CD的衍射峰值21°、35°以及31°、45°和56°均有存在,因为硅藻土和β-CD各自的结晶能力导致杂化材料中结晶峰值略微下降。但杂化材料中没有新衍射特征峰出现。
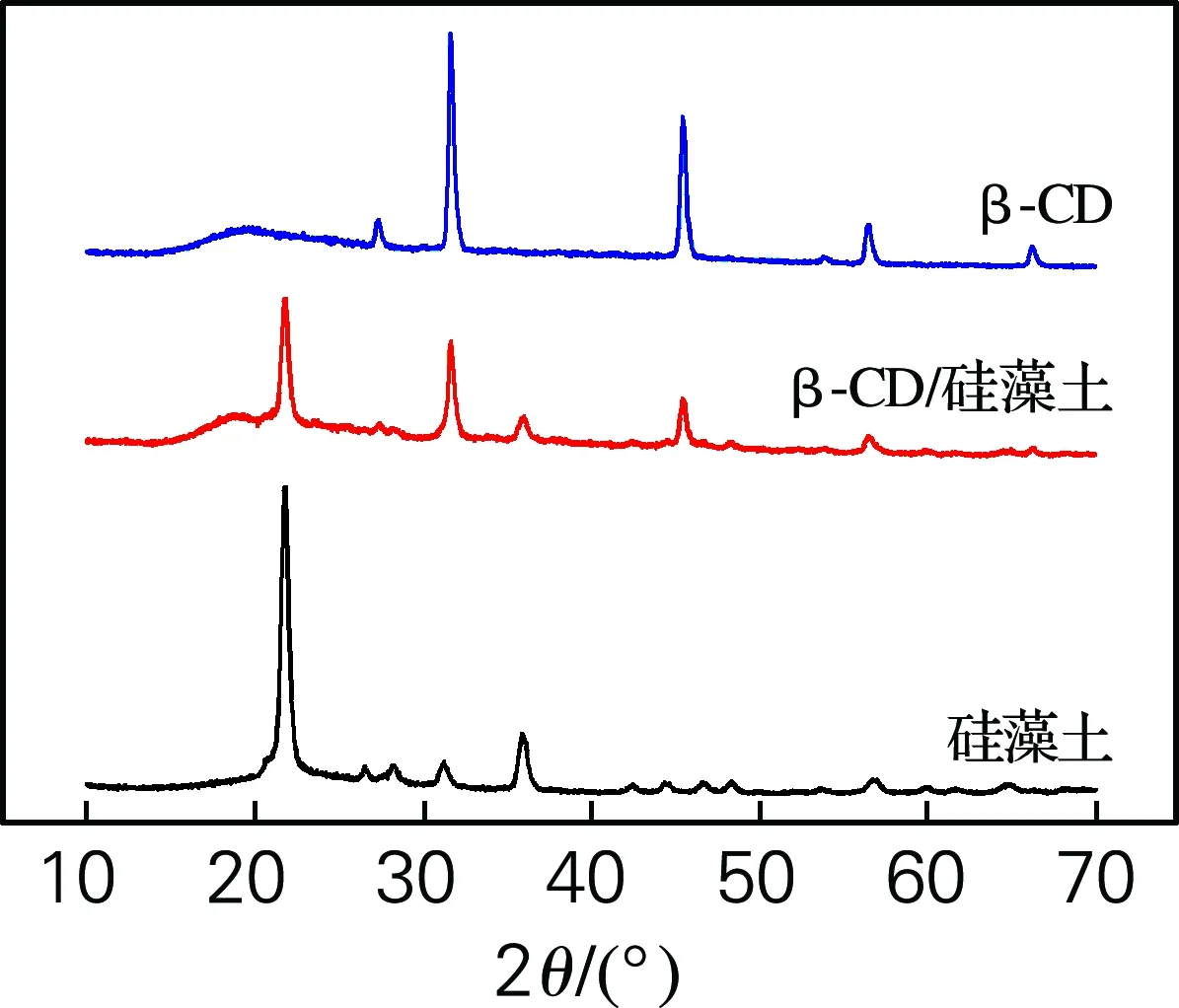
图2 硅藻土、β-CD和硅藻土/β-CD杂化材料的XRD谱图
Fig.2 XRD patterns of diatomite, β-CD and diatomite/β-CD hybrid materials
2.3 硅藻土/β-CD杂化材料SEM分析
图3为硅藻土/β-CD杂化材料的微观形貌图,可以看到,杂化材料呈球形,形态完好。放大图中杂化材料的表面有不光滑的凸点,因为硅藻土的表面为扁平不规整结构,因此β-CD聚合时导致出现一些不均匀的突兀包。

(a) 3 000倍
2.4 吸附实验分析
2.4.1 吸附动力学
为深入研究硅藻土/β-CD杂化材料作为吸附剂时对Cu2+的吸附情况,用动力学模型描述吸附动力学。采用表观吸附动力学模型中的拟一阶吸附动力学方程(式(3))、拟二阶吸附动力学方程(式(4))和颗粒内扩散动力学方程(式(5))进行拟合动力学数据[15]:
1/qt=k1/(qet)+1/qe
(3)
(4)
qt=kpt0.5
(5)
式中:qe和qt分别为平衡时和t时刻的Cu2+吸附量,mg/g;k1为拟一阶吸附速率常数,min-1;k2为拟二阶吸附速率常数,mg/(g·min);kp为内扩散速率常数,g/(g·min0.5)。
图4为硅藻土/β-CD杂化材料吸附Cu2+的吸附动力学拟合曲线,拟合曲线参数见表1。拟二阶动力学方程相关系数r2=0.989 04,高于其他两个动力学方程。采用拟二阶动力学描述吸附Cu2+过程较好,表明杂化材料对Cu2+吸附是不均匀的多分子层吸附并伴随化学吸附过程[16]。
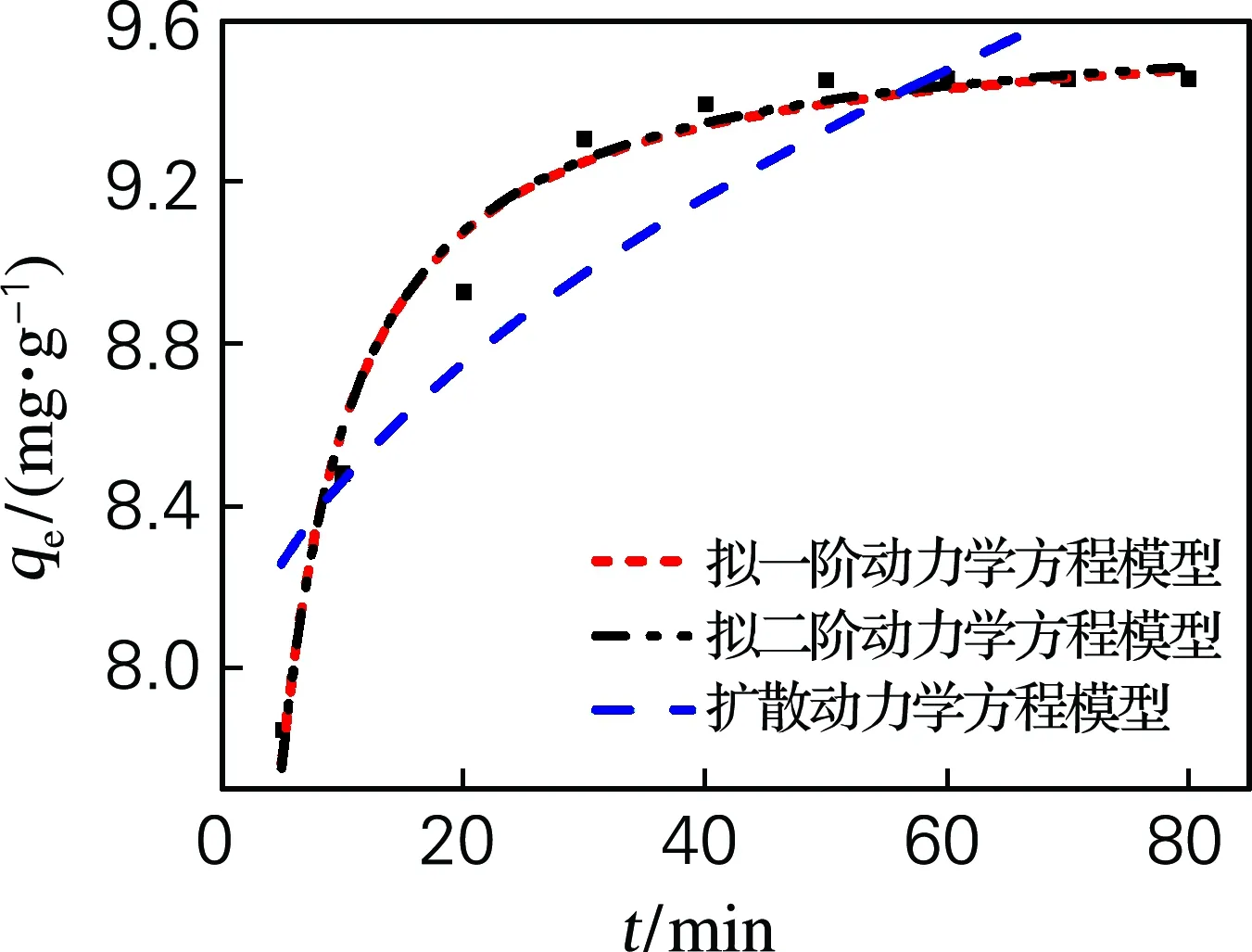
图4 硅藻土/β-CD杂化材料吸附动力学方程模型

表1 动力学方程拟合曲线参数
2.4.2 吸附等温线
改变Cu2+初始质量浓度得到等温吸附曲线。采用Langmuir和Freundlich模型对数据进行拟合处理[17]。
Langmuir模型:
qe=qmkρe/(1+kρe)
(6)
R=1/(1+kρ0)
Freundlich模型:
(7)
式中:qe为吸附平衡时吸附量,mg/g;ρe为吸附平衡时质量浓度,mg/L;qm为最大吸附量,mg/g;k为Langmuir常数,L/mg;kf为Freundlich常数,L/mg;1/n为与吸附强度有关的溶剂参数。
图5为硅藻土/β-CD杂化材料吸附Cu2+的等温吸附拟合曲线。硅藻土/β-CD杂化材料吸附Cu2+等温吸附拟合Langmuir的相关系数(r2=0.994 49)高于Freundlich的相关系数(r2=0.994 21),硅藻土/β-CD杂化材料的等温吸附符合Langmuir曲线,表明吸附过程是在材料表面上单层吸附,材料中每个吸附点具有相同的吸附能力。由Langmuir计算出最大吸附容量为145.177 8 mg/g。Freundlich常数1/n越小其吸附过程越容易发生,拟合曲线中1/n=0.99<1,说明硅藻土/β-CD作为吸附剂吸附Cu2+过程为自发过程。
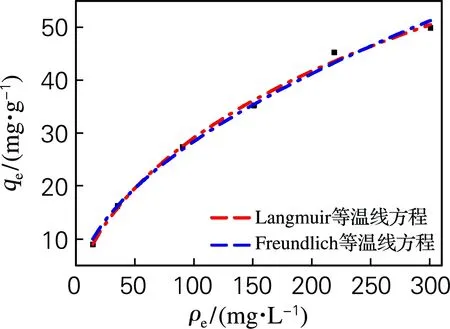
图5 硅藻土/β-CD杂化材料吸附等温线方程图
2.4.3 硅藻土/β-CD与单体吸附Cu2+能力比较
表2为同等实验条件下硅藻土、β-CD、硅藻土/β-CD杂化材料的吸附Cu2+能力对比。由表2看出,硅藻土/β-CD杂化材料的吸附容量以及去除率均高于单体硅藻土和β-CD,吸附容量比硅藻土提升20.4%,比β-CD提升20.2%,因为硅藻土与β-CD中各自具有一定的吸附位点,杂化后吸附位点增多,导致杂化材料的吸附能力提升。

表2 硅藻土、β-CD、硅藻土/β-CD杂化材料吸附Cu2+对比
2.4.4 接触时间对吸附Cu2+的影响
图6为硅藻土/β-CD杂化材料吸附Cu2+时随接触时间的变化。由图可知,在50 min左右曲线趋于平衡,吸附容量为9.46 mg/g。吸附机理为:当吸附剂刚接触Cu2+时,杂化材料的表面有大量待吸附位点,吸附容量会迅速上升,当杂化材料的吸附位点达到饱和后,杂化材料就达到一种吸附平衡状态。因此硅藻土/β-CD杂化材料的吸附平衡时间为50 min。
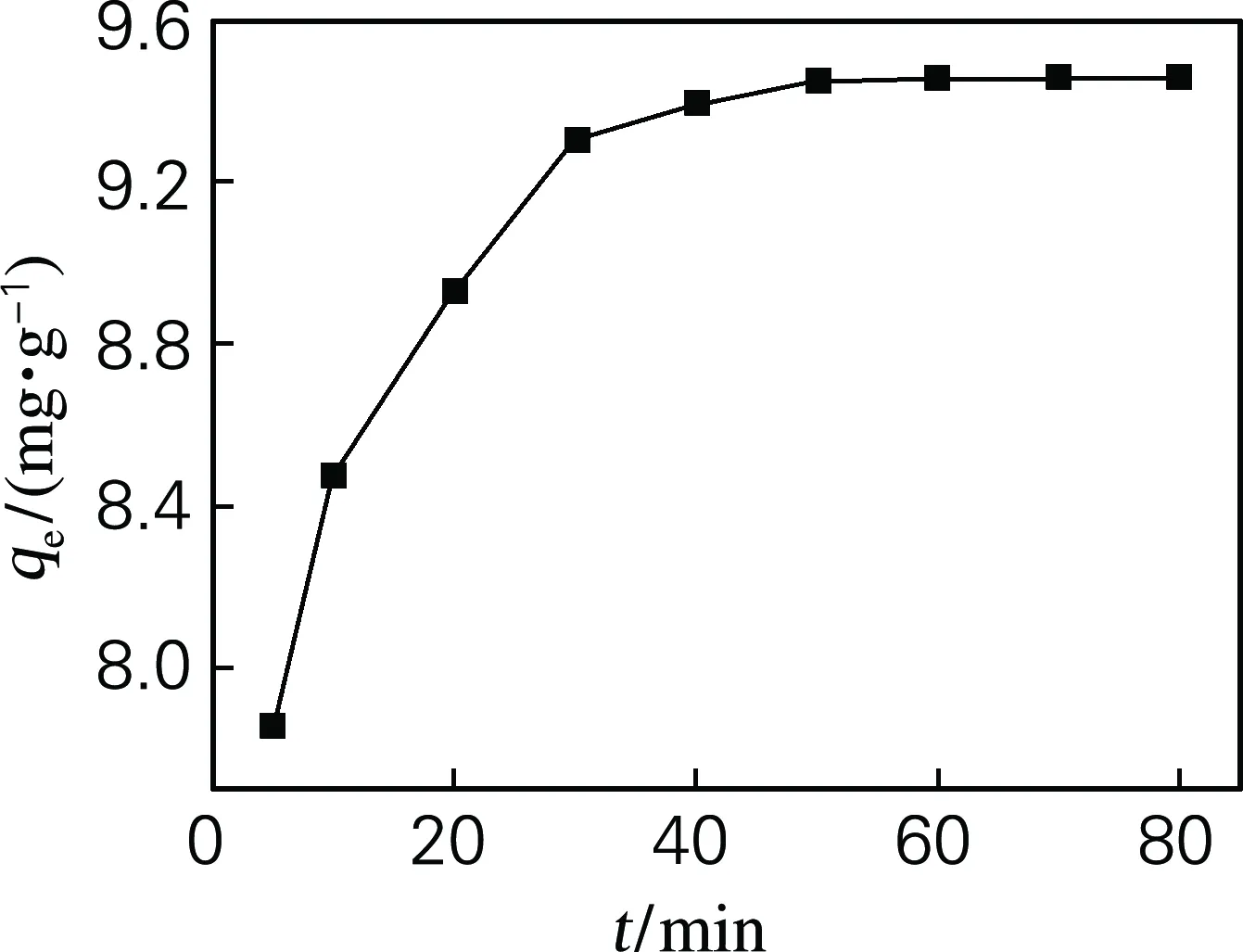
图6 接触时间对杂化材料吸附容量的影响
2.4.5 Cu2+初始质量浓度对吸附Cu2+的影响
图7为Cu2+初始质量浓度对吸附的影响。当Cu2+初始质量浓度由50 mg/L提升到500 mg/L 时,硅藻土/β-CD杂化材料对Cu2+的吸附容量由8.931 5 mg/g增加到49.84 mg/g,去除率由71.45%降低到39.87%。因为随着Cu2+初始质量浓度的增大,溶液中的活性Cu2+增多,导致Cu2+与材料吸附位点碰撞的机会增加,更多的吸附位点参与吸附,因此吸附容量逐渐增大。但材料中参与吸附的位点增加比例远低于Cu2+浓度增加的速率,导致去除率下降。

图7 Cu2+初始质量浓度对吸附容量和去除率的影响
Fig.7 Effects of initial mass concentration of Cu2+on adsorption abilities and removal efficiencies of hybrid materials
2.4.6 硅藻土/β-CD杂化材料的投入量对吸附Cu2+的影响
图8为硅藻土/β-CD杂化材料投入量对吸附Cu2+的影响。当杂化材料投入量由0.05 g增加到0.25 g时,吸附容量由33.766 mg/g下降到13.88 mg/g,去除率由33.766%上升到69.854%。因为杂化材料投入量增加,直接增加了杂化材料的吸附位点数量,更多的Cu2+被吸附,致使去除率上升。杂化材料增加但溶液中Cu2+没有增多,也间接使剩余吸附位点增多,只有部分活性位点被用来吸附Cu2+,导致整体吸附容量变小。结合吸附容量和去除率,选用杂化材料用量为0.2 g。
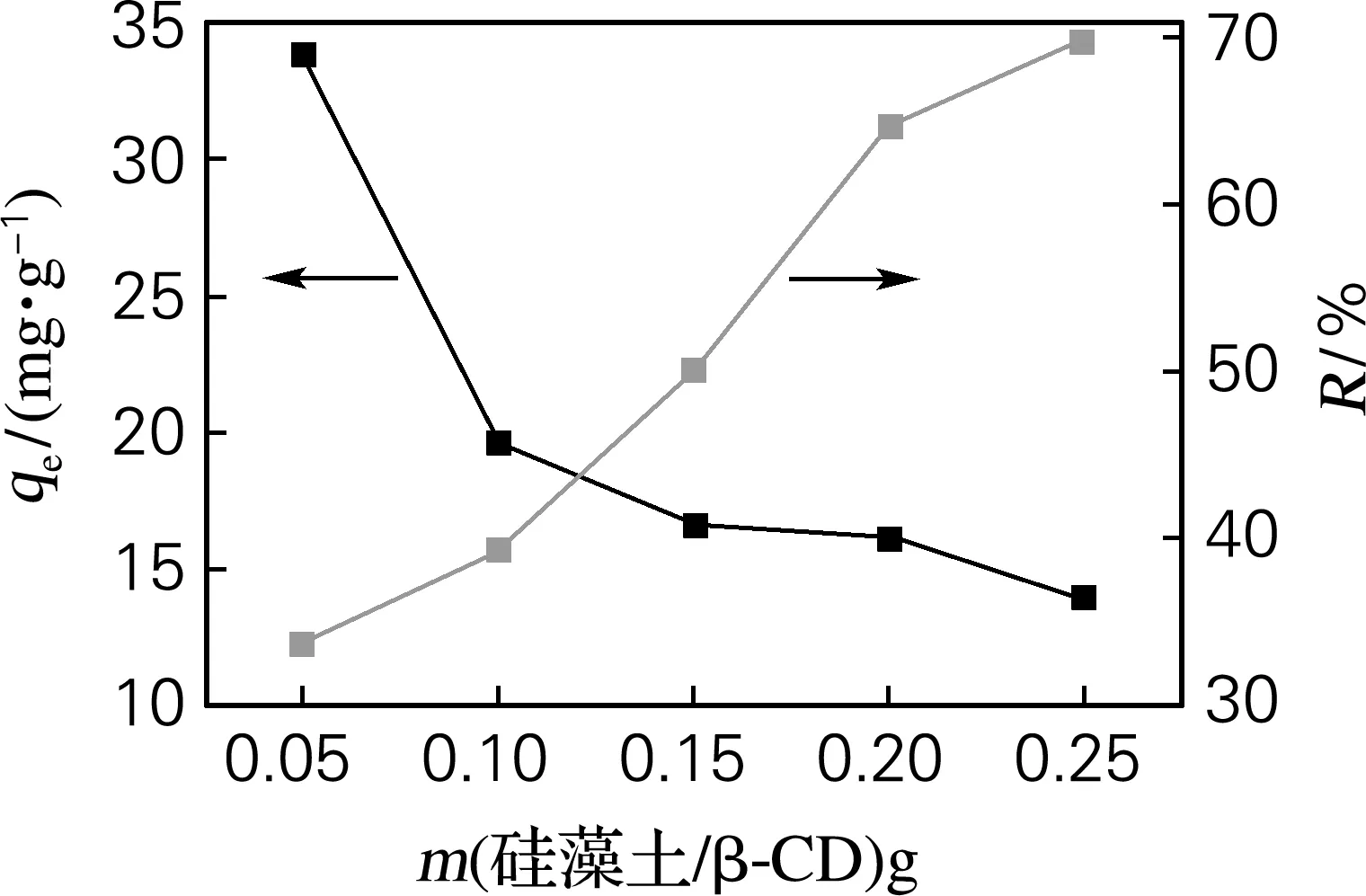
图8 杂化材料投入量对吸附容量和去除率的影响
Fig.8 Effects of materials dosages on adsorption abilities and removal efficiencies of hybrid materials
2.4.7 pH对吸附Cu2+的影响
图9为pH对吸附Cu2+的影响。随着pH的升高,杂化材料吸附容量及去除率都在升高。在pH为2时,杂化材料对Cu2+的去除率较低,仅为40.3%,pH较低时溶液中存在的大量带正电的H+包围在杂化材料表面,而Cu2+与H+竞争杂化材料上吸附位点时不如H+,导致杂化材料对Cu2+吸附量降低。随着pH的升高,H+浓度降低,Cu2+的竞争能力上升,杂化材料的吸附Cu2+能力逐渐增强,pH为7时最大,去除率达到64.747%。因为在碱性条件下Cu2+会出现沉淀,所以未做讨论。杂化材料最佳的吸附pH为7,天然水体pH为6.0~7.5[18],此时吸附材料对天然水体中Cu2+的吸附不受pH影响。
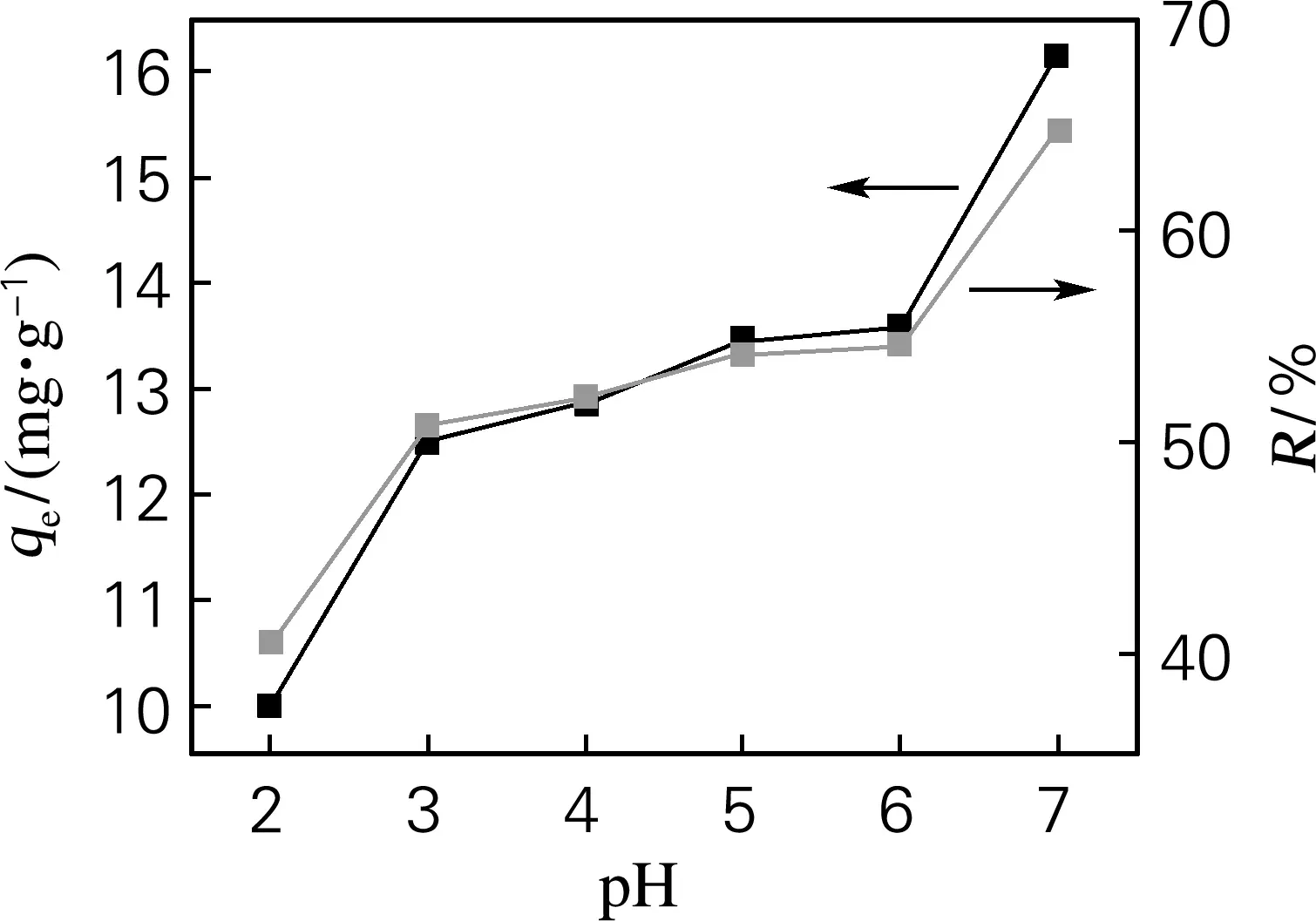
图9 pH对杂化材料的吸附容量和去除率的影响
2.4.8 温度对吸附Cu2+的影响
图10为温度对吸附Cu2+的影响。温度从20 ℃ 上升到45 ℃过程中,最优的吸附温度为20 ℃,此时吸附容量和去除率分别为16.186 mg/g和64.747%。当提高温度后,可能因为在杂化材料吸附Cu2+过程中,吸附位点的吸附过程需要放出热量,而Cu2+解离过程需要吸收热量,提高温度使提供给杂化材料的热量增多,导致杂化材料向着解离方向转变,致使杂化材料吸附能力下降。所以最优吸附温度为20 ℃。
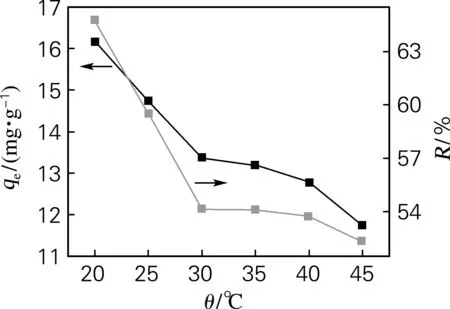
图10 温度对杂化材料的吸附容量和去除率的影响
Fig.10 Effects of temperature on adsorption abilities and removal efficiencies of hybrid materials
3 结 论
制备了一种硅藻土/β-CD有机无机杂化材料,杂化材料为微球,结构完整。通过吸附实验得出,硅藻土/β-CD杂化材料吸附能力强于硅藻土和β-CD单体,硅藻土/β-CD杂化材料吸附Cu2+过程符合拟二阶动力学模型和Langmuir等温线方程。接触时间为50 min、杂化材料投入量0.2 g、温度20 ℃、溶液pH为7时吸附效率最优,Cu2+去除率为64.747%。
