鸸鹋油的抑菌活性及机理研究
2020-01-16郭彦君郑召君刘元法
郭彦君,郑召君,叶 展,刘元法
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡,214122)
青霉素等抗菌药物的广泛使用会使病原菌出现极强的适应性。细菌等微生物和抗生素等抗菌药多次接触后,对药物的敏感性会逐渐减小或消失[1]。抗菌药物作用靶点与其化合物结构密切相关,不同结构单元的作用靶点基本不同,常用的抗菌药物应用到临床后,容易出现耐药菌株,发现新结构的抗菌化合物或对已知抗菌活性的化合物进行结构修饰是攻克耐药菌株难关的重要手段。自然界中化合物结构复杂多样,有生物活性,所以研究自然界中具有抗菌活性的物质一直是抗菌研究的主要方向。
鸸鹋油,提取自鸸鹋背部的厚脂肪袋,被认为用于保护鸸鹋免受澳大利亚极端天气的伤害[2]。鸸鹋、鸵鸟和美洲鸵是澳洲常见的鸟类,鸸鹋是三者当中最小的,但其脂肪组织占比最高,得到的鸸鹋油极具价值。澳大利亚的原住民一直通过外敷鸸鹋油治疗创伤,促进伤口恢复和减轻疼痛[3]。鸸鹋油有很多用途:可以改善肠胃炎,缓解关节炎,降低胆固醇,减轻动脉粥样硬化,促进药物渗透[4-9]。鸸鹋油也被报道具有抗菌性:鸸鹋油基静电纺丝纤维具有广谱抗菌功效,混有鸸鹋油、荷荷巴油、鳄梨油和茶树油的护肤霜可抑制细菌和真菌的生长,鸸鹋油和其他抗菌成分混合制成抗菌药物[10-11]。鸸鹋油由于其广泛的功能性受到了越来越多的学者关注。
鸸鹋油虽然被报道具有抗菌性,但是多为和其他成分共同作用,目前尚未报道鸸鹋油自身的抗菌性及抗菌机理。前期研究发现,鸸鹋油水溶性较差,不能在固体琼脂培养基上出现清晰的抑菌圈,所以将鸸鹋油同乙醇、Tween 80混合均匀制成乳液,同对照组进行比较检测鸸鹋油的抗菌性,研究鸸鹋油对大肠埃希菌和金黄色葡萄球菌的抑制机理,以期为鸸鹋油在食品产业中的抗菌应用提供理论支撑。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
鸸鹋油块,无锡德诚乐邦生物技术有限公司提供;中性蛋白酶,诺维信公司;大肠埃希菌(E.coliATCC 25922)、金黄色葡萄球菌(S.aureusATCC 25923)、沙门氏菌,实验室储藏;Tween 80、胰蛋白胨、酵母提取物、氯化钠、琼脂、氢氧化钠、无水乙醇、十二水磷酸氢二钠、磷酸二氢钾、氯化铵、氯化钾、氯化钙、葡萄糖、乳糖、七水硫酸镁、β-巯基乙醇,国药集团化学试剂有限公司;邻硝基苯-β-D-吡喃半乳糖苷(ONPG),上海阿拉丁生化科技股份有限公司; BCA蛋白浓度测定试剂盒,碧云天生物技术;溶菌酶、细菌活性化蛋白制备裂解液、Ezup 柱式细菌基因组 DNA 抽提试剂盒,生工生物工程(上海)股份有限公司;超微量总ATP酶(ATPase)测定试剂盒(比色法)、碱性磷酸酶(AKP)测定试剂盒(微板法)、β-半乳糖苷酶,南京建成生物工程研究所。
1.1.2 仪器与设备
RW20DS025搅拌器;ME204E/02电子天平,梅特勒-托利多仪器有限公司; HH-601恒温水浴;FD23烘箱,德国宾得;V4BS000旋涡混匀器;T25DS25高速分散机,德国IKA公司;立式压力蒸汽灭菌器;BSC生物安全柜;BSD台式恒温振荡器;容声BCD526WD11HY冰箱; YXQ-LS 立式压力蒸汽灭菌器;DNM-9602G酶标仪;Zetasizer nano ZS纳米粒度及Zeta电位仪,英国马尔文公司。
1.2 实验方法
1.2.1 鸸鹋油的提取
将200 g鸸鹋油块和180 g去离子水置于烧杯中,于60℃水浴低速搅拌。加入氢氧化钠溶液调节pH至7后,加入5 g中性蛋白酶,反应3 h后100℃灭酶2 min。4 500 r/min离心10 min,取上层加入干燥无水硫酸钠过夜,抽滤所得鸸鹋油分装后于-20℃保存备用。
1.2.2 鸸鹋油乳液的制备及分组
乳液体系按照鸸鹋油、水、无水乙醇和Tween 80混合均匀,10 000 r/min高速剪切3 min,常温下备用[12]。实验组和对照组的乳液成分见表1。

表1 各组的乳液成分
1.2.3 鸸鹋油最小抑菌浓度(MIC)的测定
鸸鹋油的MIC通过二倍稀释法测得[13]。将大肠埃希菌、金黄色葡萄球菌和沙门氏菌分别接种到LB培养基中,37℃摇床培养7 h,用LB培养基稀释至浓度为105CFU/mL的菌悬液。将21 μL一系列二倍稀释浓度的鸸鹋油乳液加入到179 μL LB菌悬液中,轻轻振荡使其混合均匀, 96孔板置于37℃培养箱中培养20 h,采用酶标仪测定96孔板中样品在595 nm下的OD值。阴性对照参见表1对照组配方进行制备,实验重复3次。
1.2.4 鸸鹋油时间杀菌曲线的测定
鸸鹋油抑菌活性可以通过平板计数法评估。将895 μL培养至对数生长期的菌悬液(105CFU/mL)和105 μL特定浓度(4MIC,2MIC,1MIC)的鸸鹋油乳液混合均匀。混合物37℃摇床培养,转速为200 r/min。在培养时间0、1、2、3、4 h时,分别从混合物中取出100 μL,经梯度稀释后涂板。平板置于37℃培养箱中培养24 h后进行平板计数,计算每毫升的细菌存活数,绘制时间杀菌曲线[13]。阴性对照参见表1对照组配方进行制备,实验重复3次。
1.2.5 鸸鹋油对供试菌细胞通透性的影响
取LB液体培养基培养至对数生长期的大肠埃希菌和金黄色葡萄球菌,离心并且用无菌生理盐水洗涤2次,再悬浮于0.02 mol/L、pH 6.0磷酸盐缓冲液中。菌悬液(OD600值为0.2)加入鸸鹋油乳液使终浓度为4MIC,置于37℃摇床中培养,分别在培养0、1、2、3、4 h时取菌悬液测定260 nm处的OD值[14]。阴性对照参见表1对照组配方进行制备,实验重复3次。按下式计算细胞膜破坏程度,评价鸸鹋油对供试菌细胞通透性的影响。
(1)
式中:A1为含有鸸鹋油的样品组在各取样时间点的OD值;A0为含有鸸鹋油的样品组在0 h时的OD值;Ac为不含鸸鹋油的样品组在各取样时间点的OD值。
1.2.6 鸸鹋油对供试菌细胞质膜渗透性的影响
将对数生长后期的待测细菌菌液离心,无菌生理盐水洗涤2次,接种10 mL的M9乳糖诱导培养基,37℃振荡诱导培养10 h,离心,洗涤,用β-半乳糖苷酶反应缓冲液重悬至OD600值为0.4。取895 μLβ-半乳糖苷酶反应缓冲液重悬的待测菌液,加入105 μL鸸鹋油乳液使终浓度为4MIC,再加入100 μL 1 mg/mL 的ONPG混匀,37℃水浴,每隔1 h测定405 nm处的ODt值[1]。阴性对照参见表1对照组配方进行制备,吸光度为OD0,实验重复3次。
1.2.7 鸸鹋油对供试菌细胞表面电位的影响
将培养至对数生长后期的待测细菌菌液离心,无菌超纯水洗涤2次后重悬,加入鸸鹋油乳液使终浓度为4MIC,混匀,37℃孵育10 min,1 mmol/L KNO3(pH 6.2)溶液清洗两次,重悬并稀释至OD600值为0.2,室温下用Zeta电位仪测定细菌表面电位[15]。阴性对照参见表1对照组配方进行制备,实验重复3次。
1.2.8 鸸鹋油对供试菌细胞表面疏水性的影响
将培养至对数生长后期的待测菌液离心,无菌生理盐水洗涤2次,用0.1 mol/L KNO3(pH 6.2)溶液重悬至OD600值为0.2。取895 μL菌悬液于1.5 mL EP管,加入鸸鹋油乳液使终浓度为4MIC,再加入0.4 mL十六烷作为有机相,封口后,涡旋振荡混匀,37℃孵育15 min,两相完全分离,用移液枪快速吸取下层水相200 μL,以KNO3溶液为空白对照于600 nm处测定OD1值; 阴性对照参见表1对照组配方进行制备,涡旋振荡混匀,37℃孵育15 min,取菌液在600 nm处测OD0值[16]。同时测定不加鸸鹋油的菌悬液的OD0及OD1值。实验重复3次。测定十六烷对供试菌吸附率的变化检测鸸鹋油对细菌细胞表面疏水性的影响。
十六烷吸附率=(1-OD1/OD0)×100%
(2)
1.2.9 鸸鹋油对供试菌总蛋白含量的影响
将培养至对数生长后期的待测细菌菌液离心,无菌生理盐水洗涤2次,用新鲜的LB培养基重悬至OD600值为0.8。将菌悬液和鸸鹋油乳液混合均匀,使其终浓度为4MIC。在0 h和4 h分别取样1 mL,5 000 r/min离心5 min,弃上清,收集菌体。金黄色葡萄球菌菌体中加入720 μL 10 mg/mL 溶菌酶,涡旋振荡均匀,37℃孵育4 h,8 000 r/min离心3 min,转移上清到一个新的离心管中,作为可溶性蛋白质部分。大肠埃希菌根据细菌活性化蛋白制备裂解液收集蛋白。根据BCA蛋白浓度测定试剂盒测定总蛋白含量[17]。阴性对照参见表1对照组配方进行制备,每组实验重复3次。
1.2.10 鸸鹋油对供试菌DNA含量的影响
将培养至对数生长期的待测细菌菌液离心,无菌生理盐水洗涤2次,新鲜LB培养基重悬至OD600值为0.8。将菌悬液和鸸鹋油乳液混合均匀,使其终浓度为4MIC。0 h和4 h分别取样1 mL,室温下8 000 r/min离心1 min[18]。根据Ezup 柱式细菌基因组 DNA 抽提试剂盒收集DNA。阴性对照参见表1对照组配方进行制备,每组实验重复3次。
1.2.11 鸸鹋油对供试菌ATP酶活性的影响。
按1.2.9取0~4 h所得蛋白根据超微量总ATP酶(ATPase)测定试剂盒(比色法)进行测定[19]。
1.2.12 鸸鹋油对供试菌β-半乳糖苷酶表达活性的影响
按1.2.9取0~4 h得到的蛋白500 μL加入1 000 μLβ-半乳糖苷酶反应缓冲液、500 μL 10 mg/mL ONPG,振荡混匀,37℃孵育2 h,在405 nm处测定OD值[20]。
1.2.13 鸸鹋油对供试菌碱性磷酸酶表达活性的影响
按1.2.9取0~4 h得到的蛋白根据碱性磷酸酶(AKP)测定试剂盒(微板法)进行测定[21]。
1.2.14 统计分析
采用SPSS Statistics 19 软件分析数据,采用Origin 2018b 软件绘图。
2 结果与讨论
2.1 鸸鹋油最小抑菌浓度(MIC)(见表2)
最小抑菌浓度(MIC)能够定量表示抑菌剂抑菌性能[22]。如表2所示,大肠埃希菌对鸸鹋油较为敏感,最小抑菌浓度为0.006 25%,对金黄色葡萄球菌的最小抑菌浓度为0.012 5%,并且鸸鹋油对沙门氏菌没有表现出抑菌性。鸸鹋油乳液中虽然有乙醇和Tween 80,但这两种表面活性剂并不会完全抑制大肠埃希菌和金黄色葡萄球菌的生长。
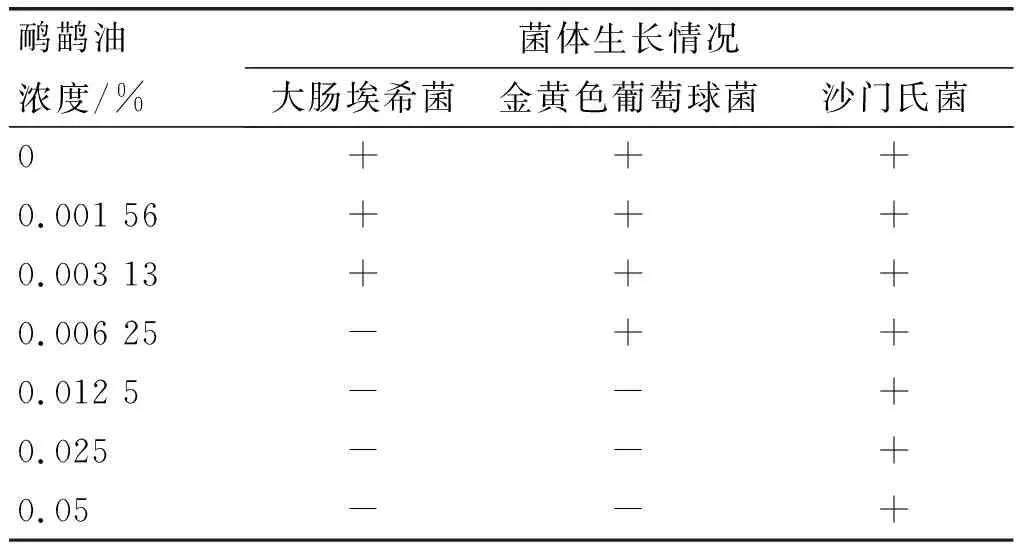
表2 鸸鹋油对供试菌的最小抑菌浓度
注:+,有菌生长;-,无菌生长。鸸鹋油浓度以质量分数表示。
2.2 鸸鹋油时间杀菌曲线(见图1)
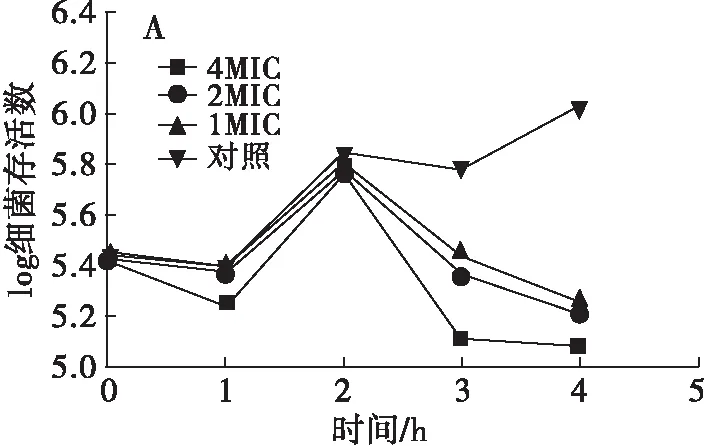
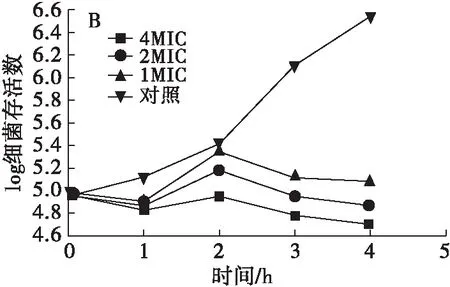
图1 不同浓度鸸鹋油作用下大肠埃希菌(A)、金黄色葡萄球菌(B)时间杀菌曲线
细菌的时间杀菌曲线是将少量细菌接种到一定体积的新鲜培养基中,适宜条件进行培养,定时稀释菌液通过平板菌落计数法测定菌液中的细菌存活数,以培养时间为横坐标,以细菌存活数的对数为纵坐标绘制得到的曲线[23]。如图1所示,鸸鹋油对两种供试菌有一定抑制效果,但抑制作用较为温和。一般情况下细菌经过1 h适应期后进入指数生长期,但由于鸸鹋油乳液中含有的表面活性剂乙醇和Tween 80具有抑菌作用,所以1 h取样时发现大肠埃希菌的实验组和对照组同时出现了细菌存活数下降的现象。在2 h取样时发现实验组和对照组细菌存活数显著提升,推测鸸鹋油对供试菌的抑制作用较为缓慢。2 h后,大肠埃希菌和金黄色葡萄球菌的生长开始受到鸸鹋油的抑制,并且抑制强度同鸸鹋油浓度成正比。
2.3 鸸鹋油对供试菌细胞通透性的影响(见图2)

图2 鸸鹋油对供试菌细胞通透性的影响
细菌细胞膜遭到破坏后,会造成胞内大分子物质的泄露,细胞内的DNA和RNA会向外泄漏,通过测定260 nm下的OD值可对其进行定量分析。通过公式(1)计算得到的比值越大,表明核酸物质泄漏量越大。根据图2可知,经鸸鹋油处理后,两种供试菌的细胞膜破坏程度随时间的变化情况基本一致,但破坏性可以忽略不计。推测鸸鹋油基本不会破坏大肠埃希菌和金黄色葡萄球菌的细胞膜,细胞的整体性基本没有受到破坏,所以2.2测定的时间杀菌曲线中,鸸鹋油处理组细菌数虽然减少,但并未降至0。
2.4 鸸鹋油对供试菌细胞质膜渗透性的影响(见图3)
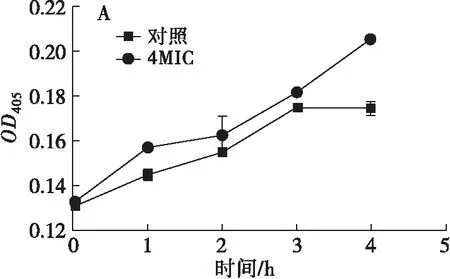

图3 鸸鹋油对大肠埃希菌(A)、金黄色葡萄球菌(B)细胞质膜渗透性的影响
β-半乳糖苷酶是位于细菌细胞质内的、被充分研究的一种水解酶,能够在多糖代谢过程中水解乳糖生成葡萄糖和半乳糖。β-半乳糖苷酶可由细菌在乳糖诱导下产生,ONPG是乳糖的类似物,可以迅速进入菌体,被β-半乳糖苷酶水解生成半乳糖和黄色的邻硝基苯酚,在405 nm处有特征吸收。当细菌细胞质膜遭到破坏时,ONPG迅速进入细胞,培养液OD值快速升高[24],因此可用OD值变化来检测鸸鹋油对供试菌细胞质膜渗透性的影响。如图3所示,对照组乙醇和Tween 80的抑菌效果会使供试菌细胞质膜渗透性的破坏程度随作用时间延长而增强,但3 h后均不再出现明显增强。鸸鹋油处理可引起2种细菌细胞质膜渗透性增加,但同对照组相比细胞质膜渗透性影响并非特别明显,仅在培养末期表现出优势。
2.5 鸸鹋油对供试菌细胞表面电位的影响(见表3)

表3 鸸鹋油对供试菌细胞表面电位的影响
细菌表面电荷由细胞表面化学结构组成决定,大多数微生物在正常生理条件下都能表现出负电性的表面电荷。Zeta电位绝对值越小,菌体分散体系越不稳定,各菌体之间的凝聚沉积作用越明显[15]。如表3所示,鸸鹋油作用于供试菌后,2种细菌的电负性显著减弱。鸸鹋油作用于细菌表面使表面电位升高的同时也增加了细胞表面的疏水性,有研究指出这可能会使菌体更容易凝集、成团、变性。
2.6 鸸鹋油对供试菌细胞表面疏水性的影响(见图4)
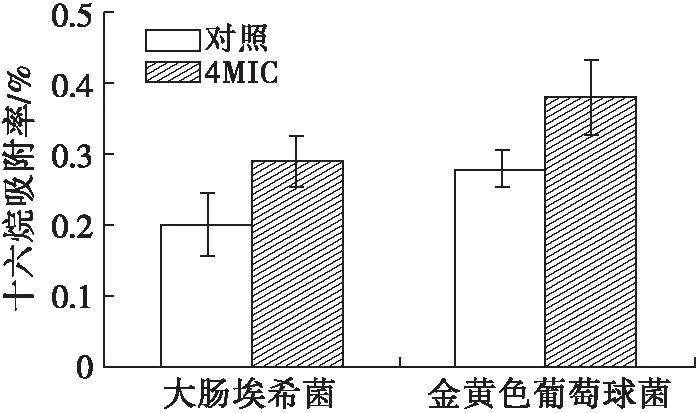
图4 鸸鹋油对供试菌细胞表面疏水性的影响
细菌在极性水中呈现出的不稳定状态可由细菌细胞表面疏水性来表示。十六烷具有较强的疏水性且对微生物细胞无明显损伤作用,可以通过测定十六烷对供试菌吸附率的变化检测细菌细胞表面疏水性的变化[14]。如图4所示,鸸鹋油作用后,2种细菌的表面疏水性同对照组相比都有一定程度提高。由此可推测鸸鹋油能使大肠埃希菌和金黄色葡萄球菌的表面疏水性增大,同时也会升高表面电位,同2.5测定的表面电位相对应。
2.7 鸸鹋油对供试菌总蛋白含量的影响(见图5)
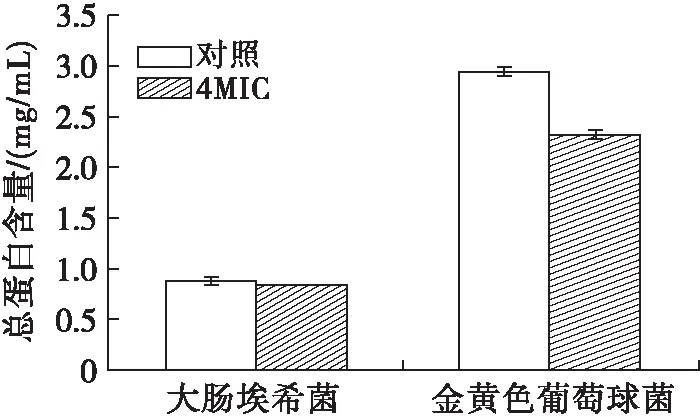
图5 鸸鹋油对供试菌总蛋白含量的影响
蛋白质的合成是细菌生命活动的重要环节之一,蛋白质作为酶、离子通道、受体及运载体等在细菌生长代谢过程中发挥着重要作用[25]。如图5所示,同对照组比较,鸸鹋油能使2种供试菌的总蛋白含量降低。根据细胞膜通透性的变化得出鸸鹋油基本没有破坏供试菌的细胞膜,所以总蛋白含量的降低主要是由于合成减少,而不是泄露。这表明鸸鹋油可以抑制大肠埃希菌和金黄色葡萄球菌总蛋白的合成,对金黄色葡萄球菌的抑制效果更为显著。
2.8 鸸鹋油对供试菌DNA含量的影响(见图6)
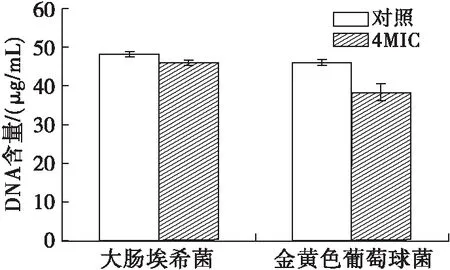
图6 鸸鹋油对供试菌DNA含量的影响
DNA是细胞核内染色体的一个成分,储藏遗传信息。鸸鹋油对DNA合成产生影响时,也会对菌体内的大分子合成产生影响,从而对供试菌的生长产生影响[26]。如图6所示,同对照组相比,鸸鹋油使2种供试菌DNA含量降低。2.3已推断出鸸鹋油基本没有破坏供试菌的细胞膜,所以DNA含量的降低主要是由于合成的减少,而不是泄露至菌体外。由此推断鸸鹋油能够抑制大肠埃希菌和金黄色葡萄球菌DNA合成,对金黄色葡萄球菌的抑制效果更为显著。
2.9 鸸鹋油对供试菌ATP酶活性的影响(见图7)
ATP酶能将ATP催化水解为ADP和磷酸根离子,其活性与菌体的能量代谢密切相关,影响菌体的物质运送、能量转换以及信息传递。菌体在缺氧及疾病状态下,ATP酶活性会发生变化[27]。如图7所示,鸸鹋油对大肠埃希菌和金黄色葡萄球菌ATP酶活性均有抑制作用,但是二者效果不一致。乙醇和Tween 80的抑菌作用在鸸鹋油作用于大肠埃希菌的前2 h内,使对照组和鸸鹋油组的ATP酶活性均明显下降;2 h后,对照组ATP酶活性恢复,鸸鹋油的抑菌作用使得4MIC处理组的菌体ATP酶活性上升速度远小于对照组。乙醇和Tween 80使得对照组的金黄色葡萄球菌中ATP酶活性基本没有发生变化,在一定范围内波动;4MIC处理组的ATP酶活性在1 h 时有轻微下降,2 h时明显下降且之后一直处于较低水平。鸸鹋油对供试菌的ATP酶活性均有一定的抑制作用:减缓大肠埃希菌ATP酶活性的恢复速度,抑制金黄色葡萄球菌的ATP酶活性恢复,使其一直处于较低的酶活性。
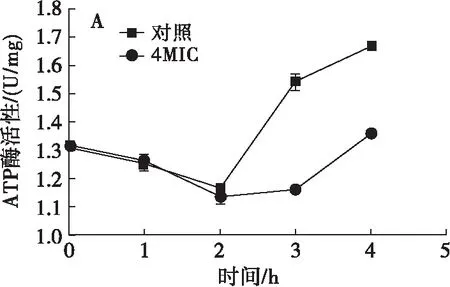
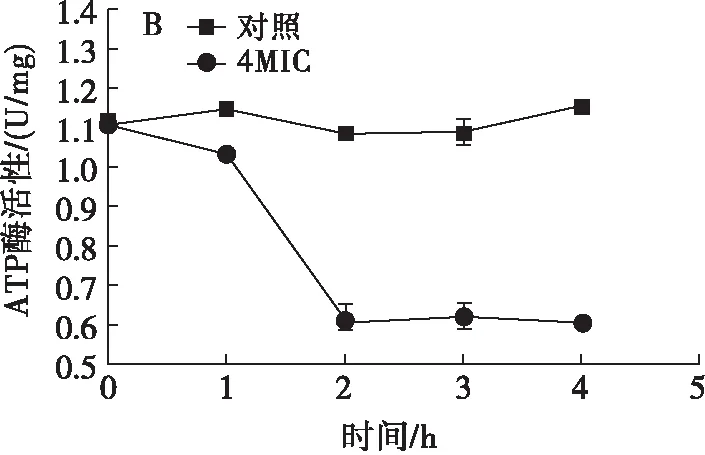
图7 鸸鹋油对大肠埃希菌(A)、金黄色葡萄球菌(B)ATP酶活性的影响
2.10 鸸鹋油对供试菌β-半乳糖苷酶表达活性的影响(见图8)
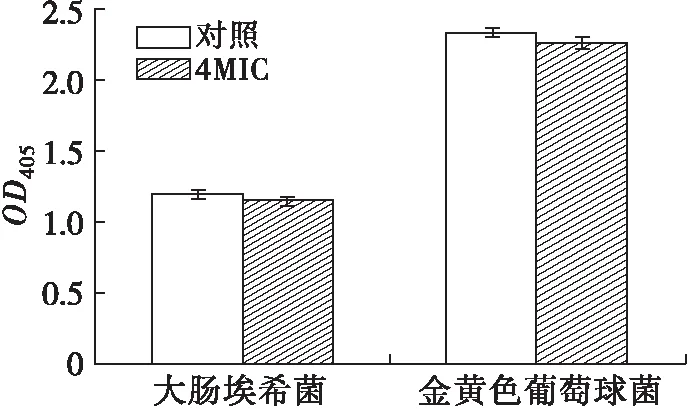
图8 鸸鹋油对供试菌β-半乳糖苷酶表达活性的影响
微生物来源的β-半乳糖苷酶有胞外酶和胞内酶两种[28],本实验测定的为胞内酶。如图8所示,鸸鹋油使得两种供试菌的β-半乳糖苷酶表达活性降低,但是抑制效果不显著。鸸鹋油不能显著抑制两种供试菌的β-半乳糖苷酶活性,表明其对供试菌的细胞膜基本没有影响,同2.3相对应。
2.11 鸸鹋油对供试菌碱性磷酸酶表达活性的影响(见图9)
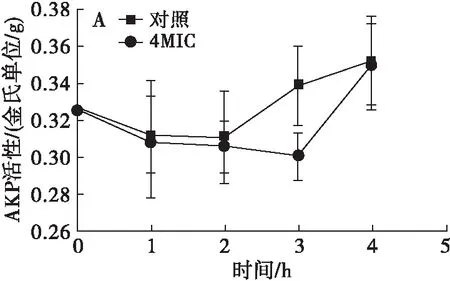
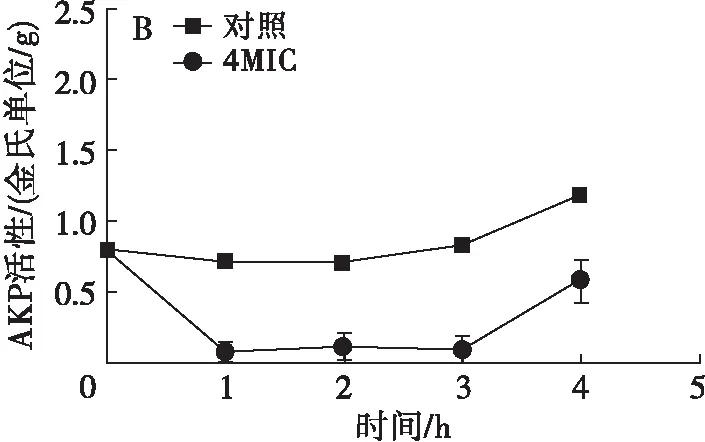
图9 鸸鹋油对大肠埃希菌(A)、金黄色葡萄球菌(B)碱性磷酸酶表达活性的影响
碱性磷酸酶(AKP)存在于细胞壁与细胞膜之间,正常情况下胞外检测不到其活性[29],本实验通过破碎菌体细胞来检测AKP活性。如图9所示:鸸鹋油对大肠埃希菌和金黄色葡萄球菌的AKP活性均有一定抑制作用,在作用后的3 h内,抑制了AKP活性,对金黄色葡萄球菌的抑制更为显著;3 h后,鸸鹋油对大肠埃希菌的AKP活性基本不再有影响,相比对照组,鸸鹋油对金黄色葡萄球菌的AKP活性仍有一定抑制效果,但是AKP活性已逐渐恢复。
3 结 论
鸸鹋油对大肠埃希菌和金黄色葡萄球菌具有较好的抑制作用。大肠埃希菌对鸸鹋油较为敏感,最小抑菌浓度为0.006 25%,金黄色葡萄球菌为0.012 5%。鸸鹋油主要通过影响供试菌细胞表面特性抑制细菌的生长,减弱细菌表面电荷负荷性,提高细菌表面疏水性,也通过影响ATP酶活性改变细菌新陈代谢速率。鸸鹋油基本不影响大肠埃希菌的蛋白合成能力、DNA合成能力、β-半乳糖苷酶及AKP活性,但是能够降低金黄色葡萄球菌的相应大分子合成能力和β-半乳糖苷酶、AKP活性。该研究可以为鸸鹋油抗菌各基础指标研究奠定基础,也可以为鸸鹋油食物抗菌剂的开发研究提供新的思路与途径。
