男性代谢综合征伴睡眠呼吸暂停患者血清代谢指标及脂肪因子变化
2020-01-16周斌蒋晓真陈蕊华奚峰秦玉兰
周斌 蒋晓真 陈蕊华 奚峰 秦玉兰
上海市浦东新区人民医院1内分泌科,2呼吸内科(上海201299)
代谢综合征(metabolic syndrome,MetS)是多种导致2型糖尿病和心血管疾病的代谢危险因素在个体内集结的状态。MetS与睡眠呼吸暂停-低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)联系密切,肥胖导致气道脂肪过度堆积和颈部脂肪压迫,可能是导致气道狭窄的重要原因。OSAHS是指每晚7 h睡眠过程中呼吸暂停反复发作30次以上,或者睡眠呼吸暂停低通气指数(AHI)≥5次/h,并伴有嗜睡等临床症状的一类临床综合征,它是多种全身疾病的独立危险因素。由于MetS人群缺乏临床症状,合并OSAHS的患者早期大多不重视鼾症的出现,这类人群处于内分泌与呼吸科的交叉地带,尚未受得临床医生的重视及早期预防。
本研究通过对健康志愿者、MetS伴或不伴OSAHS的男性患者进行临床生化指标、脂肪因子及睡眠呼吸监测的测定和比较,探讨合并OSAHS的MetS男性患者代谢指标及脂肪因子的变化及意义。
1 对象与方法
1.1 研究对象由于OSAHS在男性中发生率更高,且女性的更年期性激素变化可能对体内代谢状况和睡眠呼吸状况产生影响,为了减少偏倚,故本研究入组的均为男性患者。根据中国2型糖尿病防治指南(2013年版)的MetS诊断标准,选取2014年3月至2015年12月在上海市浦东新区人民医院门诊就诊的MetS男性患者99例(年龄),根据睡眠监测(PSG)分为单纯MetS组(Met组,n=31,年龄32~65岁)和MetS合并OSAHS组(OM组,n=68,年龄29~64岁)。并选取既往无COPD病史、行睡眠监测后排除OSAHS的男性健康志愿者39例作为对照组(NC组,年龄30~59岁)。所有患者均签署知情同意书。研究获得上海市浦东新区人民医院伦理委员会批准(图1)。
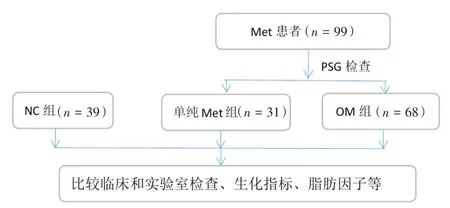
图1 研究流程图Fig.1 Research flow chart
MetS诊断标准:具备以下5项组成成分中的3项及以上或全部者可诊断为MetS:(1)腹型肥胖:腰围男性≥90 cm,女性≥85 cm;(2)高血糖:空腹血糖≥6.1 mmol/L或糖负荷后2 h血糖≥7.8 mmol/L和(或)已确诊为糖尿病并治疗者;(3)高血压:血压≥130/85 mmHg及(或)已确认为高血压并治疗者;(4)空腹 TG≥1.70 mmol/L;(5)空腹 HDL-C<1.04 mmol/L。OSAHS诊断标准根据2011年中华医学会呼吸病学分会睡眠呼吸障碍学组诊断标准[1]:根据病史、体征和睡眠监测结果,临床上有典型的夜间睡眠打鼾伴呼吸暂停、日间嗜睡(epworth sleepiness scale,ESS嗜睡量表评分≥9分)等症状,查体可见上气道任何部位的狭窄及阻塞,AHI≥5次/h;对于日间嗜睡不明显(ESS评分<10分)者,AHI≥ 10次/h或AHI≥ 5次/h,存在认知功能障碍、高血压、冠心病、脑血管疾病、糖尿病、和失眠等1项或1项以上OSAHS合并症可诊断为OSAHS。MetS入组标准:(1)年龄18~ 65岁,男性;(2)符合MetS诊断标准。排除标准:(1)既往已确诊为糖尿病的患者,近3个月曾使用或正在使用降糖药、调脂药;(2)糖尿病急性并发症;(3)血压≥160/100 mmHg者;(4)手术或其他应激情况下的患者;(5)合并严重肝肾功能损害者,合并严重心脑肺,血管疾病患者,合并甲状腺疾病患者,合并各种急性感染性疾病患者;(6)中枢性睡眠呼吸暂停综合征;鼻、口、咽、颈部疾患造成的睡眠呼吸暂停综合征;(7)肢端肥大症;慢性阻塞性肺疾病等。
1.2 一般资料由1名经过专科培训的护士进行病史资料和临床数据采集,收集研究对象的年龄(岁)、体质量(kg)、身高(cm)、体质量指数(BMI,kg/m2)、颈围(cm)、腰围(cm)、臀围、腰臀比(WHR)、血压、病程(年)、吸烟史、酗酒史。计算BMI及WHR。测量收缩压(SBP)、舒张压(DBP)。
1.3 标本采集与处理所有入选对象检查前禁食8~12 h以上,于第2天清晨7~8点肘静脉抽取静脉血,测定患者空腹血糖(FPG)、空腹胰岛素(INS)、糖基化血红蛋白(HbA1c)、血脂[三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆醇(HDLC)、低密度脂蛋白胆固醇(LDL-C)]、肾功能[肌酐(Scr)、尿素(BUN)、尿酸(UA)]。检测方法:FPG(GOD-POD测定法)、HDL-C、LDL-C(均相酶比色法)、TG、TC、Scr(酶试剂测定法)、BUN(urease-GLDH法)、UA(F-DAOS法)(以上测定均使用Cobas 8000 C701 C502全自动生化仪及配套试剂,罗氏公司)。INS(电化学发光法)(Cobas 6000分析仪e601模块化免疫分析系统及配套试剂,罗氏公司)。HbA1c(离子交换高速液体色层分析法)(HLC-723G7糖化分析仪及配套试剂,TOSOH株式会社)。同时另取6 mL静脉血,3 mL放入普管,3 mL放入EDTA抗凝管,行3 000 r/min离心沉淀,分离血清、血浆,置于-70℃冰箱中保存,在抽血后6个月内进行集中测定血清hs-CRP,血浆瘦素(leptin,LEP)、脂联素(adiponetin,ADP)、人摄食抑制因子-1(nesfatin-1,NES-1)、内脏脂肪素(visfatin,VF),使用酶联免疫吸附法(ELISA法)检测(无锡市东林科技发展有限责任公司),期间避免反复冻融。测定步骤及样本含量计算按说明书进行,试剂盒组内差异<10%,组间差异<12%。
1.4 睡眠呼吸监测对所有入组对象行PSG监测,检查前24 h内不能饮酒、喝浓茶及服用安眠药,监测时不吸氧,全夜7~8 h连续测定:口鼻呼吸气流、胸腹呼吸运动、血氧饱和度、体位、鼾声、记录AHI、夜间最低SaO2、ODI。
1.5 统计学方法使用SPSS 19.0统计软件包进行统计分析。计数资料用卡方检验,计量资料经过正态分布检验和方差齐性检验后,数据符合正态分布者以表示,非正态分布数据以中位数(P25,P75)表示,并经对数转换为正态分布进行统计,3组之间比较用One-way ANOVA行组间比较和趋势检验。相关分析采用Pearson相关分析或Spearman相关分析。多因素分析采用二元logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组一般资料比较3组年龄差异无统计学意义(P>0.05);BMI、颈围、腰围、臀围、腰臀比、SBP、DBP差异有统计学意义,NC组明显低于Met组和OM组,且颈围、腰围、腰臀比在3组中呈逐渐升高趋势(P<0.01)。见表1。
表1 3组临床资料比较Tab.1 Comparison of clinical characteristics among three groups ±s
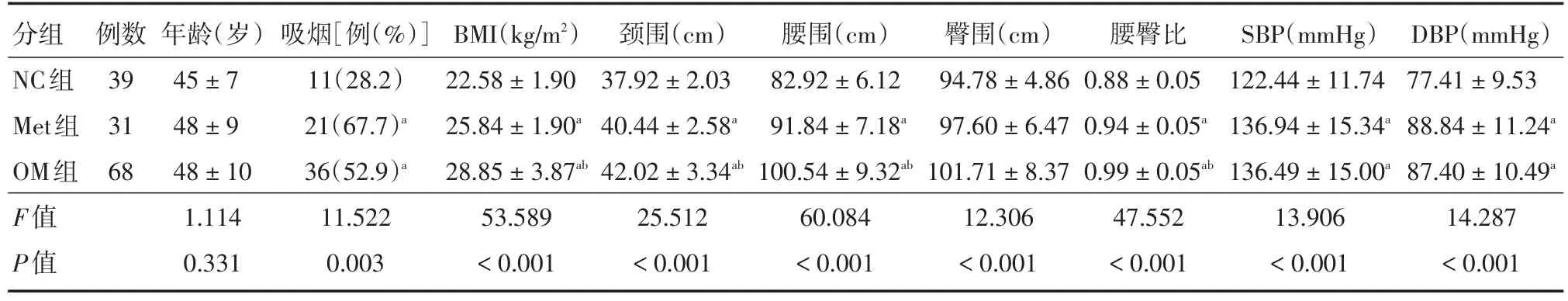
表1 3组临床资料比较Tab.1 Comparison of clinical characteristics among three groups ±s
注:与NC组比较,aP <0.05;与Met组比较,bP <0.05
分组NC组Met组OM组F值P值例数39 31 68年龄(岁)45±7 48±9 48±10 1.114 0.331吸烟[例(%)]11(28.2)21(67.7)a 36(52.9)a 11.522 0.003 BMI(kg/m2)22.58±1.90 25.84±1.90a 28.85±3.87ab 53.589<0.001颈围(cm)37.92±2.03 40.44±2.58a 42.02±3.34ab 25.512<0.001腰围(cm)82.92±6.12 91.84±7.18a 100.54±9.32ab 60.084<0.001臀围(cm)94.78±4.86 97.60±6.47 101.71±8.37 12.306<0.001腰臀比0.88±0.05 0.94±0.05a 0.99±0.05ab 47.552<0.001 SBP(mmHg)122.44±11.74 136.94±15.34a 136.49±15.00a 13.906<0.001 DBP(mmHg)77.41±9.53 88.84±11.24a 87.40±10.49a 14.287<0.001
2.2 3组的生化指标比较3组患者的FPG、FINS、HOMA-IR、HbA1c差异有统计学意义,在NC组、Met组和OM组中呈升高趋势(P<0.05)。OM组的TG和LDL-C显著高于NC组和Met组,而Met组的TG显著高于NC组,HDL-C低于NC组(P<0.05)。3组的肌酐、尿素氮差异有统计学意义,OM组和Met组的尿酸显著高于NC组(P<0.05)。NC、Met和OM3组比较,CRP水平呈升高趋势,且OM组显著高于其他两组;NES-1和和ADP呈下降趋势;VF和LEP呈升高趋势。其中,OM组的NES-1和ADP显著低于其他两组,LEP显著高于其他两组(P<0.05)。睡眠监测显示,OM组的AHI、ODI高于NC组及Met组,最低SaO2显著低于其余两组,差异有统计学意义。见表2。
表2 3组生化指标比较Tab.2 Comparison of biochemical indicators among three groups ±s
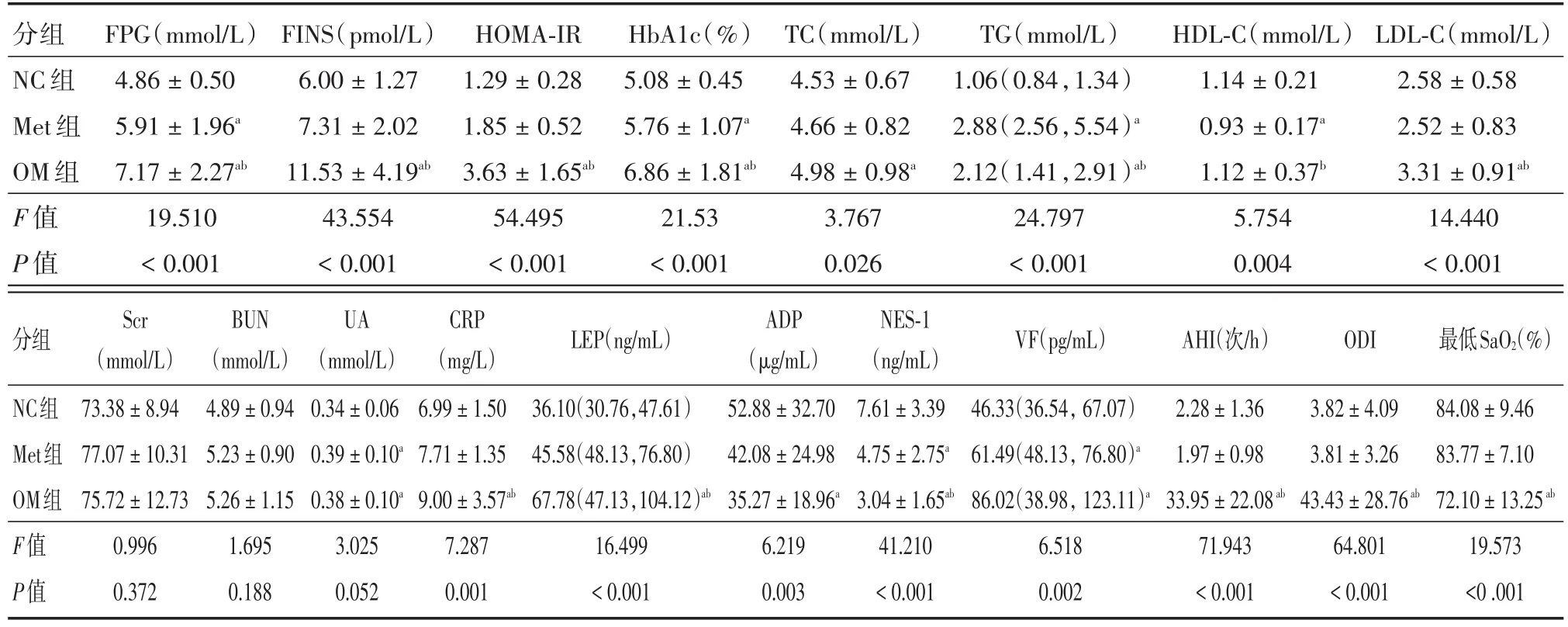
表2 3组生化指标比较Tab.2 Comparison of biochemical indicators among three groups ±s
注:与NC组比较,aP <0.05;与Met组比较,bP <0.05
分组NC组Met组OM组F值P值FPG(mmol/L)4.86±0.50 5.91±1.96a 7.17±2.27ab 19.510<0.001 FINS(pmol/L)6.00±1.27 7.31±2.02 11.53±4.19ab 43.554<0.001 HOMA-IR 1.29±0.28 1.85±0.52 3.63±1.65ab 54.495<0.001 HbA1c(%)5.08±0.45 5.76±1.07a 6.86±1.81ab 21.53<0.001 TC(mmol/L)4.53±0.67 4.66±0.82 4.98±0.98a 3.767 0.026 TG(mmol/L)1.06(0.84,1.34)2.88(2.56,5.54)a 2.12(1.41,2.91)ab 24.797<0.001 HDL-C(mmol/L)1.14±0.21 0.93±0.17a 1.12±0.37b 5.754 0.004 LDL-C(mmol/L)2.58±0.58 2.52±0.83 3.31±0.91ab 14.440<0.001分组LEP(ng/mL)VF(pg/mL)AHI(次/h)ODI 最低SaO2(%)NC组Met组OM组F值P值Scr(mmol/L)73.38±8.94 77.07±10.31 75.72±12.73 0.996 0.372 BUN(mmol/L)4.89±0.94 5.23±0.90 5.26±1.15 1.695 0.188 UA(mmol/L)0.34±0.06 0.39±0.10a 0.38±0.10a 3.025 0.052 CRP(mg/L)6.99±1.50 7.71±1.35 9.00±3.57ab 7.287 0.001 36.10(30.76,47.61)45.58(48.13,76.80)67.78(47.13,104.12)ab 16.499<0.001 ADP(μg/mL)52.88±32.70 42.08±24.98 35.27±18.96a 6.219 0.003 NES-1(ng/mL)7.61±3.39 4.75±2.75a 3.04±1.65ab 41.210<0.001 46.33(36.54,67.07)61.49(48.13,76.80)a 86.02(38.98,123.11)a 6.518 0.002 2.28±1.36 1.97±0.98 33.95±22.08ab 71.943<0.001 3.82±4.09 3.81±3.26 43.43±28.76ab 64.801<0.001 84.08±9.46 83.77±7.10 72.10±13.25ab 19.573<0.001
2.3 BMI与各临床参数的单因素分析138例入组对象中,采用单因素相关分析比较BMI、AHI与其他临床参数的相关性,结果显示,BMI、AHI均与SBP、DBP、臀围、腰围、颈围、FPG、HBA1c、TC、TG、LDL-C、CRP、VF、LEP、ODI、AHI呈正相关,与ADP、NES、最低SaO2呈负相关。见表3。
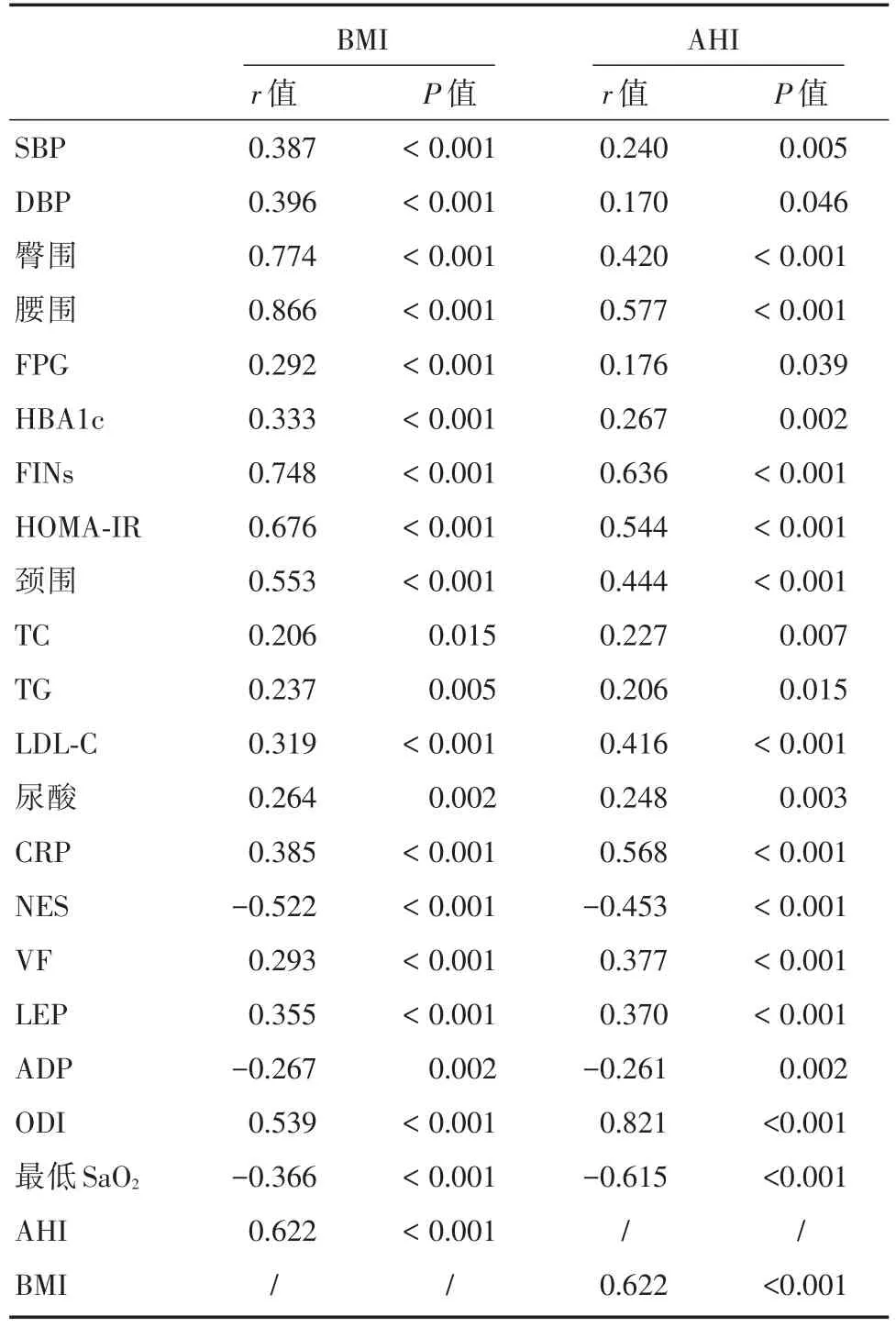
表3 所有研究对象BMI、AHI与各临床参数的相关性分析Tab.3 Associations of BMI and AHI with other clinical characteristics
2.4 MetS患者发生OSAHS的临床影响因素99例男性MetS患者以是否存在OSAHS为因变量,年龄、BMI、颈围、腰围、FPG、FINS、HbA1c、TC、TG、LDL-C、CRP、NES、LEP、ADP为自变量,行二元Logistic向后条件回归分析,结果显示:腰围、FINS、HbA1c、LDL-C升高和NES降低是MetS男性发生OSAHS的独立提示因素(R2=0.744)。见表4。
3 讨论
本研究中,男性MetS患者OM组的颈围、腰围、腰臀比、BMI都显著高于单纯的Met组。虽然血压和Met组无显著差异,但代表糖代谢的FPG和HbA1c及与心血管危险密切相关的LDL-C、空腹胰岛素水平和HOMA-IR均显著高于MetS组,提示了OM组患者的代谢异常情况更严重。

表4 MetS患者发生OSAHS的独立影响因素Tab.4 Independent predictors of the occurrence of OSAHS in subjects of metabolic syndrome
MetS患者大多伴有超重/肥胖,更易发生脂肪代谢的紊乱和脂肪因子的异常。间歇性缺氧(intermittent hypoxia,IH)是OSA的一个标志性特征,IH导致胰岛β细胞功能障碍和肝脏、骨骼肌和脂肪组织的胰岛素抵抗,诱导内脏脂肪组织巨噬细胞向M1-促炎亚型分化,上调和分泌许多促炎性脂肪因子,并影响胰岛素信号通路,加重脂肪组织功能障碍[2]。而脂肪因子的水平异常变化也可能对患者病情的严重程度和预后、疾病的诊断和治疗效果的评价具有一定的提示意义[3]。
LEP主要由白色脂肪组织产生,它在饱腹感,食欲,调节食物摄取中起着重要的作用,并参与能量消耗,生育和动脉粥样硬化的发生发展[4-8]。本研究中,MetS组的LEP水平较NC组无显著升高,而OM组的LEP显著高于其余两组,提示了OSAHS患者更容易发生LEP抵抗和高瘦素血症。有学者[9]认为间歇性缺氧是脂肪组织中LEP表达和释放的有效刺激物。高瘦素血症和LEP抵抗可能上调活性氧的生成,增加氧化应激和促进炎症。
ADP被认为具有改善胰岛素敏感性和对多种细胞具有抗炎和抗凋亡的作用[10-13]。在代谢异常的情况下,ADP会降低[14]。既往关于肥胖伴OSA儿童的研究[15]显示,LEP和ADP水平主要与于中心性肥胖有关,在肥胖的儿童中不受OSA的影响。本研究中,ADP在MetS组中降低的并不明显,但在OM患者中有显著降低,它在OSAHS伴MetS患者中的降低可能与这类患者的肥胖程度和慢性炎症水平更高有关。
NES-1是一种抑制食欲的多肽,是核结合-2肽(NUCB2)基因产物,可表达于中枢神经系统、垂体、胃、胰腺、皮下脂肪组织等[16-17]。动物研究[18]显示,它可通过血脑屏障,在中枢系统直接影响LEP水平,介导LEP抑制食欲的效果。有研究[19]曾探索NSE-1与睡眠之间的联系,并发现它和黑色素浓缩激素蛋白在参与调节快速眼动(REM)睡眠的中枢神经系统区域共表达,并可能缩短REM期。有研究[20]显示:在OSAHS的患者中,MetS组的NES-1较单纯的OSAHS者更低,但目前尚未有在MetS患者中,NES-1水平与OSAHS发病风险的相关性研究。本研究中,MetS的男性NES-1较NC组的更低,而在OM组中,这个值更低,且与是否发生OSAHS独立相关,提示了它不但与脂肪代谢有关,且可能与机体缺氧密切相关。
VF是2005年由FUKUHAM在内脏脂肪组织中发现的一种脂肪细胞因子,具有促进葡萄糖的摄取及甘油三酯的合成等胰岛素样作用。VF可能是通过nampt/visfatin通路激活了沉默信息调节因子(silence information regulator-1,SIRT-1)(也被称为长寿基因),在基因水平改善氧化应激、炎症反应和胰岛β细胞功能[21]。有学者认为,MetS人群的VF的水平较正常人群显著降低;也有学者[22]认为,OSAHS患者VF与对照组无显著差异。而本研究中,VF在Met组和OM组中均显著升高,但回归分析未显示它和OSAHS的独立相关性,提示了它可能是与肥胖有关,但与OSAHS的发生并不独立相关。
总之,本研究结果显示,MetS合并OSAHS的男性患者存在更严重的向心性肥胖、胰岛素抵抗、异常的糖代谢以及更低的NES-1和ADP。NES-1的降低与MetS男性患者发生OSAHS具有密切的关系,MetS男性患者的脂肪因子的水平变化可能对其发生OSAHS具有重要的临床提示意义。
