MicroRNA-29a-3p调控转化生长因子β1诱导的人角膜基质细胞的肌成纤维细胞转化
2020-01-16李凌菡郝朋李轩天津医科大学眼科临床学院天津300070天津市眼科医院天津市眼科研究所天津市眼科学与视觉科学重点实验室天津30000
李凌菡 郝朋 李轩天津医科大学眼科临床学院(天津300070);天津市眼科医院,天津市眼科研究所,天津市眼科学与视觉科学重点实验室(天津30000)
角膜基质是角膜组织的重要组成结构,其厚度约占角膜总厚度的90%[1]。近年来各种角膜区域的手术数量渐增,手术过程中难免发生角膜基质的损伤[2]。所以对角膜基质的损伤反应和愈合机制的研究变得意义非凡。深入研究基质创伤愈合及其机制,尽早开发出预防和治疗基质纤维化的有效方法,有重大的临床意义。
微小RNA29(microRNA-29,miR-29)的靶基因功能广泛,组织细胞的增殖、分化、凋亡等多种生物学过程均与其关系密切。目前,已被证实的miR-29靶基因有40余个[3],其中最主要的是胶原蛋白[4]。胶原蛋白的大量产生造成细胞外基质(extracellular matrix,ECM)沉积会引起组织器官纤维化,而miR-29可直接抑制多种胶原蛋白表达,这提示了其潜在的抗纤维化功能。miR-29又可以分为miR-29a、miR-29b和miR-29c 3种亚型,其中,miR-29b又可以分为miR-29b1和miR-29b2。本研究选用miR-29的亚型为miR-29a。
转化生长因子β(transforming growth factor beta,TGF-β)广泛存在于各种正常及转化细胞中,参与体内许多重要的生理过程,如细胞增殖、迁移、分化、凋亡和细胞外基质生成等;参与几乎所有器官(如肝脏、肺、肾、心脏等)及组织(如角膜、椎间盘、皮肤等)的纤维化过程[5-6]。而TGF-β可分为TGF-β1、TGF-β2和TGF-β3。据已有的研究显示,角膜基质细胞激活转变为肌成纤维细胞后会开始表达平滑肌肌动蛋白α(α-smooth muscle actin,αSMA),故αSMA可作为肌成纤维细胞转化过程中一个可被检测的特异性指标[7]。基于miR-29的抗纤维化潜能以及TGF-β在多种组织细胞纤维化过程中的重要作用,本研究主要探讨miR-29a对TGF-β1体外诱导人角膜基质细胞的肌成纤维细胞转化的抑制作用,以期为临床工作中延缓或是治疗角膜基质纤维化提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞培养本实验采用5代以内人角膜基质细胞(美国science cell)。本研究通过天津医科大学实验伦理委员会批准。
1.1.2 主要试剂及仪器主要试剂:TGF-β1(美国R&D SYSTEMS),胎牛血清(fetal bovine serum,FBS)(美国Gibco公司),培养基FM(美国science cell),培养基DME/F12(美国Hyclone),青链霉素混合液(青霉素10×103U/mL,链霉素10×103μg/mL)(美国Gibco公司),Hsa-miR-29a-3p转染试剂盒及引物套盒(苏州吉玛基因股份有限公司),细胞增殖/毒性检测试剂盒(cell counting kit-8,CCK-8)(日本DOJINDO研究所),2.5 g/L胰蛋白酶(美国Biotopped公司),细胞总RNA提纯试剂盒(北京天根生化科技有限公司),实时定量PCR引物(上海生物工程有限公司),MMLV逆转录酶、Taq DNA聚合酶(美国Promega);SYBR Premix Ex TaqⅠ(日本Takara)。BCA蛋白浓度测试试剂盒(美国Thermo),蛋白marker(美国Biotopped),兔单克隆抗体(美国Proteintech)。主要耗材及仪器:CO2培养箱(德国Heraeus),酶标仪(美国Thermo),实时荧光定量基因扩增仪(美国Appllied Biosystems),Odyssey双色红外激光成像系统(美国LI-COR公司)。
1.2 方法
1.2.1 细胞培养选用5代以内人角膜基质细胞,培养条件:培养基FM+5%FBS混合液。当细胞达60%~70%的细胞单层融合时,DME/F12+1%青链霉素混合液饥饿过夜后转染miR-29a,转染时无FBS和青链霉素混合液,转染24 h后更换新鲜培养基(DME/F12+0%FBS+0%青链霉素混合液)加入5 ng/mL TGF-β1作用48 h。全程细胞培养条件:5%CO2,37℃孵箱。
1.2.2 实验分组根据实验目的,实验分设6组,对照组(Control group)、TGF-β1组(TGF-β1 group)、miR-29a过表达对照+TGF-β1组(AgoNC+TGF-β1 group)、miR-29a过表达+TGF-β1组(Ago29a+TGF-β1 group)、miR-29a抑制表达对照+TGF-β1组(AntNC+TGF-β1 group)及miR-29a抑制表达+TGF-β1组(Ant29a+TGF-β1 group)。
1.2.3 CCK-8试剂盒检测细胞活性在96孔板内按照实验组设计接种人角膜基质细胞,细胞接种密度为1 000~2 000个/孔,24 h后细胞贴壁并基本单层融合,饥饿过夜处理后按实验目的分组,分别处理各组细胞。细胞按实验设计处理完毕后,去除各孔内液体,加入10%CCK-8(CCK-8:10 μL+DME/F12:90 μL),并设置无细胞空白对照。5%CO2,37℃孵箱培养2 h后,使用酶标仪选取波长450 nm,读各孔吸光度(OD)值,各分组均设置复孔3个,重复3次。
1.2.4 实时荧光定量PCR法检测人角膜基质细胞miR-29a及αSMA的mRNA相对表达量在6孔板内按照实验组设计接种人角膜基质细胞,细胞接种密度为500×106个/孔,观察细胞贴壁情况,24 h后细胞基本单层融合,饥饿过夜处理后再按实验设计的分组处理各组细胞。细胞按实验设计处理完毕后,采用细胞总RNA提纯试剂盒提取各组细胞的总RNA,逆转录成cDNA后-20℃保存。采用实时荧光定量基因扩增仪对各组cDNA进行目的基因扩增,其中,相关引物:miR-29a上游引物:CTGCCGTAGCACCATCTGA;下游引物:TATCCTTGTTCACGAACTCCTTCAC;U6上游引物:CTCGCTTCGGCAGCACA;下游引 物 :AACGCTTCACGAATTTGCGT;GAPDH上游引物:TGCCCTCAACGACCACTTTG;下游引物:CTGGTGGTCCAGGGGTCTTA;αSMA 上游引物:AAAGCAAGTCCTCCAGCGTT;下游引物:GCTTCACAGGATTCCCGTCT。反应体系:10 μmol/L的目的基因上下游引物各0.5 μL、无菌去离子水7.8 μL、Rox 0.2 μL、SYBR Green 10 μL及 cDNA 1 μL。扩增程序:95 ℃预变性 3 min,95℃变性12 s,62℃退火延伸40 s,共40个循环。熔解曲线分析条件为:95℃反应15 s,60℃反应1 min,95℃反应15 s,最后4℃冷却降温。各组均设置3个复孔,至少重复3次。结果分别以U6、GAPDH为内参,应用2-ΔΔCt法计算mRNA的相对表达量。
1.2.5 Western Blot法检测αSMA蛋白的相对表达量在6孔板内按照实验组设计接种人角膜基质细胞,细胞接种密度为500×106个/孔,24 h后细胞贴壁并基本单层融合,饥饿过夜处理后按实验目的分组,分别处理各组细胞。细胞按实验设计处理完毕后,去除各孔内液体,提取细胞总蛋白,采用BCA法测定各组样本蛋白浓度。向各组蛋白样本中加入5 μL的5×蛋白上样缓冲液,100℃10 min使蛋白变性。根据测定的蛋白浓度确定各组样本上样量,SDS-PAGE电泳后转膜采用PVDF膜,后续采用Odyssey双色红外激光成像系统曝光,实验至少重复3次。
1.3 统计学方法采用SPSS 23.0以及GraphPad Prism 8.0软件对实验数据进行分析,本研究实验数据以3次独立实验的均值±标准差表示。两组样本间采用单因素方差分析及t检验对实验数据进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 人角膜基质形态人角膜基质细胞呈多角形,树突状,排列规则。
2.2 各组细胞活性比较按实验设计处理细胞后,各组OD值(图1):对照组(0.874±0.050)、TGF-β1组(0.879± 0.200)、miR-29a过表达对照+TGF-β1组(1.068± 0.002)、miR-29a过表达+TGF-β1组(0.931± 0.058)、miR-29a抑制表达对照+TGF-β1组(0.871±0.010)及miR-29a抑制表达+TGF-β1组(0.979±0.006)。且各组间OD值均值差异无统计学意义(P>0.05),提示各组细胞在实验条件处理后细胞活力基本相同。
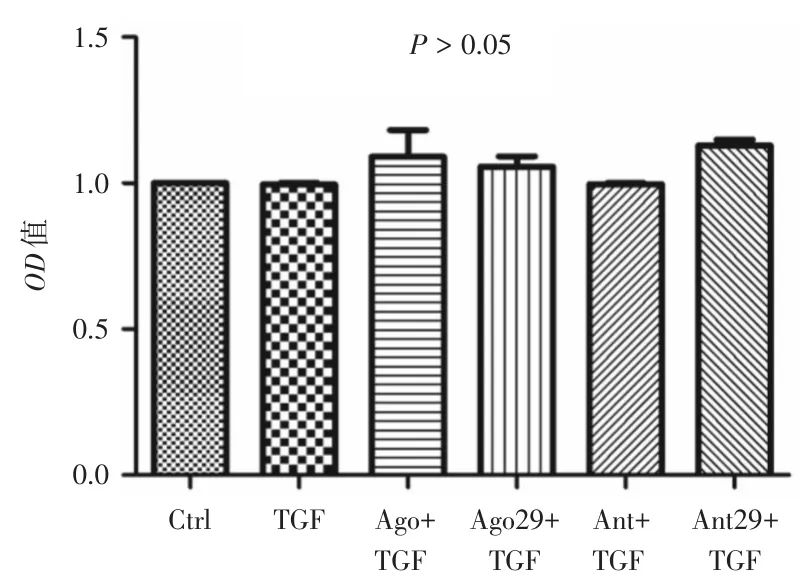
图1 各组细胞CCK-8在波长450 nm处读取的OD值比较Fig.1 Comparison of OD values at wavelength 450 nm read by CCK-8 in each group
2.3 RT-PCR检测miR-29a及αSMA的mRNA在人角膜基质细胞中的表达RT-PCR结果(图2)提示转染效果良好,miR-29a的过表达(P<0.001)和抑制表达(P=0.012)分别与其对照组相比差异有统计学意义。图3为不同实验条件下的各组细胞αSMA的相对表达量,可见与对照组比较,TGF-β1组αSMA mRNA表达显著升高,差异有统计学意义(P<0.001);miR-29a过表达+TGF-β1组与miR-29a过表达对照+TGF-β1组相比,αSMA的相对表达量明显降低,差异有统计学意义(P=0.001);而该指标在miR-29a抑制表达+TGF-β1组与miR-29a抑制表达对照+TGF-β1组的比较中增高且差异有统计学意义(P=0.019)。

图2 各组细胞转染miR-29a后细胞内miR-29a在核酸水平相对表达量Fig.2 Relative expression of intracellular miR-29a at nucleic acid level after miR-29a transfected in each group
2.4 Western Blot法检测αSMA蛋白的相对表达量Western Blot结果(图4)显示,角膜基质细胞中αSMA蛋白的表达水平与mRNA的表达趋势基本一致,对照组、TGF-β1组、miR-29a过表达对照+TGF-β1组、miR-29a过表达+TGF-β1组、miR-29a抑制表达对照+TGF-β1组及miR-29a抑制表达+TGF-β1组αSMA蛋白的相对表达量分别是:(0.012±0.001 1)、(0.026 ± 0.001 1)、(0.027 ± 0.001 8)、(0.018±0.000 8)、(0.018 ± 0.001 9)、(0.023 ± 0.001 8)。其中,对照组与TGF-β1组相比αSMA的相对表达量显著升高,差异有统计学意义(P<0.001);miR-29a过表达+TGF-β1组与miR-29a过表达对照+TGF-β1组相比,αSMA的相对表达量明显降低,差异有统计学意义(P=0.007);而该指标在miR-29a抑制表达+TGF-β1组与miR-29a抑制表达对照+TGF-β1组的比较中增高且差异有统计学意义(P=0.034)。
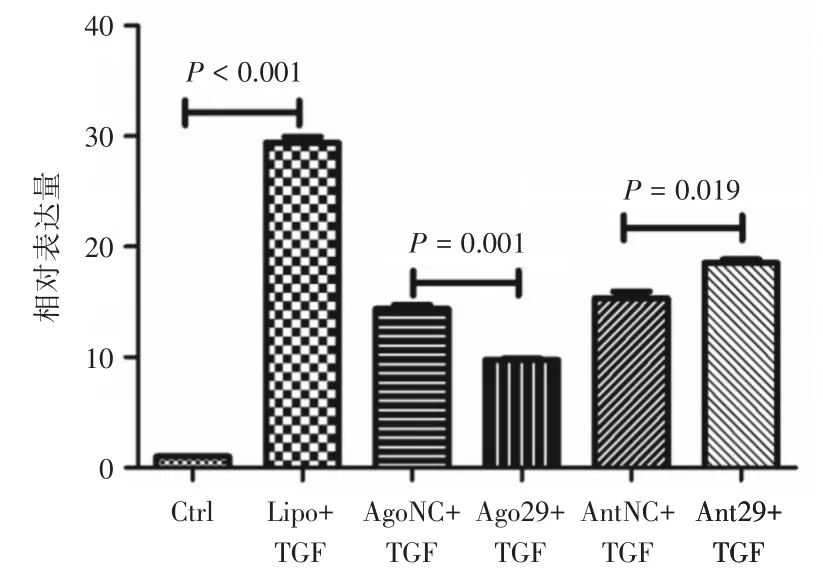
图3 各组细胞内αSMA mRNA的相对表达量Fig.3 Relative expression of αSMA mRNA in each group
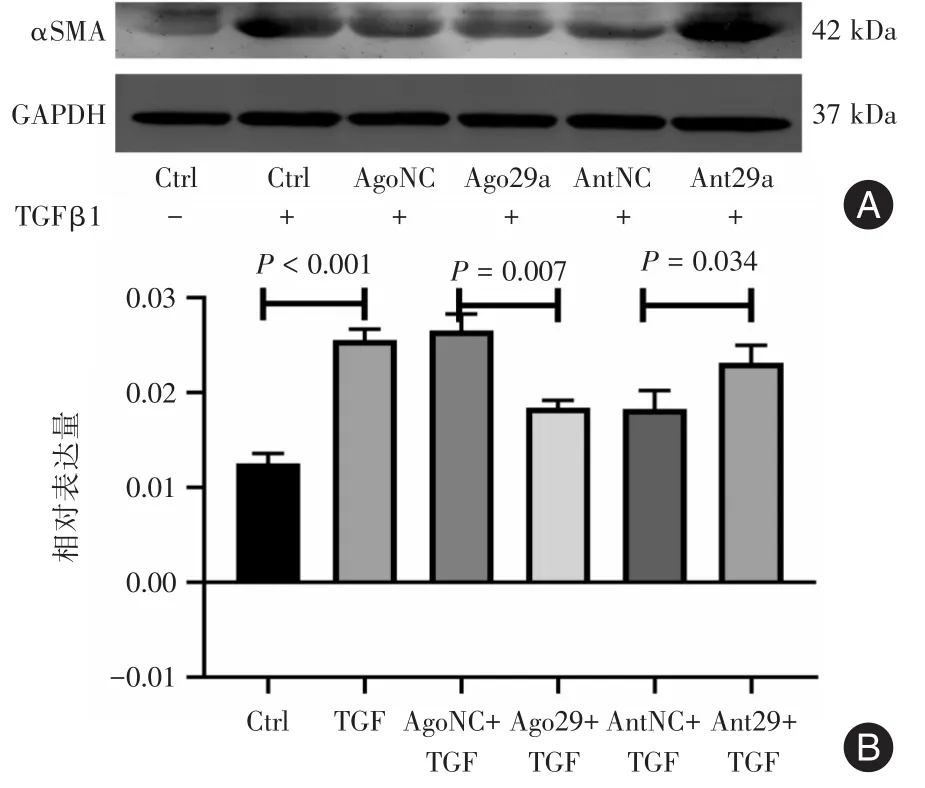
图4 Western Blot图像及量化结果Fig.4 The image and quantification results of Western Blot
3 讨论
现有的研究[8-11]结果表明,角膜基质细胞在受到损伤刺激之后会被激活,由静止状态向修复表型转变,其属性也将发生改变,成为成纤维细胞,同时获得迁移活性,进而向损伤区域迁移覆盖,再通过肌成纤维细胞转化,促进再生或诱导纤维化,起到修复损伤的作用。
TGF-β1是一种细胞因子,在体外培养时能诱导成纤维细胞转变为肌成纤维细胞从而促进纤维化[12-16]。其中TGF-β1主要是通过诱导ECM产生、抑制ECM的降解来推进整个纤维化的进程。本研究采用TGF-β1体外诱导人角膜基质细胞发生纤维化反应,并通过RT-PCR及Western blot法检测在对照组、TGF-β1组中αSMA在核酸、蛋白水平的相对表达量,结果提示TGF-β1组中αSMA的表达显著升高,且差异有统计学意义。该结果也再次证实了TGF-β1可以用来体外诱导人角膜基质细胞发生肌成纤维细胞转化。
纤维化的发生及发展涉及多种相关调节因子,是一个十分复杂的过程。多方面的研究结果显示,miR-29可以通过阻断TGF-β1/Smad3信号通路来减弱纤维化反应,尤其是在肺纤维化[17]、肝纤维化[18]、肾纤维化[19]以及心梗后心肌组织纤维化[20]。本研究将首次报道miR-29a对TGF-β1体外诱导人角膜基质细胞发生肌成纤维细胞转化的负性作用,结果根据αSMA在核酸、蛋白水平的相对表达量显示,在miR-29a过表达+TGF-β1组与miR-29a过表达对照+TGF-β1组、miR-29a抑制表达+TGF-β1组与miR-29a抑制表达对照+TGF-β1组中,miR-29a的高表达能有效减弱TGF-β1所诱导的纤维化反应,而抑制miR-29a的表达则能增强该反应。
与此同时,本研究还发现在特异性地调控人角膜基质细胞内的miR-29a含量后加入TGF-β1诱导该细胞反生纤维化反应并不会影响细胞的活性,这点可以从本研究中CCK-8的结果得到证实。
综上所述,通过特异性地上调人角膜基质细胞内miR-29a的含量,从而可以达到抑制角膜基质细胞发生肌成纤维细胞转化的作用,或可进而抑制或延缓角膜组织纤维化的发生和发展。本研究开篇有提到现阶段已证实的miR-29靶基因大多是胶原蛋白,本研究后续也将根据miR-29的靶基因预测结果从胶原蛋白的表达方面进行一系列检测以佐证本研究的结果,同时力求在miR-29所涉及的具体调控途径进行更多更深层次的研究。
