超高压诱导食品中微生物失活的研究进展
2020-01-14马亚琴贾蒙成传香王鹏旭
马亚琴,贾蒙,成传香,王鹏旭
(西南大学柑桔研究所,国家柑桔工程技术研究中心,重庆,400712)
随着生活水平的提高,一些最少加工、即食(ready-to- eat,RTE)的新鲜食品越来越受到消费者的青睐。同时,食品安全事故的频发以及传统杀菌工艺的局限性引发了大众对新型食品安全的关心和非热加工技术(如超高压、高压脉冲、紫外辐照、超声波、微波技术等)的期待。在确保食品生产安全的同时满足营养、无添加的高品质食品是当今的消费趋势,非热杀菌技术亦成为食品加工领域的主流研究热点。其中,超高压处理(high pressure processing,HPP) 能通过施加压力(100~1 000 MPa)灭活食品中存在的致病菌及腐败菌,从而延长食品货架期[1]。HPP是一种多靶点杀菌技术,其利用压力改变分子间距,致使微生物细胞形态改变,并破坏生物高分子物质(蛋白质和碳水化合物等)立体结构的非共价键,抑制酶活性和遗传物质复制等,从而引起细胞膜、细胞壁、核糖体等细胞器的功能改变或损失,这些损伤累积最终导致细胞死亡[2]。由于HPP不会使分子的共价键断裂,对食品内部化学变化影响较小;其非热特性亦能较好地保留食品的感官品质和营养成分[3]。基于这一优势,全球已有近400套HPP设备投入到新型食品(有机食品、保健食品)的加工生产,HPP也成为最早商业化的非热杀菌技术[4]。
但在HPP的工业化实施中,仍然存在一些重要的科学和技术难题悬而未决,除了生产中存在的杀菌效果不稳定、间歇处理缺陷和工艺复杂性等问题外,研究人员对超高压加工中微生物(耐压性芽孢以及亚致死菌等)失活机制的有限认知也是制约因素之一[5]。因此,本文综述了HPP技术对食品中微生物的影响,通过阐述HPP致死食品中微生物的内外因子、发生机制以及与其他技术联用增强微生物的致死作用或抑制作用,有助于HPP有效降低食品安全隐患和进一步商业化。
1 HPP技术对食品中微生物的作用效果
食品中众多营养成分是微生物生长繁殖的丰富营养源,因此在HPP加工过程中,微生物灭活对提高其安全性和延长货架期至关重要。表1列出了HPP处理对食品中部分微生物的杀菌效果,除了HPP对干腌火腿切片的杀菌效果不显著外,其余结果表明多数致病菌和腐败微生物在HPP后能显著减少。然而,HPP处理后可诱导部分微生物损伤,使其细胞完整性损失,同时保持一定的生理活性,在特定条件下能自我修复为正常细胞,这种现象被称为微生物的亚致死效应(sublethal effects)[6]。根据HPP处理后微生物的损伤程度,可将其分为3种不同的生理状态,即死亡细胞、正常细胞和亚致死细胞[7]。由于亚致死细胞特性改变,以至于在常规检测中常被低估或忽略,如果在杀菌过程中不对其完全杀灭,将会很大程度上给食品工业带来巨大的经济损失及安全隐患[6],因此有必要对HPP引起微生物失活或亚致死效应的作用条件进行研究,进一步改善其杀菌效果。
2 影响HPP杀菌效果的内外因子
为了研究HPP作用于微生物的效果,需要针对HPP新技术开发出有关其预测模型、动力学参数以及规范化工艺流程的广泛数据库。但此前有关HPP加工食品的大多数动力学信息(kinetics information)比较分散,且研究人员对实验数据的分析通常依赖于线性动力学模型,即假设在等压和等温条件下,微生物数量变化与其浓度成正比。此外,大多数关于HPP诱导微生物失活的研究都集中在压力效应上,而忽略了食品基质、加压媒介及其与容器壁和食品之间热交换的影响[15]。因此研究人员报道了一些与线性模型存在显著偏差的失活曲线,如凸型曲线(失活曲线上存在肩部现象)、凹型曲线(失活曲线上存在拖尾现象)、S型曲线(肩部现象和拖尾现象同时存在)等,并开发出一些非线性失活曲线模型如Weibull模型、Baranyi模型、修正Gompertz模型以及对数逻辑函数,以便更准确地描述HPP在各种食品中的微生物灭活效果[14]。如PELRG等[16]首先将Weibull模型用于模拟微生物的失活曲线,表明微生物的失活曲线上存在肩部现象是由于微生物在失活前存在损伤累积的过程,当其超过了微生物可承受的临界水平,就会造成微生物的大量失活;而曲线上存在拖尾现象是因为残留的微生物对压力(或温度)存在了抗性。造成微生物非线性失活曲线现象的原因可能与微生物种类以及各种不同处理参数的差异相关[17]。其他的非线性模型也解释了微生物受到多种致死效应的共同作用,其中压力诱导细胞膜损伤是HPP致死微生物的主导因素,在复杂的加工环境中,微生物失活还受到工艺参数、食品基质、微生物特征等因素的影响,具体如表2所示。

表1 HPP处理对不同食品样品中微生物的影响Table 1 Effects of HPP treatment on microorganisms in different media.

表2 影响HPP灭活微生物的因素Table 2 Factors affecting HPP inactivated microorganisms
2.1 工艺参数
2.1.1 压力
微生物在HPP下的失活同时受到多种因素影响,其中压力是致死微生物的主要因素,压力可能导致细胞膜中脂质从凝胶向水合物的晶体结构改变,从而降低膜流动性;当高压破坏细胞膜结构时,微生物对营养的吸收受到影响,细胞内积累的废物清除受阻,正常代谢途径被破坏[14]。因此,低压水平(20~180 MPa)通常导致细胞亚致死性损伤;高压(200~400 MPa)会使微生物细胞内蛋白质或酶发生不可逆变性,胞内物质泄漏,最终导致微生物失活[18];ATES等[19]在35 ℃用400 MPa的压力处理李斯特菌(L.monocytogenes)5 min后,其数量从5 lgCFU/mL降低到检测限以下(<1 lgCFU/mL),但在4℃贮藏6周后,其数量上升至2.00~3.2 lg CFU/mL;当压力升高至685 MPa时,李斯特菌在贮藏期间未被检出。EVERT-ARRIAGADA等[12]也报道了随着压力的降低,李斯特菌数量能够在贮藏期间迅速提升,说明低压引起的应激能够诱导亚致死细胞修复系统表达,使微生物在逐渐修复为正常状态,或者对压力适应,对食品造成了潜在危害(如图1所示)[3]。因此应用HPP对食品杀菌时,适当地提升压力可有效提升微生物的致死率,但压力过高则会对食品感官品质造成不利影响,同时需要将耗能问题考虑在内。
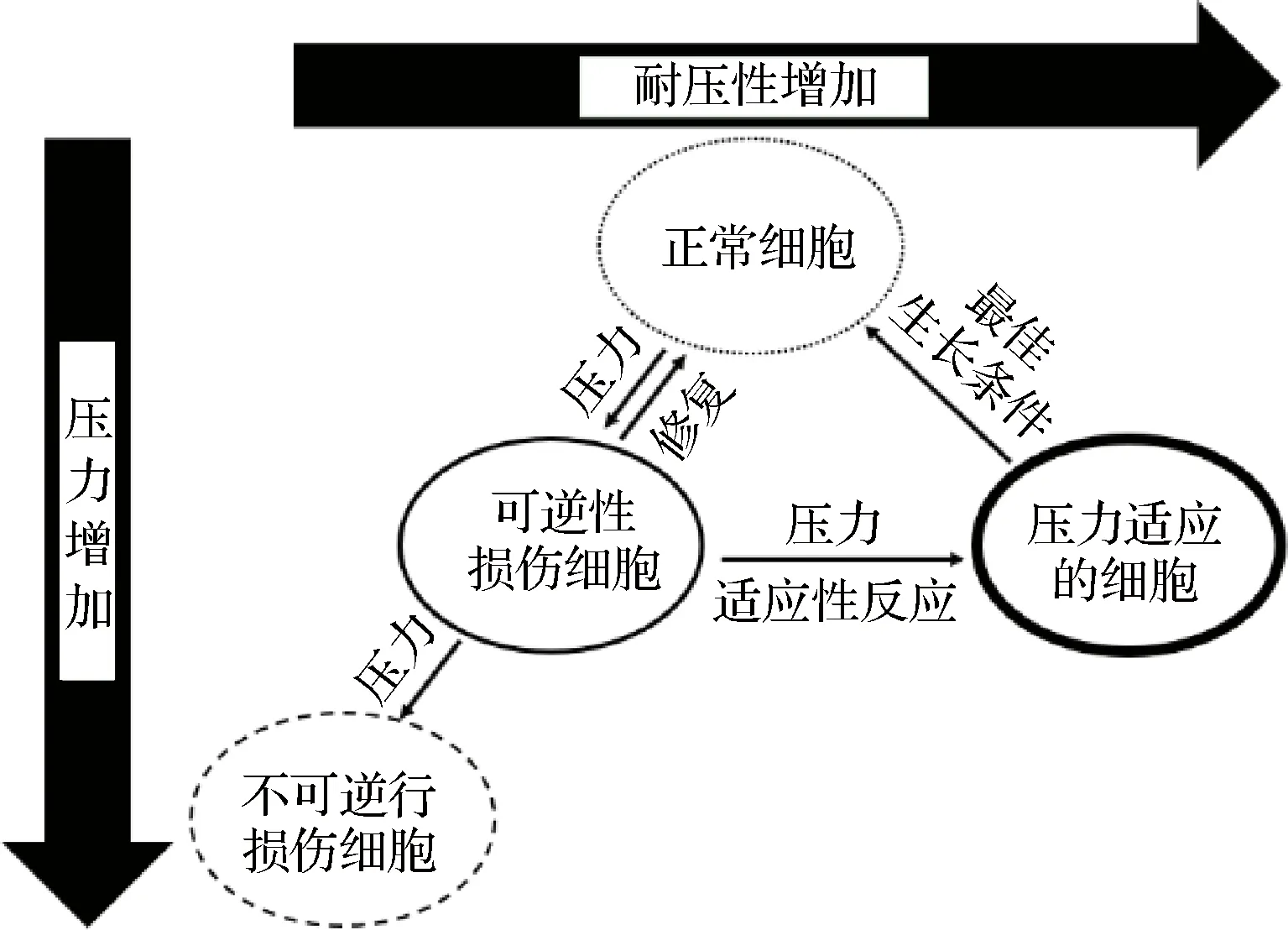
图1 微生物在压力下的损伤、修复和抵抗反应[3]Fig.1 Microbial damage, repair and resistance under stress
2.1.2 温度
温度是影响HPP致死微生物效果的另一重要因素,其对微生物生长代谢和存活与否有着重要的影响。在常温条件下,随着温度升高,HPP能明显提高微生物的致死率;胡友栋[20]选用不同温度梯度(20~60℃)在相同压力下(400 MPa)处理胡柚汁10 min后,发现温度上升导致了菌落总数下降了3.00~4.20 lg CFU/g;酵母菌和霉菌下降了2.60~4.10 lg CFU/g,致死率明显提升。ATES等[19]发现提高压力/温度(20~50℃)能够提高亚致死菌比率。这可能是因为较低温度导致了可逆的细胞渗透,使其耐盐性丧失而发生损伤。此外,低温条件(≤0℃)也有助于提升HPP的杀菌效果,因为低温联合压力处理能使微生物细胞内冰晶析出,细胞膜结构被破坏,蛋白质更容易发生变性[21]。总之,在温度协同压力条件下,增加温度可使压力所导致可逆的细胞膜损伤或结构损伤转换为不可逆的蛋白质变性或代谢损伤,最终导致微生物死亡[22]。
2.1.3 保压时间
压力条件相同时,延长保压时间对微生物致死率也有一定程度的提高。这是因为微生物细胞体积随着保压时间的增加而逐渐减小,水和溶液(如Ca2+和Mg2+)向细胞外扩散,从而对微生物的生理过程产生重要影响,最终导致细胞内物质发生不可逆的渗漏,造成微生物死亡[23]。孙兆远等[24]采用不同保压时间的HPP条件(400 MPa,30℃)对鲜切莲藕杀菌,发现HPP能在5~10 min迅速杀死绝大部分微生物,当保压时间>15 min,菌落总数下降速度明显减缓;同样,孙新生[25]应用HPP对低温火腿杀菌时也发了这一现象。因此,在杀菌过程中具体的保压时间设定可能基于各种内外因素而异,而微生物只有在最初施加压力的一段时间内才能大幅度减少,过长的施压时间会导致部分微生物通过应激反应来适应压力[26]。为此,加压方式也被考虑作为一种影响杀菌效果的因素。
2.1.4 加压方式
HPP根据其加压方式可分为连续性加压和间歇性加压2种方式。间歇性加压又称为循环压力或脉冲压力,即在一个循环过程中,通过快速、反复地施加压力并释放压力,使微生物在多次循环压力下更容易发生亚致死损伤,且这种损伤在循环压力下不断加大,最终导致微生物死亡[3]。因此相对于延长保压时间(连续性加压),间歇性加压对微生物的致死率更大[27]。WANG等[11]发现同样HPP条件(300 MPa,0 ℃,5 min)下,连续压力对大肠杆菌的破坏作用更大,但产生了大量亚致死细胞,而2次循环压力的累积有效增加了大肠杆菌的致死效果。此外,HPP在诱导芽孢萌发的过程中,芽孢会对压力敏感。此时应用循环压力处理芽孢,相比持续加压更有效,因为重复的快速减压会对其造成更高的伤害,灭活萌发的芽孢[28]。但有关循环压力的报道较少,可能是因为循环压力耗能更高,且会缩短设备使用寿命。因此还需要将加压和减压速率等因素考虑在内并对其深入研究,以综合评估HPP应用于食品工业化生产的有效性和适应性。
2.2 食品基质
在复杂的食品基质中,食品的组成成分及其性质对HPP作用于微生物的效果密切相关,因而被认为是提高微生物耐压性和降低灭活程度的重要因素,并会进一步导致亚致死性受损细胞在贮藏期间恢复[29]。NASIOWSKA等[30]发现HPP处理的胡萝卜汁对亚致死性损伤李斯特菌的生长和再生有一定促进作用,而HPP处理的甜菜根汁相对比较安全。此外,由于食品中某些成分对微生物细胞具有保护作用,因此HPP处理缓冲液或培养基中微生物的失活数据并不能直接应用于HPP食品加工中。
2.2.1 食品成分
食物中各种成分,如蛋白质、糖和盐含量在一定程度上可能对微生物起到保护作用,增加它们对压力的抵抗力。高浓度的糖可降低食品水分活度(aw),从而间接为微生物提供压力保护(baroprotection)[17]。脂肪含量对HPP处理微生物的影响仍存在争议。一些研究表明,脂肪含量增加可能导致微生物的耐压性增加[30];而SYED等[31]发现,在0~15 min施加300~800 MPa的压力条件下,较高的(约17%)脂肪含量才能对火腿中李斯特菌细胞产生压力保护作用。因此食品中脂肪含量对HPP致死微生物的影响可能取决于压力强度。在实际HPP杀菌中,食品成分影响可能更为复杂,因此需进一步探明食品成分间的相互作用对HPP下微生物致死效果的影响。
2.2.2 酸碱度
食品酸碱度对微生物耐压性有显著影响。在HPP处理时,微生物在中性食品中最具耐压性,当酸碱度升高或降低时,微生物细胞的耐压性降低[31]。如大肠杆菌O157:H7在酸樱桃汁(pH=3.3)中对压力的敏感性要高于杏汁(pH=3.8)[33]。而李斯特菌在pH为 7.0的食品基质中,能够承受较高的压力水平(高达600 MPa)[34]。然而VERCAMMEN等[35]研究了HPP(100~800 MPa,25、45、75℃)对缓冲液(pH=4.0、5.0、7.0)和番茄酱(pH=4.2、5.0)中凝结芽孢杆菌(B.coagulans)和酸热脂环酸芽孢杆菌(A.acidocaldarius)的影响,发现与酸性食品系统相比,微生物在中性食品系统中的耐压性较低,这可能与芽孢萌发有关,因为在酸性条件下压力诱导的芽孢萌发受到抑制,因此不容易被杀灭。此外,HPP可能通过诱导弱酸电离而降低食品的pH值[23]。因此,考虑到pH在微生物失活中的作用,应开发具有pH探针的HPP设备,以测量压力下食品样品的pH变化[31]。
2.2.3 水分活度(aw)
高aw通常有利于微生物的生长,低aw也会增加微生物对HPP的耐压能力。MARTNEZ-ONANDI等[36]采用HPP(600 MPa,6 min,21℃)处理不同aw的火腿,发现嗜冷菌(Psychrophile)和微球菌(Micrococcaceae)在低aw下有更多的残留,而其他微生物则不受aw的显著影响。同样地,RUBIO等[26]发现低aw(0.79)对李斯特菌有保护作用,使其在400 MPa的压力下不会显著地减少。这可能是因为低aw可维持蛋白质(尤其是酶)的稳定性,从而降低了压力诱导蛋白质变性的可能性。
2.2.4 抗菌剂
食品中添加的一些抗菌剂能增加HPP对微生物的作用效果。DAS等[37]利用添加了山梨酸钾(质量分数0.1%)的印度白虾在HPP条件(350 MPa)下处理20 min后,发现其李斯特菌减少约6个对数周期。ISHIMORI等[38]发现HPP联合轻度热处理并添加氨基酸协同促进了生孢梭菌芽孢生长,并且在热杀菌(80 ℃,10 min)后可以实现5个对数周期以上的芽孢失活。然而也有研究发现一些抗菌剂能够对微生物提供压力保护。BOVER-CID等[39]发现添加了乳酸钾和二乙酸钠(2.0%+0.11%或2.0%+0.45%)的超高压加工火腿在贮藏期间,其李斯特菌增生率比相同浓度有机酸的非加压产品快4倍,说明有机酸的存在使这些细胞能够抵抗压力,并从亚致死性损伤状态恢复为正常细胞,这可能是因为抗菌剂与食品基质相互作用并影响了HPP对微生物的致死率,但其机理尚不清楚,有待深入研究。
2.3 微生物特征
微生物具有较强的环境适应性。利用HPP加工食品时,微生物通过利用多种保护机制,如适应环境、进入休眠状态(芽孢)、激活抗应激基因的调节或产生自适应变异(adaptive mutation)等。因此,微生物的抗压能力并不是固定的,其还与自身种类特征有关,如种类和形态、生长阶段等[31]。
2.3.1 微生物种类和形态
不同种类微生物对压力表现出不同的敏感性。一般情况下,芽孢是最具抗性的;原核微生物对压力的抵抗能力高于真核微生物;革兰氏阳性菌的抗压能力高于革兰氏阴性菌;球菌的抗压能力强于杆菌[40]。酵母菌和一些霉菌是对HPP处理最敏感的微生物,但是革兰氏阳性细菌(芽孢杆菌、李斯特菌和金黄色葡萄球菌等)的细胞壁比革兰氏阴性细菌的细胞壁厚,且可以生成芽孢。芽孢的灭活受到多种内外因素的影响(如图2所示),若仅考虑压力因素,一些芽孢甚至能在1 000 MPa的压力下存活[1]。因此在灭活芽孢时需要根据实际情况综合考虑。
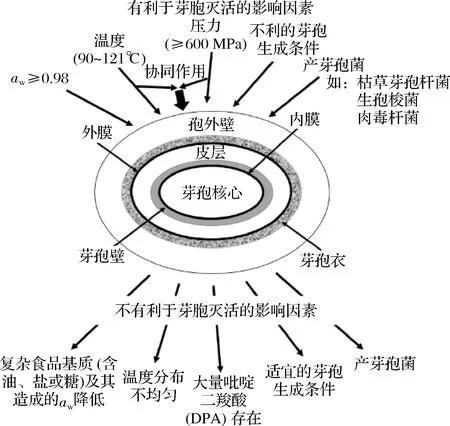
图2 HPP下芽孢失活的非保护性和保护性因素[4]Fig.2 Non protective and protective factors of spore inactivation during high pressure processing
2.3.2 微生物细胞的结构
在HPP条件下,微生物细胞膜被认为是压力导致微生物失活的主要靶点。如果压力不能达到使细胞膜遭受不可逆损伤的水平,则微生物可以在施加压力后使细胞膜恢复完整性;同时,细胞膜的流动性特征也会增加微生物对HPP的抵抗能力[41]。孔晓雪等[42]发现500 MPa的超高压处理引起大肠杆菌O157:H7细胞膜产生显著损伤,而细胞膜上Ca2+、Mg2+流失以及ATP酶失活是导致大肠杆菌O157:H7死亡的主要原因。HPP导致微生物失活的另一个靶点是核糖体,细胞死亡与否和核糖体完整性是密切相关的,因为HPP会导致微生物核糖体中的亚单位解离,抑制微生物细胞的活性[43]。此外,核酸具有极强的耐压性,其结构在高达1 000 MPa的压力下仍能保持完好[44]。目前关于核酸在超高压下处理的文献较少,但不能忽略其重要性。
2.3.3 微生物浓度
微生物失活率与产品中初始微生物数量直接相关。初始微生物数量越高,处理后的存活率也就越高[31]。EVERT-ARRIAGADA等[12]发现李斯特菌在较低和较高的接种水平下,经500 MPa压力后分别降低1.5和2 lgCFU/g;在600 MPa下观察到更好的结果,低和高接种水平分别达到3.9和4.3 lgCFU/g的灭活。而无害李斯特菌CECT 4031是对压力敏感的菌株,与接种水平无关。
2.3.4 生长阶段
微生物的生长周期分为延迟期、指数期、稳定期和衰亡期4个阶段。一般来说,微生物在稳定期比指数期具有更高的抗压能力。这是因为微生物在指数期经历了连续细胞分裂和合成,因此在不利环境中的耐压性较低;而处于稳定期的微生物具有完整的细胞结构,并受到细胞膜的保护,因此具有更高的抗压能力[45]。此外,稳定生长期的微生物细胞会表达一种替代性σ因子(革兰氏阳性细胞的σb因子和革兰氏阴性细胞的σs因子),这些σ因子控制着与抗应激有关的基因转录(如蛋白酶和过氧化氢酶的基因),这些基因可能在HPP下发挥作用[40]。因此,处于稳定期的微生物对HPP杀菌工艺参数的建立具有较可靠的参考价值。
3 HPP与其他技术联用对微生物的致死效果
在HPP中,增加压力通常会增加微生物的致死效果,但需要极高的处理强度,这不仅对食品外观和质地造成了不良影响,还会增加能耗,提高生产成本[41]。此外,芽孢以及高抗性微生物的存在也会影响单独使用HPP技术的杀菌效果[46]。根据跨栏技术的概念,当使用HPP进行食品灭菌时,应考虑将其与影响微生物生长的不利环境条件结合(如低pH值和不适宜微生物生长的温度),通过攻击各种细胞靶点,使细胞修复过程变得更加困难,从而提高其致死率[47]。
HPP联合温度是最常用的处理方法[31],压力(400~600 MPa)与轻度热处理(40 ℃左右)联合可使各种致病性和引起腐败的细菌、酵母菌和霉菌失活;与热处理(>70℃)联合处理能有效灭活芽孢[1]。而HPP结合其他非热技术或添加某些抗菌剂也可以显著提高杀菌效果:PYATKOVSKY等[10]报道了采用HPP和超声联合处理可观察到协同效应;HPP与4%乙酸联合对嗜热链球菌(S.thermophilus)生长有很强的抑制作用,在300 MPa处理10 min或500 MPa处理5 min,即可使其在贮藏期间难以恢复生长[48]。此外,将HPP与机械均质相结合的方法,称为高压均质化(high pressure homogenization,HPH),通常用于在工业水平上灭活液态食品中的各种腐败微生物。与使用高达600 MPa的HPP相比,HPH在100~350 MPa的压力范围内工作,可以在极短的时间(<0.5 s)使用高温(酵母细胞高达50℃,芽孢高达100℃),以实现微生物的有效灭活[49]。表3列出了近年来HPP与其他技术联合的杀菌效果,从表中可以看出,HPP结合不同的处理方法可以弥补单独超高压处理的缺陷,增强其对微生物的致死或抑制作用。
4 结论
HPP是一种有前景的非热处理技术,其在食品的工业化生产中具有较大的应用潜力和优势。在实际加工中,HPP的工艺参数对其杀菌效果至关重要,而食品基质因素和微生物特征在超高压杀菌过程中的影响亦不可忽视。因为只考虑工艺参数的HPP处理可能会产生部分亚致死微生物,其在贮藏期间恢复生长;此外,具有较高耐压性的芽孢会导致所需的压力负荷升高。这对食品安全和品质构成了不良的影响。为了使杀菌效果最大化,应进一步研究其特定因素,如优化HPP工艺参数,了解亚致死微生物的保护机制和恢复条件,以确保其充分灭活。最后,HPP与其他杀菌技术联合能在最小处理强度条件下达到最佳杀菌效果,符合“绿色加工理念”,将有助于该领域的进一步发展。

表3 超高压栅栏技术对不同食品样品中微生物种群的影响Table 3 Combined effects of novel hurdles and high pressure processing on the microbial population in selected media
