利用重组大肠杆菌发酵生产L-茶氨酸
2020-01-14张通龙科艺曹华杰吴思佳元跃陈宁范晓光
张通,龙科艺,曹华杰,吴思佳,元跃,陈宁,3,范晓光,3*
1(天津科技大学 生物工程学院,天津,300457)2(河南巨龙生物工程股份有限公司,河南 汝州,467500) 3(天津市微生物代谢与发酵过程控制技术工程中心,天津,300457)
L-茶氨酸是茶叶中特有的氨基酸,其质量分数占其总游离氨基酸50%以上[1]。L-茶氨酸有许多有益的生理效果,能够促进人脑放松,提高注意力和促进学习能力[2]。 在医疗保健方面,L-茶氨酸具有降低血压、预防血管疾病、缓解压力、保护神经、减肥降脂和提高免疫系统能力等功效[3-9]。在食品方面,L-茶氨酸已被FDA列为安全的食品药品添加剂,用于改良食品品质、增强食品风味[10]。
现有的L-茶氨酸的生产方法主要包括提取法、化学合成法和酶催化法。提取法是最天然的L-茶氨酸生产方法,但由于干茶叶中L-茶氨酸的质量分数仅占1%~2%,导致从茶叶或茶叶废渣中提取L-茶氨酸提取量少、产品纯度低,不能满足大规模生产需求[11]。化学合成法是目前茶氨酸生产的主要途径,是利用酯型或乙酰化的L-谷氨酸和乙胺作为底物,通过控制反应过程和反应条件使L-谷氨酸和乙胺结合形成L-茶氨酸[12],但由于合成产物易存在对映异构体,导致分离困难、产品收率低。近来使用酶催化法生产L-茶氨酸引起了很多学者的关注,目前主要有4种不同的细菌来源的酶可作为理想的生物催化剂并显示出不同的潜力。这4种细菌来源的酶,包括L-谷氨酰胺合成酶(L-glutamine synthetase, GS)[13],γ-谷氨酰甲基酰胺合成酶(γ-glutamylmethylamide, GMAS)[14],γ-谷氨酰转肽酶(γ-glutamyltranspeptidase, GGT)[15]和L-谷氨酰胺酶[16]。上述4种细菌酶都被证实了有较高的催化L-茶氨酸合成的活性,但这些已被证实的酶的微生物来源十分有限,且酶催化法合成L-茶氨酸包括产酶菌株的培养和酶促反应两个过程,需要使用价格较高的谷氨酸/谷氨酰胺盐和ATP为原料[17],生产成本与提取法和化学法相比并无优势。
鉴于现有L-茶氨酸生产方法的不足,本研究通过构建重组大肠杆菌高效表达来源于Methylovorusmays的γ-谷氨酰甲基酰胺合成酶,并通过流加前体物乙胺发酵的方式直接发酵合成L-茶氨酸。根据L-茶氨酸的物化性质拟定出合适的分离提取路线,从发酵液中获得了合格的L-茶氨酸成品。整个生产工艺具有较好的经济可行性和工业应用潜力。
1 材料和方法
1.1 材料与试剂
1.1.1 菌株和质粒
实验所需菌株和质粒如表1所示。

表1 菌株和质粒Table 1 Strains and plasmids
1.1.2 培养基
斜面培养基(g/L):葡萄糖 1,蛋白胨 10,牛肉膏 10,酵母粉 5,NaCl 2.5,琼脂 25,pH 7.0;
种子培养基(g/L):葡萄糖 25,酵母提取物 10,蛋白胨 15,NaCl 15,pH 7.2;
发酵培养基(g/L):葡萄糖30,酵母提取物10,蛋白胨15,KH2PO45,MgSO42,pH 7.2。
1.1.3 主要试剂
PCR产物回收及质粒提取试剂盒:北京博大泰克生物基因有限责任公司;L-茶氨酸标品:美国Sigma公司;其他试剂均为国产分析纯。
1.2 目的基因扩增
1.2.1 以DNA为模板的PCR
在PCR仪上根据引物和片段长度分别设定退火温度(约低于理论退火温度5 ℃)和延伸时间。本实验使用Prime STAR酶作为DNA聚合酶,扩增速率约为1 kb/min。PCR反应条件:首先95 ℃预变性5 min,之后进入如下循环:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸合适时间(根据片段长度),完成最后一个循环后,72 ℃继续延伸10 min。其中验证体系进行25个循环,回收体系进行30个循环。扩增PCR反应液体系如表2所示。

表2 扩增PCR反应液体系Table 2 Composition of PCR reaction solution
1.2.2 重叠PCR
以T7-gmas基因整合为例。根据GenBank中E.coliW3110的yghX基因序列、T7启动子和Methylovorusmays的gmas序列,在Primer Premier 5.0中设计引物,分别扩增上游同源臂、下游同源臂和中间整合片段。其中相连片段分别有约20 bp的重叠区域。PCR扩增体系如表3所示。

表3 重叠PCR扩增体系Table 3 Amplification system of overlap PCR
分别回收T7-gmas上、下游同源臂和整合片段PCR产物,以1∶1∶2的摩尔比进行混合作为模板,通过重叠PCR,将上游、下游和中间整合片段3段片段连接起来。
1.3 CRISPR/Cas9基因整合方法
1.3.1 带有拟敲除基因同源臂基因片段的扩增
带有拟敲除基因同源臂片段扩增的方法参见1.2.1以DNA为模板的PCR和1.2.2重叠PCR。PCR扩增完成后切胶回收片段。
1.3.2 整合基因替换拟敲除目的基因
将重叠片段和gRNA质粒共同电转入含有pRedCas9质粒的大肠杆菌细胞感受态中,于32 ℃培养,待长出单菌落,经菌落PCR鉴定筛选出阳性转化子,再消除pGRB和pRedCas9。
1.4L-茶氨酸的发酵生产方法
从-80 ℃冰箱保菌管中刮1环菌种,均匀涂布于活化斜面,37 ℃培养12 h,转接茄形瓶继续培养12 h。取适量无菌水于茄形瓶中,将菌悬液接入种子培养基中,pH值稳定在7.0左右,温度恒定在37 ℃,溶氧在20%~30%,培养6 h。按照15%接种量接入新鲜的发酵培养基,开始发酵,发酵过程中控制pH值稳定在7.0左右,温度维持在37 ℃,溶氧在25%~35%之当培养基中的葡萄糖消耗完之后,流加800 g/L的葡萄糖溶液并维持发酵培养基中的葡萄糖浓度<2 g/L,发酵开始4 h时开始以30 mL/h的速率流加2 mol/L的乙胺溶液至发酵结束。
1.5L-茶氨酸的分离纯化
根据L-茶氨酸的物化性质制定了合理的产品分离提取工艺。具体流程为:微滤去除发酵液中的菌体,微滤膜的孔径为0.1 μm,料液循环体积为0.2 L,过滤流速为0.5~10 L/h;超滤膜除蛋白质和色素,超滤膜截留分子质量600 Da;初步浓缩脱色,使用阳离子交换树脂进行浓缩脱色;药用炭脱色,用量3%(质量分数)的活性炭,温度60 ℃,搅拌混合时长25 min;二次浓缩,使用真空浓缩装置,真空度-0.1 MPa,浓缩至饱和;冷乙醇析晶;重结晶,将结晶用去离子水溶解,然后重复浓缩至冷乙醇析晶的步骤;利用减压烘干设备,烘干成品,成品含水质量分数<5%。测定膜过滤处理前后溶液在600 nm下的吸收值,根据公式(1)即可求得菌体细胞截留率Ycell;测定膜过滤和脱色处理前后溶液在540 nm下的吸收值,根据公式(2)即可求得色素截留率Ypigment;根据考马斯亮蓝显色方法测定可溶性蛋白质含量,根据公式(3)可以求得蛋白截留率Yprotein:
(1)
(2)
(3)
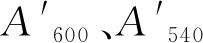
1.6L-茶氨酸的检测方法
发酵液预处理:取1 mL发酵液于1.5 mL EP管中,13 000 r/min离心2 min,取上清液待测。
衍生处理:用移液器取200 μL衍生缓冲液加入到2 mL离心管中,取上述上清液10 μL加入反冲液中,再加入300 μL衍生剂溶液,充分混匀后,将反应液置于65 ℃水浴锅中避光反应1 h,取出加入定容缓冲液定容至1.2 mL,充分摇匀后过0.2 μm膜后进行色谱分析[18]。
高效液相色谱检测:色谱柱为Agilent ZORBAX Eclipse AAA(4.6 mm×150 mm,5-Micron),流动相为乙酸钠缓冲液,50%乙腈,柱温33 ℃,流速1 mL/min,检测波长360 nm,采用二元梯度分析。
2 结果与分析
2.1 在大肠杆菌E. coli origin中单拷贝T7启动子控制的γ-谷氨酰甲胺合成酶基因gmas
以E.coliorigin基因组为模板,根据其yghX基因的上下游序列设计上游同源臂引物UP-yghX-S、UP-yghX-A和下游同源臂引物DN-yghX-S、DN-yghX-A,通过PCR扩增其上下游同源臂片段。根据针对大肠杆菌优化合成的gmas基因序列,设计引物gmas-S、gmas-A,通过PCR扩增gmas基因片段,将启动子T7设计在上游同源臂的下游引物和gmas基因的上游引物中。通过重叠PCR将上述片段整合为“上游同源臂-T7-gmas-下游同源臂”的重叠片段。设计引物gRNA-yghX-S和gRNA-yghX-A扩增包含靶序列的DNA片段,与线性化的pGRB载体重组后获得重组的pGRB-yghX。将整合片段和pGRB-yghX电转化至含有pREDCas9载体的E.coliorigin感受态细胞中,将电转化后复苏培养的菌体涂布于含氨苄青霉素和奇霉素的LB平板上,32 ℃过夜培养后利用PCR验证阳性重组子,再消除用于基因编辑的pGRB-yghX。
图1是T7-gmas整合片段的阳性菌株PCR验证的电泳图。其中,上游同源臂的长度应为648 bp,gmas基因片段长度应为1 415 bp,下游同源臂的长度应为595 bp,整合片段的总长应为2 607 bp,PCR验证时,阳性菌PCR扩增片段长度应为2 607 bp,原菌PCR扩增片段长度应为1 765 bp。电泳图证明该片段整合成功。将单拷贝T7-gmas基因的菌株命名为E.coligmas1。
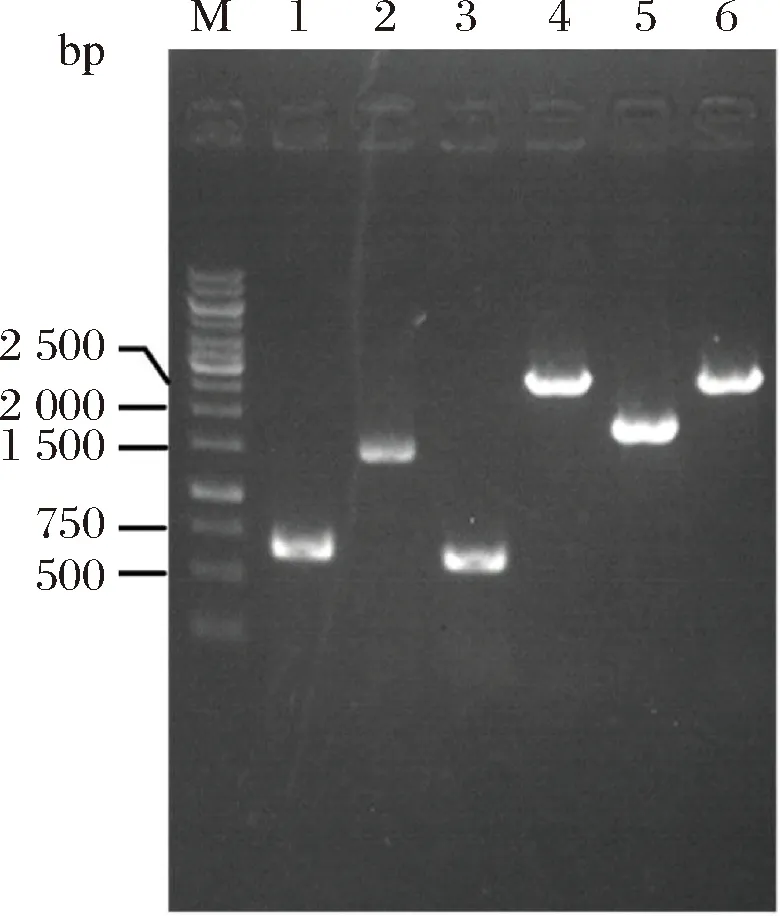
图1 yghX::T7-gmas的PCR验证图Fig.1 PCR verification diagram of yghX::T7-gmas注:M:1kb Marker;1:上游同源臂;2:目的基因;3:下游同源臂;4:重叠片段;5:原菌PCR片段;6:目的菌PCR片段。图2同。
2.2 在大肠杆菌E. coli origin中双拷贝T7启动子控制的γ-谷氨酰甲胺合成酶基因gmas
以E.coliorigin基因组为模板,根据其yeeP基因的上下游序列设计上游同源臂引物UP-yeeP-S、UP-yeeP-A和下游同源臂引物DN-yeeP-S、DN-yeeP-A,通过PCR扩增其上下游同源臂片段。根据针对大肠杆菌优化合成的gmas基因序列,设计引物gmas-S、gmas-A,通过PCR扩增gmas基因片段,将启动子T7设计在上游同源臂的下游引物和gmas基因的上游引物中。通过重叠PCR将上述片段整合为“上游同源臂-T7-gmas-下游同源臂”的重叠片段。设计引物gRNA-yeeP-S和gRNA-yeeP-A扩增包含靶序列的DNA片段,与线性化的pGRB载体重组后获得重组pGRB-yeeP。将整合片段和pGRB-yeeP电转化至含有pREDCas9载体的E.coliorigin感受态细胞中,将电转化后复苏培养的菌体涂布于含氨苄青霉素和奇霉素的LB平板上,32 ℃过夜培养后利用PCR验证阳性重组子,再消除用于基因编辑的pGRB-yeeP。
图2是T7-gmas整合片段的阳性菌株PCR验证的电泳图。其中,上游同源臂的长度应为558 bp,gmas基因片段长度应为1 415 bp,下游同源臂的长度应为547 bp,整合片段的总长度应为2 469 bp。PCR验证时,阳性菌PCR扩增片段长度应为2 469 bp,原菌PCR扩增片段长度应为1 396 bp。电泳图证明该片段整合成功。将双拷贝T7-gmas基因的菌株命名为E.coligmas2。
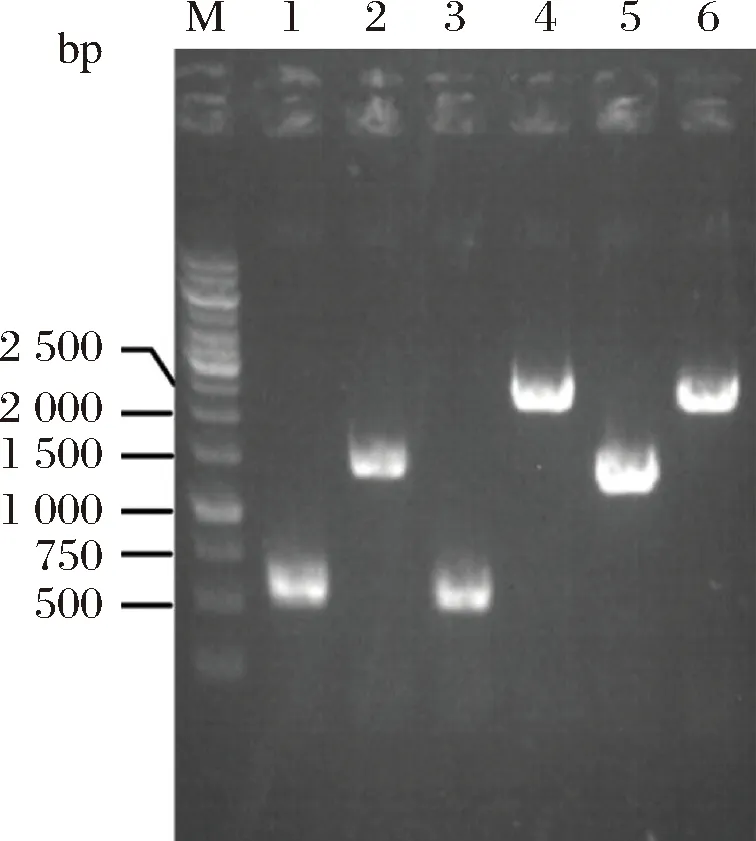
图2 yeeP::T7-gmas的PCR验证图Fig.2 PCR verification diagram of yeeP::T7-gmas
2.3E. coli gmas1和E. coli gmas2的5 L发酵罐发酵结果比较
为对比2株菌生产L-茶氨酸的能力,对单拷贝E.coligmas1和双拷贝E.coligmas2菌株进行了5 L发酵罐发酵实验,由于大肠杆菌能够通过自身代谢产生L-谷氨酸和ATP,因此只需要在发酵过程中外源添加前体物乙胺即可获得L-茶氨酸。结果如图3所示。由图3可知,发酵结束时,E.coligmas2菌株5 L发酵罐发酵L-茶氨酸产量为30.45 g/L,比E.coligmas1提高了22%左右,而菌体浓度E.coligmas2菌株比E.coligmas1降低了11%左右。在耗糖量方面,E.coligmas2菌株的耗糖量为150.97 g/L,而E.coligmas1菌株为124.17 g/L,两者的糖酸转化率均为20%左右。上述结果表明增加γ-谷氨酰甲胺合成酶基因gmas的拷贝数虽然能够提升L-茶氨酸的产量,但对糖酸转化率影响不大,且过多的异源基因表达会加重菌体的生长负担。后期可考虑通过进一步强化葡萄糖到L-谷氨酸的代谢流量来提升糖酸转化率,从而增加葡萄糖的利用率。
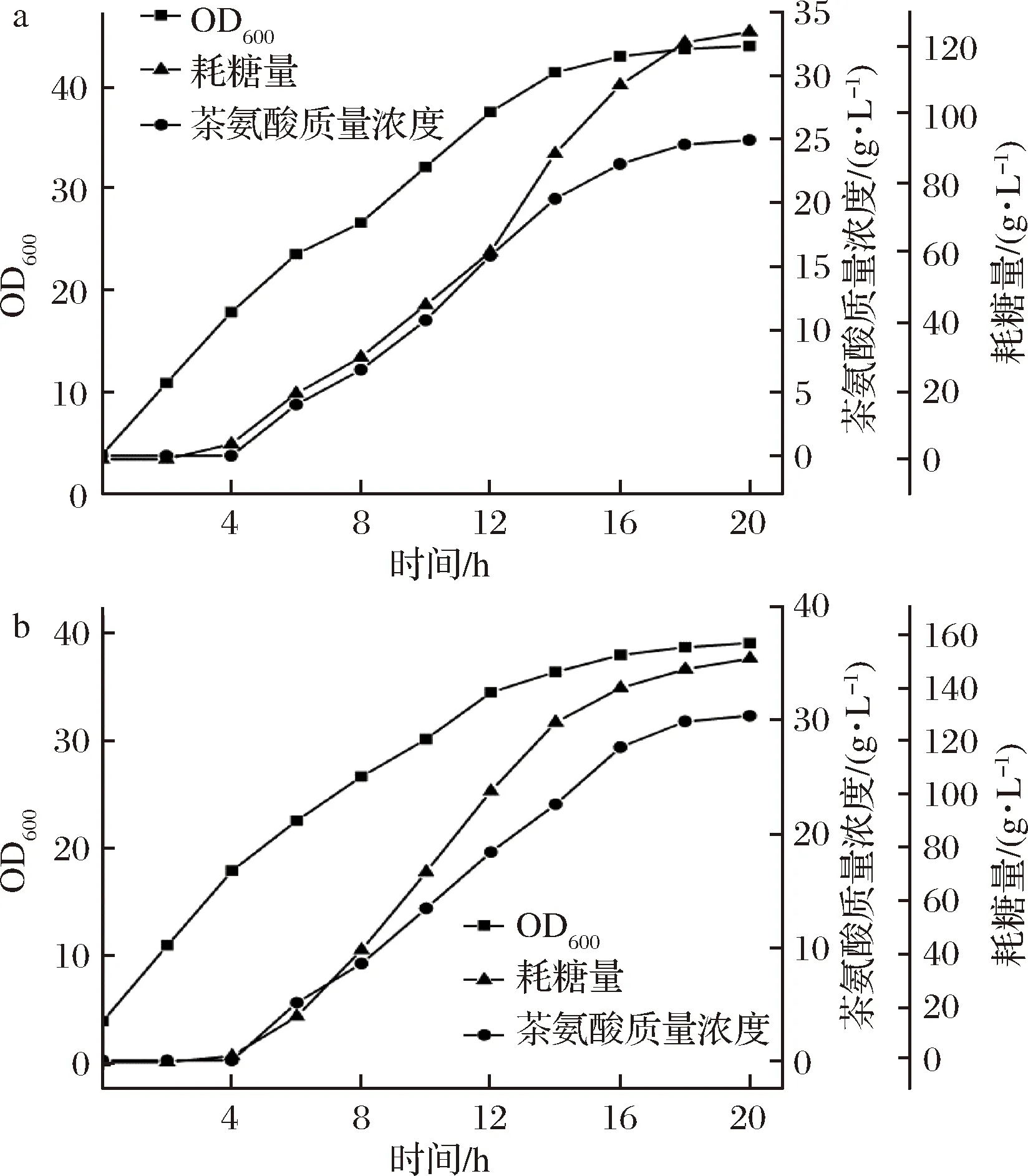
a-E. coli gmas1;b-E. coli gmas2图3 5 L发酵罐中不同重组菌发酵L-茶氨酸的进程曲线Fig.3 Fermentation process curve of L-theanine in 5 L-fermetor by different recombinant strain
2.4 从发酵液中分离提取L-茶氨酸产品
发酵完成后,为了得到L-茶氨酸产品需要对发酵液进行分离提取。与大多数发酵液一样,L-茶氨酸的发酵液中残留有菌体、杂蛋白以及未被利用的培养基等杂质。因此合适的分离提取工艺就显得尤为重要。本实验首先根据L-茶氨酸的理化性质和发酵液的性质制定了如图4所示的分离提取工艺流程。该流程主要将膜过滤,阳离子交换树脂脱色浓缩,活性炭脱色和浓缩结晶四部分单元操作结合起来分离提取L-茶氨酸。
图4 从发酵液中分离提取L-茶氨酸的流程图Fig.4 Flow chart of the L-theanine separation and purification
发酵液成分复杂,黏度较大,固液共存,首先要经过初步处理去除其中的菌体以及可溶性蛋白和色素等大分子物质。常用的去除菌体的方法包括离心法,絮凝法和膜过滤法[19]。微滤膜能有效分离0.1~10 μm的粒子,操作简便,过滤效率高,不会造成产品污染,适合用于L-茶氨酸发酵液的菌体分离;超滤法操作简便,安全性能高,常用于分离分子质量>5 kDa物质,因此更适合用于该单元操作。据此本实验选择微滤膜和超滤膜组合的方式对发酵液中L-茶氨酸进行初步分离提取。
L-茶氨酸发酵液经过膜过滤后有些色素还是无法去除,这将会影响下一步的分离纯化,并导致产品质量变差,所以需要进行进一步脱色处理才能进行后面的操作。目前,常用的脱色方法主要有离子交换树脂脱色和活性炭脱色。离子交换法具有效率高、操作简单、可重复利用等优点,是工业上常用的浓缩和脱色方法之一[20];活性炭脱色具有操作工艺简单、设备投入少以及运行费用低等优点[21],其中药用活性炭具有脱色速度快、吸附能力强、内部孔隙发达、孔隙粗大等特点,能够有效吸附产品溶液中的色素,同时降低其中杂质,不影响产品其他成分浓度[22]。由于L-茶氨酸结构与L-谷氨酸较为接近,因此在乙醇中的溶解度较小,再结晶过程中使用冷乙醇可以增加晶体的析出率。重结晶操作是为了进一步提高产品的纯度,去除析晶过程中包裹的杂质。
为了对比分离提取工艺中各步骤的分离效果,利用1.5中的公式对各步工艺中的细胞截留率Ycell、色素截留率Ypigment、蛋白截留率Yprotein和L-茶氨酸回收率进行了计算,各步工艺分离效果如表4所示。微滤和超滤膜联用能够截留99.5%的细胞和95.5%的可溶性蛋白,但对于色素的截留效果只有71.7%。阳离子交换树脂结合药用炭处理能够截留98.7%的色素,使得产品能够以白色晶体形式析出。整个过程L-茶氨酸提取回收率可达到70.34%,经高效液相色谱检测成品纯度可达到98.51%。
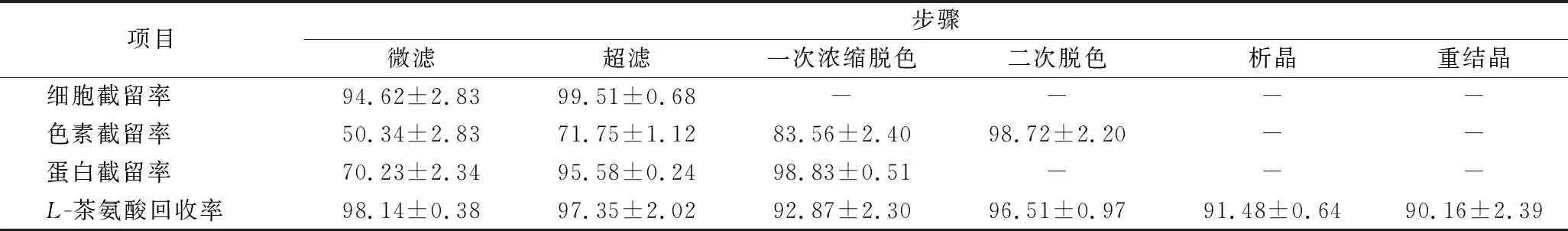
表4 分离提取工艺各步骤分离效果对比 单位:%
注:“-”表示无。
使用核磁共振对烘干后成品进行进一步鉴定,图5为产品的核磁共振氢谱图,其中4.713 ppm处为试剂峰。由图中峰面积和峰数目可知,该产品共含有1个甲基、1个次甲基和3个不同的亚甲基。由峰位移和峰裂分数可知,上述每类基团所处位置,将图上的峰从右至左依次排列顺序,得到位置如图5所示。由偶合常数J可知该产品构型为L型。之后与样品核磁共振氢谱图比对,确认产品为L-茶氨酸。
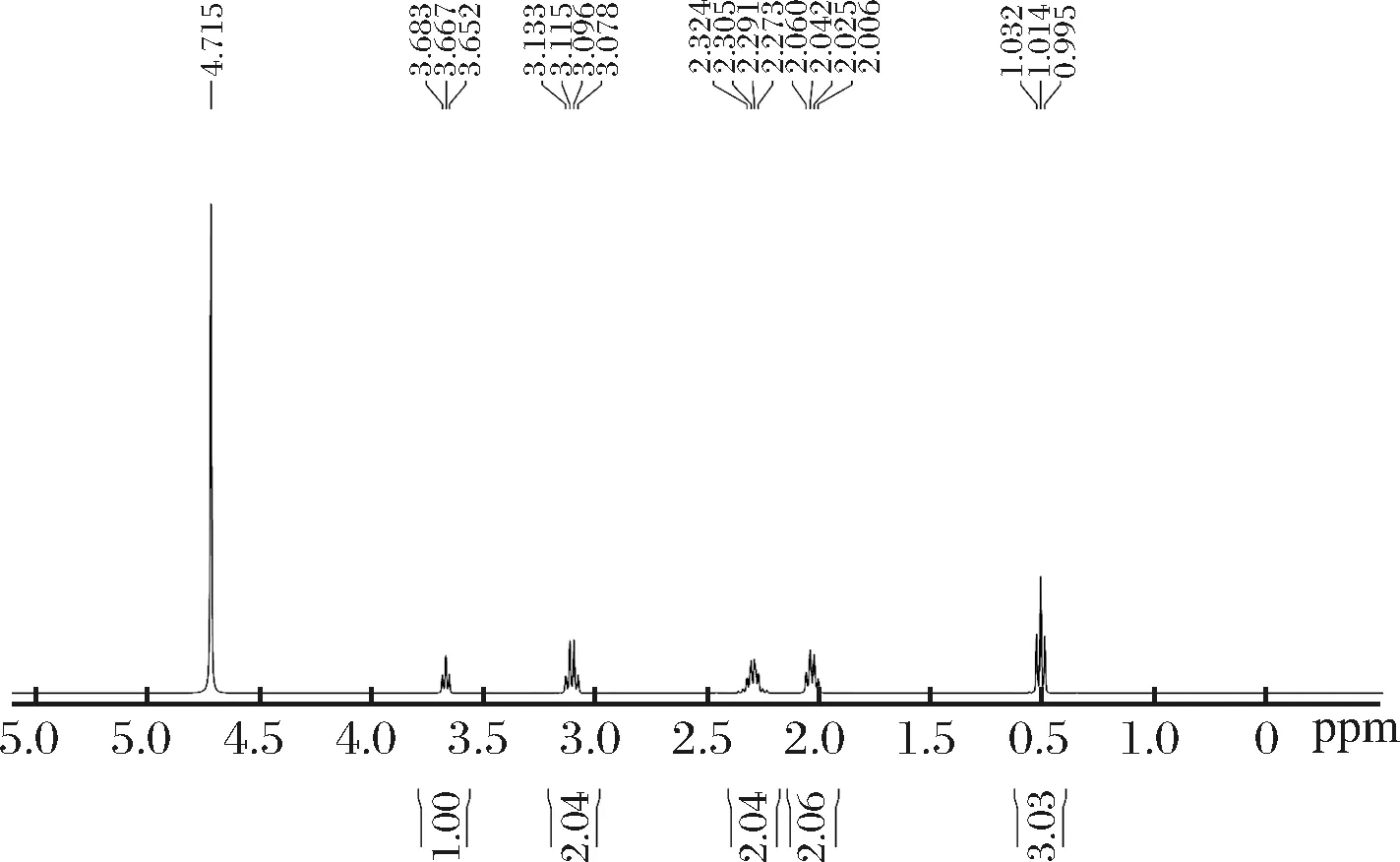
图5 L-茶氨酸产品的氢谱核磁共振图Fig.5 NMR hydrogen spectrum of L-theanine product
3 结论
L-茶氨酸作为一种重要的食品添加剂和药品添加剂,已经广泛应用于食品和医药领域。然而,现有的L-茶氨酸生产方法如提取法、化学合成法和酶催化法存在提取收率低、工艺复杂、生产成本高等不足。本研究通过Crispr/Cas9技术在大肠杆菌染色体上双拷贝来自于Methylovorusmays的γ-谷氨酰甲基酰胺合成酶基因gmas,得到的重组菌E.coligmas2经过20 h乙胺流加发酵,L-茶氨酸产量可以达到30.45 g/L,糖酸转化率可以达到20.17%,与现有的生产方法相比具有原料价格低廉、周期短、操作简便、绿色环保等优点,工业应用价值较高。根据L-茶氨酸的物化性质拟定出合适的分离提取路线,获得了合格的L-茶氨酸产品,整个过程提取回收率可达到70.34%,成品纯度可达到98.51%。本研究证实了使用重组大肠杆菌直接发酵法生产L-茶氨酸是可行的,但是L-茶氨酸发酵水平还有待提高。后期可以针对前体物L-谷氨酸合成涉及的糖酵解途径以及三羧酸循环中的关键代谢节点进行系统改造,进一步增强α-酮戊二酸至L-谷氨酸的代谢流,进而提高L-茶氨酸的产量及转化率。
