河南辛夷SRAP分子标记的引物筛选
2020-01-14李靖靖
王 岚,张 宏,李靖靖*
(1.郑州工程技术学院 化工食品学院,河南 郑州 450044;2.南阳市南召县辛夷产业办公室,河南 南阳 474650)
辛夷是我国传统的名贵中药材之一,其性温、味辛,具有祛风散寒、开穴通窍之功能,在我国已有两千多年的临床应用历史[1]。辛夷的采集主要集中在花蕾部位,对其有性繁殖产生较大影响。目前国内外对辛夷的需求增加,市场前景十分广阔,但缺乏利用分子标记进行遗传多样性的研究,种质资源的多样性受到严峻考验,如何保证辛夷的可持续发展是未来面临的一个重要问题[2]。随着DNA分子标记技术的不断发展和检测技术的日益完善,从DNA水平上对品种的遗传特异性进行快速、准确、不受季节或外环境影响的鉴定成为可能,可为道地品种保护提供理论基础和法律依据。本研究旨在筛选出辛夷序列相关扩增多态性(Sequence-Related Amplified Polymorphism,SRAP)分子标记的引物,为河南辛夷的道地性品牌提供分子学基础。
1 文献综述
辛夷始载于《神农本草经》[3],是我国民间常用的中药材,具有抗炎、抗过敏作用[4]。辛夷在我国已有两千多年的临床应用历史,其性温、味辛,具有祛风散寒、开穴通窍之功能,临床上主要用于抗炎、抗病毒治疗。辛夷多为栽培,少有野生,药用原植物较多,种类多样。辛夷富含芳香类物质,其中挥发油含量高达3%~4%,主要成分为松油二环烯、桉精油等,是轻化行业和食品行业重要的添加剂。此外,辛夷树种根系发达,耐干耐寒,生长迅速、树形及树冠美观,花色鲜艳,也是重要的速生和绿化树种。辛夷是我国传统的出口商品,近些年,国内外对辛夷的需求量日益增加,辛夷价格不断攀升,市场开发前景十分广阔。作为辛夷的原产国,其植株主要分布于河南、湖北、陕西及四川等省。河南省南召县位于伏牛山东段南麓,长江流域汉水上游,是河南省山区林业重点县之一。南召辛夷具有绿色、无污染、道地性好,药用价值高,用途范围广等优点。南召栽培辛夷的历史悠久,《本草纲目》上对南召辛夷曾有详细记载,把南召辛夷列为“本经上品”;《河南省志》第五十八卷记载,辛夷花应用始于元末明初,以南召所产之地最佳;1977 年南召辛夷被《中华人民共和国药典》列为正品,在国际市场上素有“南召辛夷不验货”的嘉誉。2001年3月,原国家林业局和中国经济林协会将南召县作为首批命名的全国唯一“中国辛夷之乡”;2003 年,南召辛夷及其制品获得原国家质检总局原产地保护注册认证。南召县栽培辛夷的历史悠久,为历史上辛夷的原产地,但目前市场品系混乱,真伪难辨,严重影响辛夷药品质量及道地药材的品牌效应[2]。目前,国内外有关以辛夷种质资源为研究对象的报道不多,且辛夷的研究主要集中于化学成分分析、临床应用、栽培技术、品种选育、种属分类等方面[2,5-6],利用分子标记进行遗传多样性研究的报道甚少,仅见郭乐等[7]利用ISSR 标记对野生望春玉兰种质资源遗传多样性进行过比较分析,这对于人工栽培的辛夷种质资源多样性研究和种质鉴定而言,提供的分子水平的理论依据不够充分,也无法为“河南辛夷”道地性品牌的保护提供有力的支撑。
利用DNA 分子标记能科学准确地鉴定植物品种以及种质资源材料的遗传特性,对遗传资源保护和利用、遗传资源评价、种子质量鉴定和道地性品牌权益保护具有重要意义[8]。目前已经建立的DNA分子标记技术有十多种, 但每种方法的复杂性、可靠性均不相同。SRAP分子标记是分析植物材料遗传背景的有力工具,它通过独特的双引物设计对基因的开放式阅读框特定区域进行扩增,因不同个体以及物种的内含子、启动子与间隔区长度不同而产生多态性。赵秀娟等[9]利用SRAP筛选标记研究43份苦瓜的遗传多样性表明:平均每对引物扩增可得到14.15条多态性谱带,多态性位点42.11%。SRAP分子标记具有简便、产率高、可显示大量的共显性标记、易从序列中得到分离的条带等优点,在遗传学和育种学领域具有广泛的应用前景,目前已在国内外广泛应用于各类农作物、中药材等的种质资源多样性研究领域[10]。
2 材料与方法
2.1 实验材料
采取河南省南召县辛夷树种盛花期的花蕾,共34个个体,由河南省南阳市南召县辛夷产业办公室张宏提供 (见表1),采摘后用自封袋封装,-70℃冰箱冻存。
2.2 实验仪器
DP305植物基因组DNA提取试剂盒:天根生化科技(北京)有限公司;NanoDrop 2000C 微量分光光度计:美国NanoDrop 公司;Tanon1600凝胶图像处理系统:上海天能科技有限公司。
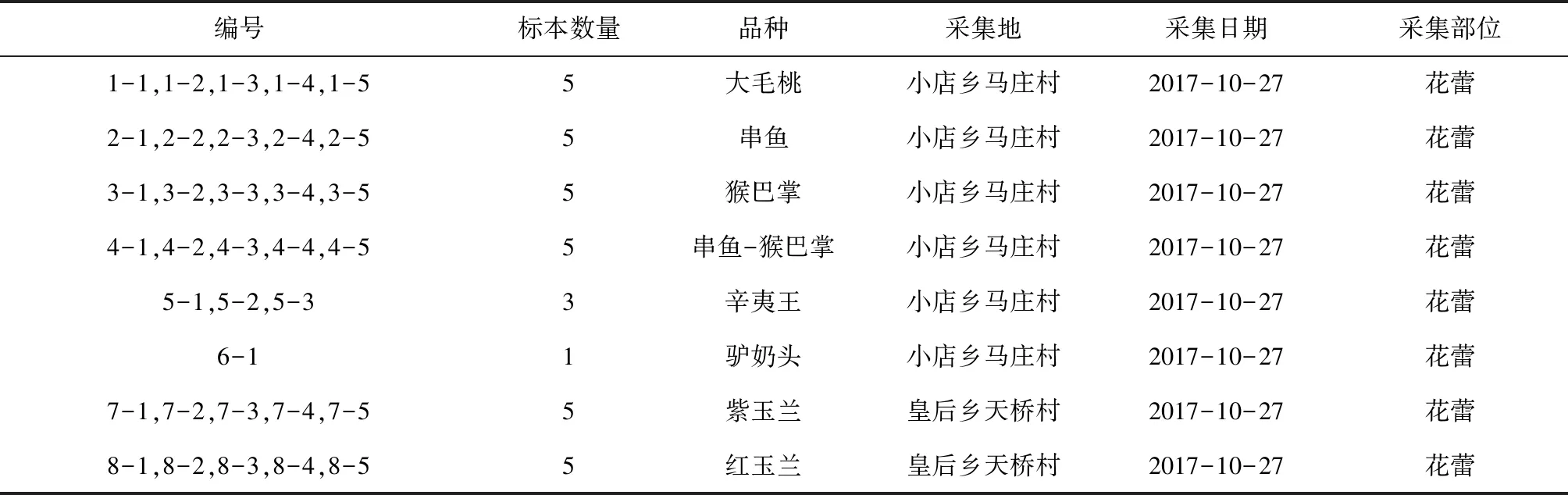
表1 河南辛夷编号及品种名称
2.3 实验方法
2.3.1 DNA提取及检测
每个品种称取70~100mg移入研钵,加入少量石英砂,研磨成细粉末状。将粉末加入2.0mL离心管中,应用植物基因组DNA提取试剂盒(北京天根,DP305),严格按照说明书步骤提取DNA。用微量分光光度计(美国NanoDrop 2000C)测定DNA的OD值及A260/280值,分光光度计测定DNA浓度,-70℃冰箱冻存备测。
2.3.2 SRAP-PCR反应体系及检测
参考2001年由LI和QUIROS[11]创建的SRAP方法,并对扩增体系和程序进行优化。正反向引物由上海捷瑞生物工程有限公司合成(见表2)。通过正反向引物正交实验,组成36对SRAP引物组合,对34个辛夷品种进行初筛。 PCR扩增采用25μL反应体系,其中2.5μL 10×PCR buffer(含MgCl2),1μL 2.5 mmol·L-1dNTPs,正反向引物各1 μL,模板DNA 30ng,Taq DNA 聚合酶 0.2 μL,余双蒸水补齐。扩增程序:94℃ 预变性3 min;94℃ 变性1 min,35℃退火1min,72℃延伸1 min,5个循环;94℃ 变性1 min,50℃退火1 min,72℃延伸5min,35个循环;4℃保存。在含有核酸染料的1.8%琼脂糖凝胶,电极缓冲液为0.5×TBE,110 V电压下对PCR产物进行电泳分离,电泳后用 Tanon1600(上海天能)凝胶图像处理系统对凝胶进行拍照。
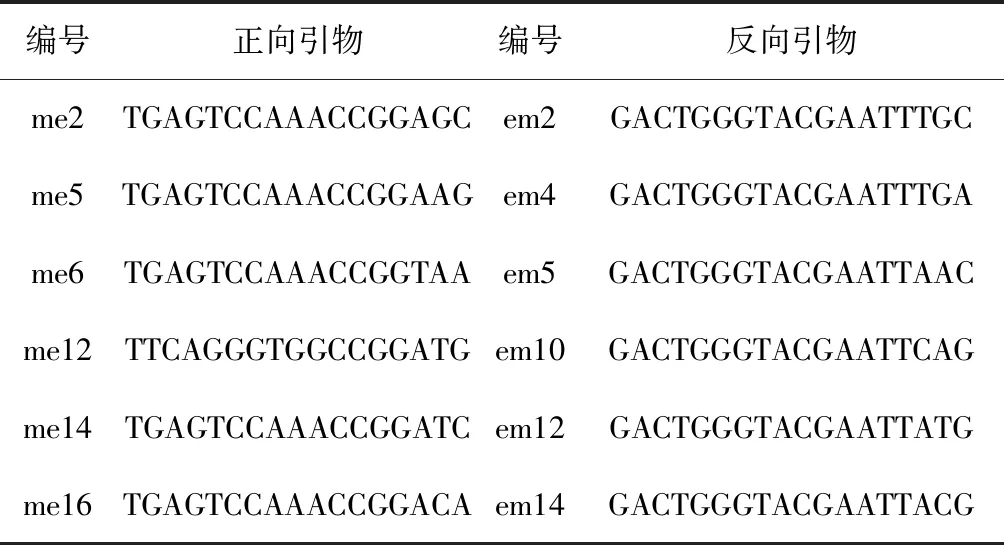
表2 SRAP所用引物序列(5’- 3’)
2.3.3 优化体系的验证
利用优化好的SRAP反应体系,对34个河南辛夷品种进行PCR扩增,分析多态性。
3 结果
3.1 河南辛夷基因组DNA的检测结果
经分光光度计测定,所有样品的DNA A260/280值在1.7~1.9,材料的基因组DNA质量和浓度都较高,满足本试验的要求。
3.2 引物的筛选
3.2.1 初筛
将34个河南辛夷品种的DNA各取1ul,作为混合DNA,对所有的引物组合进行初筛 (图1A),初步筛选出10对引物组合。
3.2.2 复筛
在初筛的基础上,对选出来的10对引物组合用34个辛夷品种进行复筛(图1B),共筛选出8对引物组合 (见表3),满足背景干净、条带清晰、扩增条带丰富的条件,可用于深入的研究。
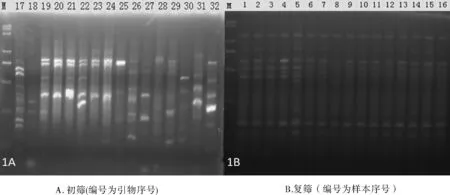
图1 SARP部分引物的初筛和复筛
3.3 河南辛夷多态性分析
应用筛选出的8对引物对34个河南辛夷品种进行PCR扩增,共扩增出107条谱带,83条多态性谱带,其中多态性比例为77.57%。每个引物组合的扩增条带为11~17(表3),DNA扩增产物的大小在100~2000bp。
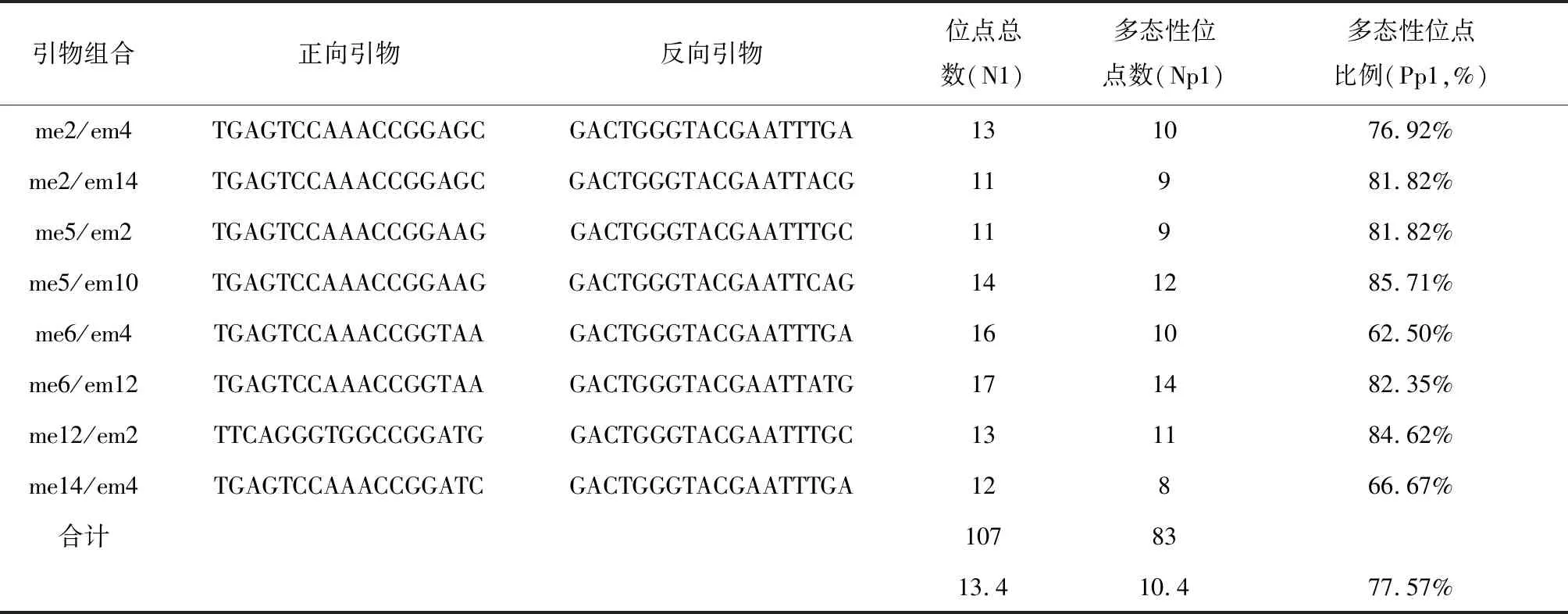
表3 复筛的SRAP引物组合序列(5’- 3’)及扩增结果
4 结论
本研究运用SRAP分子标记对河南省南召县的34个辛夷品种进行了研究,经过初筛和复筛,最终选出8对背景干净、条带清晰、扩增条带丰富的引物组合,并进行辛夷多态性分析,共扩增出107条谱带,83条多态性谱带,其中多态性比例为77.57%,为今后河南辛夷在SRAP分子标记方面的研究提供依据,且能满足对辛夷的多态性分析、聚类分析等。为辛夷品种分类鉴别、种群进化潜力、优质种质资源的保护和选育提供可靠的分子学证据,对从源头保障“河南辛夷” 药材道地性具有重要现实意义,为进一步研究打下基础。
