血清同型半胱氨酸联合降钙素原检测对HBV相关慢加急性肝衰竭患者短期预后的临床价值
2020-01-13谢玲程丰孙文锦龚国富
谢玲 程丰 孙文锦 龚国富
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指在慢性肝病基础上因短期内发生急性肝功能失代偿而导致肝和肝外器官衰竭的一种疾病。由HBV感染引起的ACLF即HBV-ACLF是我国ACLF的主要类型[1]。ACLF进展迅速,预后极差,3个月病死率高达50%以上[2]。因此,早期准确预估患者预后有利于降低ACLF病死率。同型半胱氨酸(Hcy)是一种为甲硫氨酸代谢中间产物的含硫氨基酸,有研究显示,在肝硬化、非酒精性脂肪肝患者中均存在较高水平的Hcy,并且Hcy可作为肝硬化、非酒精性脂肪肝等肝病预后标志物[3-4]。此外,感染是ACLF患者最常见的并发症,作为炎症指标血清降钙素原(PCT)在早期诊断ACLF并发感染中具有重要的临床意义[5]。为此,本研究拟回顾性分析和探讨联合血清Hcy和PCT检测对HBV-ACLF患者短期预后的临床价值,以期为HBV-ACLF短期预后的评估提供更加可靠的指标。
资料与方法
一、资料
(一)一般资料 收集2015年2月—2018年1月期间鄂州市中心医院收治的98例HBV相关ACLF(HBV-ACLF)患者作为研究对象,另选取同时期54例慢性乙型肝炎(CHB)患者和32例健康体检者作为对照。HBV-ACLF的诊断标准参考《肝衰竭诊治指南(2012版)》[6],即在CHB基础上短期内发生急性或亚急性肝功能失代偿的临床症候群,具体表现:①极度乏力,有明显的消化道症状;②黄疸迅速加深,血清胆红素(TBil)大于正常值上限10倍或每日上升≥17.1 μmol/L;③出血倾向,凝血酶原活性(PTA)≤40%或国际标准化比率(INR)≥1.5,并排除其他原因;④失代偿性腹水;⑤伴或不伴有肝性脑病。CHB的诊断标准参考《慢性乙型肝炎防治指南(2015更新版)》[7],具体诊断标准:血清HBsAg和(或)HBV DNA 阳性6个月以上,丙氨酸转氨酶(ALT)持续或反复升高。所有患者入院后经过确诊后均接受相应规范治疗,HBV-ACLF患者经过为期3个月的随访,根据预后分为存活组和死亡组。
(二)纳入标准 ①年龄18~60岁;②符合HBV-ACLF、CHB诊断标准者;③入组前无免疫抑制剂、核苷类似物和(或)干扰素抗病毒治疗史者;④全程自愿配合研究并签署知情同意书者。
(三)排除标准 ①急性肾衰竭或慢性肾衰竭者;②合并其他病毒感染的ACLF者;③其他病因所致的ACLF者,如自身免疫性、药物性、酒精性、遗传代谢性等;④合并其他严重疾病者,如脑水肿、严重感染、肝癌等等;⑤妊娠或哺乳期妇女。
二、方法
收集患者年龄、性别等一般资料。采集所有患者入院24 h内血液,记录和检测患者入院24 h内肝肾功能、凝血功能、血常规及Hcy(Hcy正常值为5 ~15 μmol/L)等各项实验室检测指标;采用免疫比浊法检测患者血清降钙素原(PCT)含量(PCT正常值<0.05 ng/mL)。并采用终末期肝病模型(MELD)评分[8]评估肝病严重程度,MELD评分计算公式:MELD=9.57×In[Cr(mg/dL)]+ 3.78×In[TBil(mg/dL)]+11.2×ln(INR)+6.4×病因(胆汁性或酒精性为0,其他为1)。
三、统计学处理

结 果
一、一般资料比较
各组研究对象临床一般资料如表1所示,3组研究对象年龄、性别比例相互比较无显著性差异(P>0.05)。与健康体检者比较,HBV-ACLF组ALT、TBil、INR和WBC显著提高以及PTA、PLT显著降低(均P<0.05),CHB组ALT显著升高和PTA显著降低(均P<0.05);与CHB组比较,HBV-ACLF组ALT、TBil、INR、WBC和MELD评分显著提高以及PTA、PLT显著降低(均P<0.05)。另外,入院时HBV-ACLF组有32例并发肝硬化、51例并发腹水、2例并发肝性脑病和6例并发肝肾综合征。所有HBV-ACLF组患者从住院开始随访3个月,期间无人失访,51例HBV-ACLF患者死亡,死亡率为52.04%,无人接受肝移植治疗。
二、各组血清Hcy和PCT含量比较
与健康体检者组比较,CHB组和HBV-ACLF组血清Hcy和PCT含量均显著升高(均P<0.05);与CHB组比较,HBV-ACLF组血清Hcy和PCT含量也均显著升高(均P<0.05),如表2所示。
三、影响HBV-ACLF预后的危险因素分析
HBV-ACLF组生存者和死亡者临床基线资料统计如表3所示,与存活组相比,死亡组患者在年龄、性别、HBeAg阳性率、HBV DNA载量、ALT、Cr和WBC等参数无显著性差异(均P>0.05)。但在TBil、INR、PTA、PLT、MELD评分、Hcy和PCT等参数比较上,两组间差异显著(均P<0.05)。对存活组与死亡组间比较有显著性差异的参数进行Cox多因素回归模型分析,结果显示血清Hcy和PCT是影响HBV-ACLF预后的独立危险因素,如表4所示。
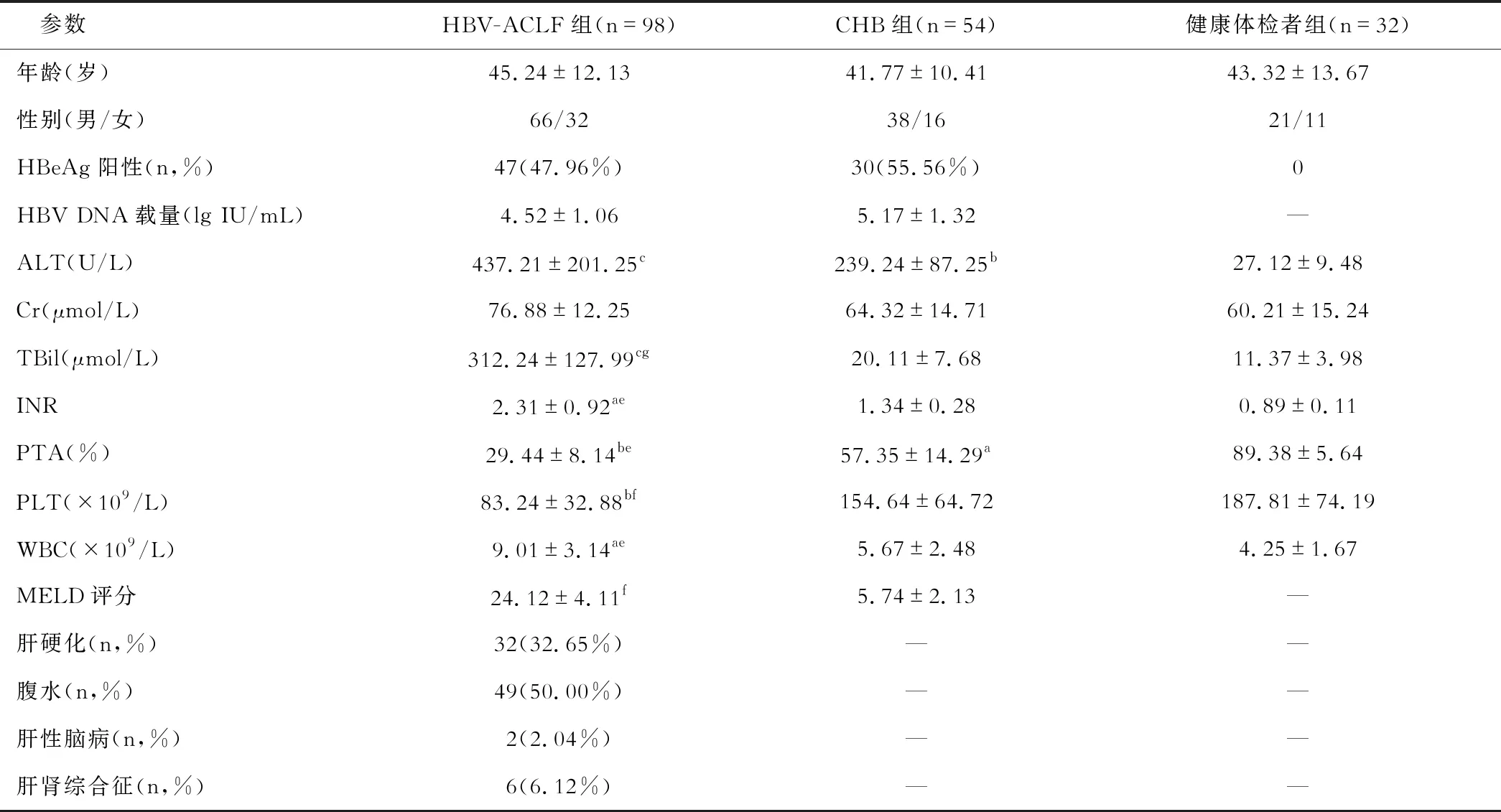
表1 各组临床基线资料分析
注:与健康体检者组比较,aP<0.05,bP<0.01,cP<0.001;与CHB组比较,eP<0.05、fP<0.01、gP<0.001

表2 各组血清Hcy及PCT含量比较(±s)
注:与健康体检者组比较,aP<0.05,bP<0.01,cP<0.001;与CHB组比较,eP<0.05、gP<0.001
四、血清Hcy、PCT联合检测对HBV-ACLF患者预后价值分析
如表5所示,血清Hcy联合PCT预测HBV-ACLF患者3个月病死的ROC曲线下面积(AUC)为0.874(95%CI:0.721~0.944),高于血清Hcy的0.837(95%CI:0.657~0.916)、血清PCT的0.719(95%CI:0.697~0.877)和MELD评分的0.764(95%CI:0.693~0.911)。血清Hcy联合PCT预测HBV-ACLF患者3个月病死的灵敏度和特异度分别为87.36%和82.94%,也均高于血清Hcy的82.24%和77.35%、血清PCT的78.36%和72.25%以及MELD评分的76.26%和79.69%。
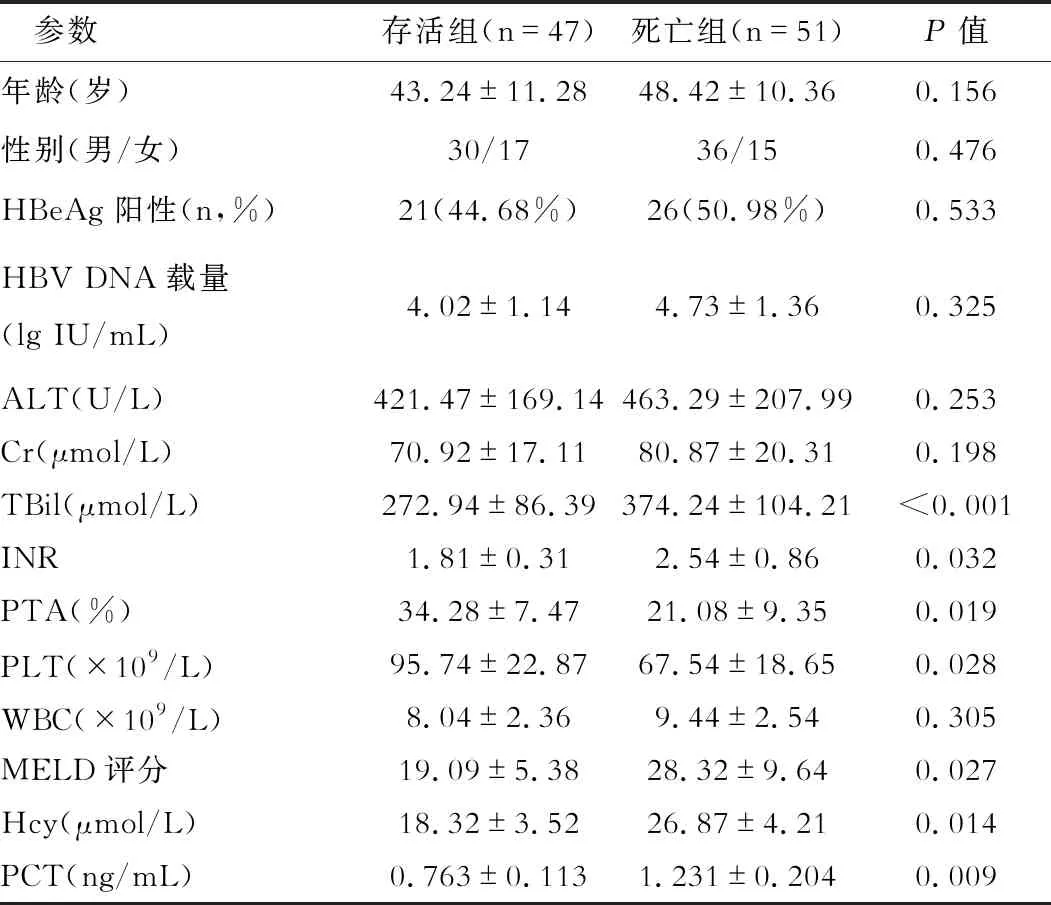
表3 HBV-ACLF生存组和死亡组患者临床基线资料比较
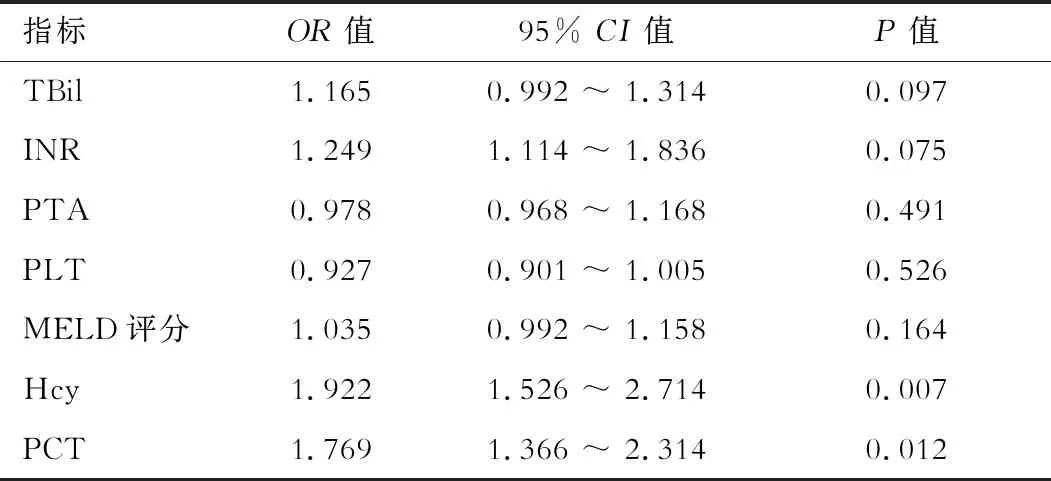
表4 Cox回归模型对HBV-ACLF预后行多因素分析
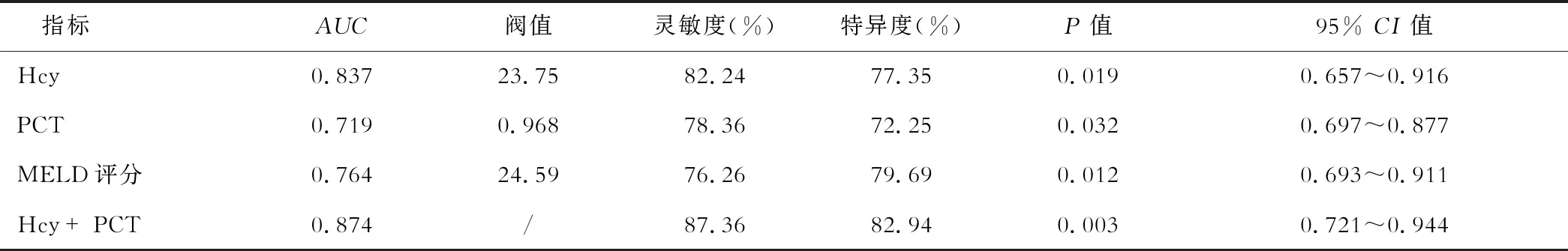
表5 ROC曲线评估Hcy联合PCT检测对HBV-ACLF患者预后价值
讨 论
目前临床上主要通过反映肝功能指标组成的评分系统来判断ACLF预后,如最初的MELD评分,改造升级后的整合MELD(iMELD)评分和MELD联合血清钠(MELD-Na)评分以及CTP评分、SOFA评分系统等等。但随着相关研究的深入,人们极易发现这些临床上常用的评估方法存在一定的局限性或不足。比如,MELD评分系统主要依赖于血清Cr、TBil和INR等指标参数,而临床血清Cr值受年龄、性别、个体肌肉量等因素影响较大,且该评分系统仅对酒精性和药物性相关ACLF预后评估价值较高;此外,CTP评分系统的主观指标较多,且不包含肾功能评价指标,因而不足以严谨的反应疾病严重程度。因此,寻找更加客观、更加可靠的预后指标意义重大。
不断复制的HBV会对宿主肝细胞进行侵蚀,造成肝功能的衰竭,而肝脏恰是体内Hcy代谢和合成的主要场所,其损伤将直接引起Hcy代谢异常。王瑞锋等[9]研究显示,CHB患者血清Hcy水平与患者肝功能指标ALT、AST、TBil等呈正相关性,与CHE呈负相关性,并表明Hcy可视为肝炎进展的危险因素。本研究结果显示,HBV-ACLF组血清Hcy水平显著高于CHB组和健康体检者组(均P<0.05),而CHB组血清Hcy水平又显著高于健康体检者组(P<0.05),说明随着患者肝病严重程度的增加,血清Hcy水平也随之增加,提示血清Hcy水平与肝病有一定的相关性。随后对HBV-ACLF生存组和死亡组患者资料进行多因素回归模型分析,发现血清Hcy是影响HBV-ACLF预后的独立危险因素,提示,血清Hcy水平对HBV-ACLF预后评估可能有一定的临床价值。
众所周知,感染是继肝性脑病之后ACLF患者最常见的并发症,也是HBV- ACLF患者预后的独立危险因素。而PCT是感染性疾病诊断的重要指标,其灵敏度和特异度均明显优于CRP、WBC等其他炎症指标,且在炎症刺激后2~4 h内即可急剧升高[10]。李华[11]对比HBV-ACLF患者死亡组(123例)与生存组(208例)血清PCT水平,发现死亡组PCT水平显著高于生存组。在本研究中,结果显示HBV-ACLF组血清PCT水平同样显著高于CHB组和健康体检者组,HBV-ACLF死亡组PCT水平高于存活组,与上述研究结果一致。进一步Cox多因素回归模型分析显示,血清PCT也是影响HBV-ACLF预后的独立危险因素。梁敏锋等[12]研究显示,血清PCT对HBV-ACLF患者短期预后有评估价值。说明,血清PCT也可能是评估HBV-ACLF预后的一个重要指标。
为了更好评估血清Hcy和PCT对HBV-ACLF预后的临床价值,本研究进一步采用ROC曲线分析,结果表明,Hcy、PCT、MELD评分以及Hcy联合PCT检测对预测HBV-ACLF短期预后均有一定的临床价值,但联合Hcy和PCT检测的预后评估临床价值更高,其AUC值达0.874,特异度为82.94%,灵敏度为87.36%,均优于Hcy、PCT和MELD评分,说明联合Hcy和PCT检测对预测HBV-ACLF短期预后有较高的临床价值。
