超声波辅助木瓜蛋白酶及发酵处理对牦牛肉的理化和质构特性
2020-01-13陈一萌唐善虎李思宁贡佳欣李琦
陈一萌,唐善虎,李思宁,贡佳欣,李琦
(西南民族大学 生命科学与技术学院,四川 成都,610041)
牦牛是生长在高原恶劣环境的特有物种,被誉为“高原之舟”,其肉质鲜美,蛋白质含量高达20%~23%,比普通牛肉高58.7%,脂肪含量普遍低于普通牛肉,为5%左右[1]。牦牛肉中氨基酸总量、必需氨基酸含量优于普通牛肉[2],富含锌、铁、铜、镁、钙、锰等矿物质元素[3],能显著增强人体抗病力、细胞活力和器官功能,是颇受消费者青睐的绿色食品[4]。我国牦牛采用放牧式饲养,肌纤维较粗,导致牦牛肉肉质坚硬,嫩度低,较难咀嚼,口感相对较差[5-6]。这些均表明需要进行嫩化处理。影响肉嫩度的重要因素是肌肉中的肌原纤维和结缔组织。肌原纤维中的肌动蛋白、肌球蛋白及肌动球蛋白均可影响肉品的嫩度,特别是肌球蛋白的pH值、离子强度和某些外源性酶类,如胰蛋白酶和木瓜蛋白酶等对肌动球蛋白的裂解[7]。结缔组织中胶原蛋白的含量、结构、溶解性和分子之间的交联程度对肉的嫩度也有很大的影响[8]。目前常用的嫩化牦牛肉的方法主要有物理嫩化法和化学嫩化法[9-11]。
木瓜蛋白酶能够分解肉中肌原纤维和结缔组织中的蛋白质,将蛋白质降解成小分子的多肽甚至氨基酸,使得肌肉丝断裂,从而达到嫩化的目的[12]。超声波是指频率高于20 kHz的机械波,其空化效应会在组织内部引起强烈反应,造成肌肉内部结构的损坏,同时可引起肉中组织蛋白酶和钙离子的释放,破坏肌肉组织,从而起到嫩化作用[13]。微生物的发酵作用也可以改善肉的嫩度,发酵使原料肉处于酸性环境,肌肉蛋白在酸性条件下变性为胶状组织,改变原有的质构特征,添加益生菌等微生物可分泌蛋白酶,降解肉中的肌浆蛋白和肌原纤维蛋白,从而达到肉质软化的目的[14]。
1 材料与方法
1.1 材料与试剂
牦牛肉,由四川省阿坝州红原县永源肉业提供,健康无病的3岁成年公牦牛的背最长肌,屠宰后于24 h内进行冷却排酸处理后于-20 ℃下急冻,在0~4 ℃下运输至实验室;植物乳杆菌(Lactobacillusplantarum,L.p)、戊糖片球菌(Pediococcuspentosaceus,P.p),中国工业微生物菌种保藏管理中心;MRS肉汤、MRS培养基,杭州微生物试剂有限公司;木瓜蛋白酶(8×105U/g)、考马斯亮蓝R-250、甘氨酸、TEMED,上海源叶生物科技有限公司;牛血清白蛋白,上海如吉生物科技有限公司;NaCl、Na2HPO4、NaH2PO4、KCl,KH2PO4、K2HPO4、EDTA-2Na、MgCl2、NaOH、C4H4KNaO6·4H2O、CuSO4·5H2O、SDS、丙烯酰胺、甲双叉丙烯酰胺、乙醇、冰乙酸,均为分析纯,成都科龙化工试剂厂;Tris、过硫酸铵,北京博奥拓达科技有限公司;5×SDS-PAGE加样缓冲液,上海励瑞生物科技有限公司;蛋白Marker(11~245 kDa),北京索莱宝科技有限公司;食盐、亚硝酸钠、葡萄糖(食用级),成都市武侯区红旗超市。
1.2 仪器与设备
HH-6恒温水浴锅,国华电器有限公司;SB-5200DTDN超声波清洗机,宁波新芝生物科技有限公司;TA-XT Plus质构仪,英国Stable Micro Systems公司;DHP-9162D电热恒温培养箱,上海齐欣科学仪器有限公司;Centrifuge 5804离心机,德国Eppendorf公司;UV1810S紫外分光光度计,上海佑科仪器表有限公司;DYY-2C型电泳仪,北京市六一仪器厂。
1.3 试验方法
1.3.1 原料与处理
将牦牛肉从-20 ℃冰箱中取出至室温解冻,剔除牦牛肉上的筋膜和可见脂肪块后洗去血污,然后切成5 cm×3 cm×3 cm大小,形状规整,厚薄均匀的肉条。切好的肉条置于含3%(质量浓度)食盐、0.005%(质量浓度)亚硝酸钠的腌制液中于4 ℃下腌制12 h。腌制完成后的肉条沥干水分后,分组并称重,便于下一步处理。
1.3.2 不同嫩化处理工艺参数
将腌制好的肉条分成6组,以未经过任何处理的牦牛肉为对照组C,其余5个对照组分别为超声波组T1,木瓜蛋白酶组T2,超声波辅助木瓜蛋白酶组T3,发酵组T4,超声波辅助木瓜蛋白酶+发酵组T5。前期对不同嫩化方法处理牦牛肉的工艺条件进行优化试验,得出各组嫩化处理工艺见表1,T1组牦牛肉用190 W的超声波处理30 min,T2组和T3组的牦牛肉按1∶10(v∶m)的比例注射木瓜蛋白酶溶液,使肉中木瓜蛋白酶浓度达到20 U/g,滚揉15 min后,将T3组的牦牛肉再用190 W超声波超声30 min,T4和T5组的牦牛肉先接种由植物乳杆菌和戊糖片球菌制成的复合发酵剂,接种量为1.0×106CFU/g,在30 ℃下恒温发酵18 h,发酵完成后再对T5组的牦牛肉进行超声波辅助木瓜蛋白酶处理,处理条件与T3组相同。所有处理组和对照组的牦牛肉嫩化完成后进行下一步指标检测。

表1 六组嫩化方法工艺条件Table 1 The tenderization conditions of the six treatment groups
1.3.3 指标测定
“这个——我应该说是这样的,多亏了‘应予扣除额’这一栏下面那十一项保留条款,否则我每年都得当乞丐,去讨钱供奉这个可恨的该死的敲诈勒索的,专制的政府。”
1.3.3.1 可溶性蛋白含量
根据孔令明等[16]的方法并稍作修改。称取4.00 g切碎的肉样,加入40 mL浸提液(100 mmol/L KCl、7 mmol/L KH2PO4、18 mmol/L K2HPO4、1 mmol/L EDTA,1 mmol/L MgCl2,pH 7.0,4 ℃保存),在高速匀浆机中于4 ℃匀浆,10 000 r/min下冷冻离心30 min,收集上清液。用双缩脲法测定上清液中可溶性蛋白含量。
1.3.3.2 肌原纤维小片化指数
将上述离心后的沉淀中加入40 mL浸提液,于10 000 r/min下冷冻离心30 min。沉淀用15 mL浸提液溶解,再用单层纱布过滤,弃去结缔组织和细胞碎片,滤液即为肌原纤维提取液。用双缩脲法测定肌原纤维提取液中蛋白质的浓度,再用浸提液调整肌原纤维提取液蛋白质量浓度至0.5 mg/mL,在540 nm波长处测定吸光度[17]。将吸光值代入公式:肌原纤维小片化指数=A540 nm×200,计算出肌原纤维小片化指数值。
1.3.3.3 双缩脲法测蛋白浓度
参考王兆明[18]的双缩脲法测定蛋白浓度。分别取10 mg/mL的BSA标准液0、0.2、0.4、0.5、0.6、0.8、1.0 mL于7个玻璃试管中,配制0、2、4、5、6、8、10 mg/mL溶液各1 mL,然后加入缩二脲试剂4 mL,在25 ℃下放置60 min,以空白试剂调零,在波长540 nm下,测定各浓度BSA溶液的吸光度值A540 nm。通过Excel数据分析中的回归分析建立直线回归方程y=0.044x+0.002,R2=0.999 7。其中,y为样品在540 nm下的吸光度,x为蛋白浓度。
1.3.3.4 蛋白SDS-PAGE电泳
SDS-PAGE电泳参考LAEMMLI[19]和RAWDKUEN等[20]的方法。将2 g样品置于研钵中,加入20 mL 0.5 mol/L(pH 7.8)的Tris-HCl缓冲液匀浆成稀糊状, 10 000×g离心10 min,将上清液的蛋白质浓度调至1 g/L后,取100 μL与25 μL 5X上样品缓冲液在离心管中混合,10 000 r/min混匀5 min,吸取样品10 μL进行上样。分离胶浓度12%、浓缩胶浓度5%,初始电压为80 V,快跑至分离胶时调至120 V,当溴酚蓝指示带靠近分离胶底部时立即终止操作。取下电泳胶块,染色2 h后脱色至条带清晰,使用Bio-Rad凝胶成像仪拍照,分析蛋白聚集与降解变化。
1.3.3.5 质构
将嫩化处理后的样品分别装入蒸煮袋中密封,于90 ℃水浴锅中加热40 min,取出后用流动水冷却至室温,将样品肉块按相同的纹路切成2 cm×2 cm×2 cm的方块,采用TA-XT Plus质构仪测定样品的硬度、弹性、内聚性和咀嚼性[21]。设置参数:探头为P/0.5 s,测前速度为2 mm/s,测试速度为1 mm/s,测后速度为1 mm/s,下压距离为10 mm,探头2次测定间隔时间5 s,触发类型为自动。
1.4 数据分析
每处理组样本重复3次,使用SPSS V19.0软件进行数据分析,实验数据用平均数±标准差的形式表示;用单因素方差分析检测各处理组之间的差异显著性(P<0.05);采用Duncan法进行平均数之间的多重比较。
2 结果与分析
2.1 不同嫩化处理对牦牛肉可溶性蛋白含量(CSP)的影响
不同嫩化方法对牦牛肉可溶性蛋白含量CSP的影响结果如图1所示。

图1 不同嫩化处理对牦牛肉CSP的影响Fig.1 Effects of different tendering methods on CSP of yak meat注:图中标有不同字母表示差异显著(P<0.05)。下同。
对照组C的CSP为36.42 mg/g,T1~T5的CSP均显著高于对照组(P<0.05)。T1组CSP为40.49 mg/g,超声波的机械作用和空化作用破坏肌肉蛋白中较短的多肽链,同时超声波处理对线粒体、肌质网和溶酶体产生破坏作用,使肌质网释放Ca2+,溶酶体释放组织蛋白酶和钙蛋白酶,肌细胞间Ca2+浓度升高,钙蛋白酶活性增加,其降解肌纤维结构蛋白和肌纤维间连接蛋白的能力增强,同时组织蛋白酶也发挥降解蛋白质的功能,使CSP增加[22]。T2和T3组的CSP分别为55.72和57.26 mg/g,两组间无显著差异(P>0.05),这2组都添加了木瓜蛋白酶,而木瓜蛋白酶含有巯基(—SH),在一定条件下能将肉中肌浆蛋白、肌原纤维蛋白、胶原蛋白和结缔组织等弹性蛋白降解生成其他小分子蛋白[23],而T3组由于超声波同时辅助木瓜蛋白酶作用,故其CSP略高于单独木瓜蛋白酶嫩化组。发酵嫩化组T4的CSP(52.02 mg/g)显著高于T1组,显著低于T2和T3组(P<0.05),发酵产生的蛋白酶或pH值降低能水解肉中肌浆蛋白和肌原纤维蛋白而产生许多低分子量蛋白,使肉中CSP增加;而T5组的牦牛肉经超声、木瓜蛋白酶和发酵共同处理后,其CSP含量(65.25 mg/g)显著高于其他处理组(P<0.05)。
2.2 不同嫩化处理对牦牛肉肌原纤维小片化指数的影响
肌原纤维小片化指数是指长度为1~4个肌节的肌原纤维占所有肌原纤维的比例,肌节中肌联蛋白和伴肌动蛋白的降解可引起MFI的变化,MFI是评价I带被破坏程度和肌纤维间断裂程度的指标,可表征嫩度[24],肌肉的MFI值越大,肌肉嫩度越好,据CULLER报道[25],MFI≥60,非常嫩,MFI在50左右,中等嫩度,远低于50,嫩度缺乏。由图2可知,对照组的MFI为33.93,所有处理组的MFI均显著高于对照组(P<0.05),其值分别为85.73、97.13、110.60、65.07、69.00,说明经不同嫩化处理后,牦牛肉的嫩度得到了较好改善,且各处理组之间MFI值差异显著(P<0.05)。
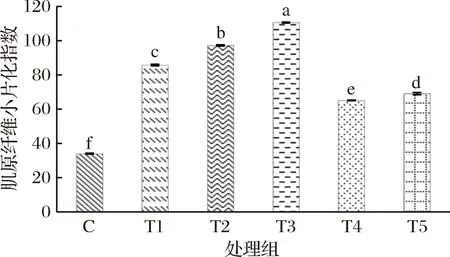
图2 不同嫩化处理对牦牛肉MFI的影响Fig.2 Effects of different tendering methods on MFI of yak meat
T1组中超声波嫩化后牦牛肉的MFI显著增加,超声波具有的强穿透力和空化效应等,可以促使肌原纤维、结缔组织等在短时间内遭到破坏,使肌原纤维破碎断裂成肌节小片,因此小片化程度在短时间内显著增大[26];T2组的MFI值显著高于T1组,因牦牛肉中肌原纤维蛋白可在木瓜蛋白酶的作用下分解,使Z线弱化和降解,导致肌节断裂,肌原纤维横向交联被破坏,从而使肌原纤维出现小片化[27];T3组的MFI值为5个嫩化处理组中最高的,结果表明超声波结合木瓜蛋白酶处理可显著降低牦牛肉的嫩度;T4和T5组的牦牛肉经过发酵后,MFI值显著高于对照组,但低于其他处理组(P<0.05),发酵使MFI值升高主要是因为微生物蛋白酶和内源蛋白酶在作用于肌肉蛋白时,肌原纤维间I带和Z线结合变弱直至断裂,肌原纤维间的连接蛋白降解,肌肉结构遭到破坏,从而大大提高肉的嫩度,表现为MFI增大[28],T5组牦牛肉经超声波辅助木瓜蛋白酶嫩化,其MFI值显著高于T4组(P<0.05)。
2.3 不同嫩化处理的蛋白SDS-PAGE电泳的比较
从图3的蛋白质电泳图谱可知,对照组中最明显的蛋白条带主要集中在分子量135~245、45~48 kDa之间,在48~100 kDa和低于48 kDa分子量处分布数条蛋白条带,10~17 kDa之间有2条比较清晰的条带。由电泳图谱可知,这类蛋白质在不同嫩化处理后均发生不同程度的降解。观察T1的蛋白条带,与对照组的蛋白条带相似,但条带变细、颜色变淡,尤其是蛋白分子量为135~245、100、45~48、20~25和17 kDa的条带变淡变少,14 kDa左右的条带与对照组和其他处理组无明显差异,这说明超声波对牦牛肉的嫩化效果并不完全是由蛋白质的降解引起的;T2和T3的蛋白质发生了非常明显地降解,与对照组相比,135~245、100 kDa处蛋白条带变淡变模糊,45~48 kDa之间较粗的条带变成3条细小的条带,20~25和17 kDa的条带逐渐消失,尤其是T3组中这些蛋白条带已经消失,这说明这2种方法均有较好的嫩化效果;T4组牦牛肉发酵后,相对分子量为135~245 kDa的蛋白条带变淡,且逐渐分成2条比较清晰的条带,63 kDa左右的蛋白条带比对照组清晰,45~48 kDa之间的条带变细,颜色变淡,20~25 kDa之间的蛋白带消失,17 kDa的条带变淡;T5组的蛋白条带与T4组相似,但该组牦牛肉还经过超声波辅助木瓜蛋白酶嫩化,其蛋白条带比T4组颜色浅,尤其是45~48 kDa之间的粗条带变细,形成一条清晰的条带。
结合超声波嫩化后牦牛肉CSP和MFI可知,超声波对牦牛肉的嫩化主要是由于其机械作用或空化作用破坏肌纤维结构,故其可溶性蛋白含量和蛋白降解程度都低于其他处理组,而肌原纤维断裂效果较好,MFI值较高。木瓜蛋白酶不仅能使肌原纤维断裂,也能直接作用于蛋白质使其降解成小分子蛋白甚至氨基酸,对牦牛肉的嫩化效果极为明显。而在超声波的协助下,木瓜蛋白酶在肉中分布更均匀,活性更强,其CSP较高,MFI值最高。发酵对蛋白质的降解能力也较强,发酵时微生物产生的蛋白酶能降解蛋白,同时破坏肌肉结构,而结合超声辅助木瓜蛋白酶嫩化后,牦牛肉的嫩度不仅能得到极佳改善,发酵产生的氨基酸物质等可赋予牦牛肉更丰富的风味,更鲜艳的颜色,有益微生物还可抑制有害微生物的生长繁殖,提高牦牛肉的安全性。
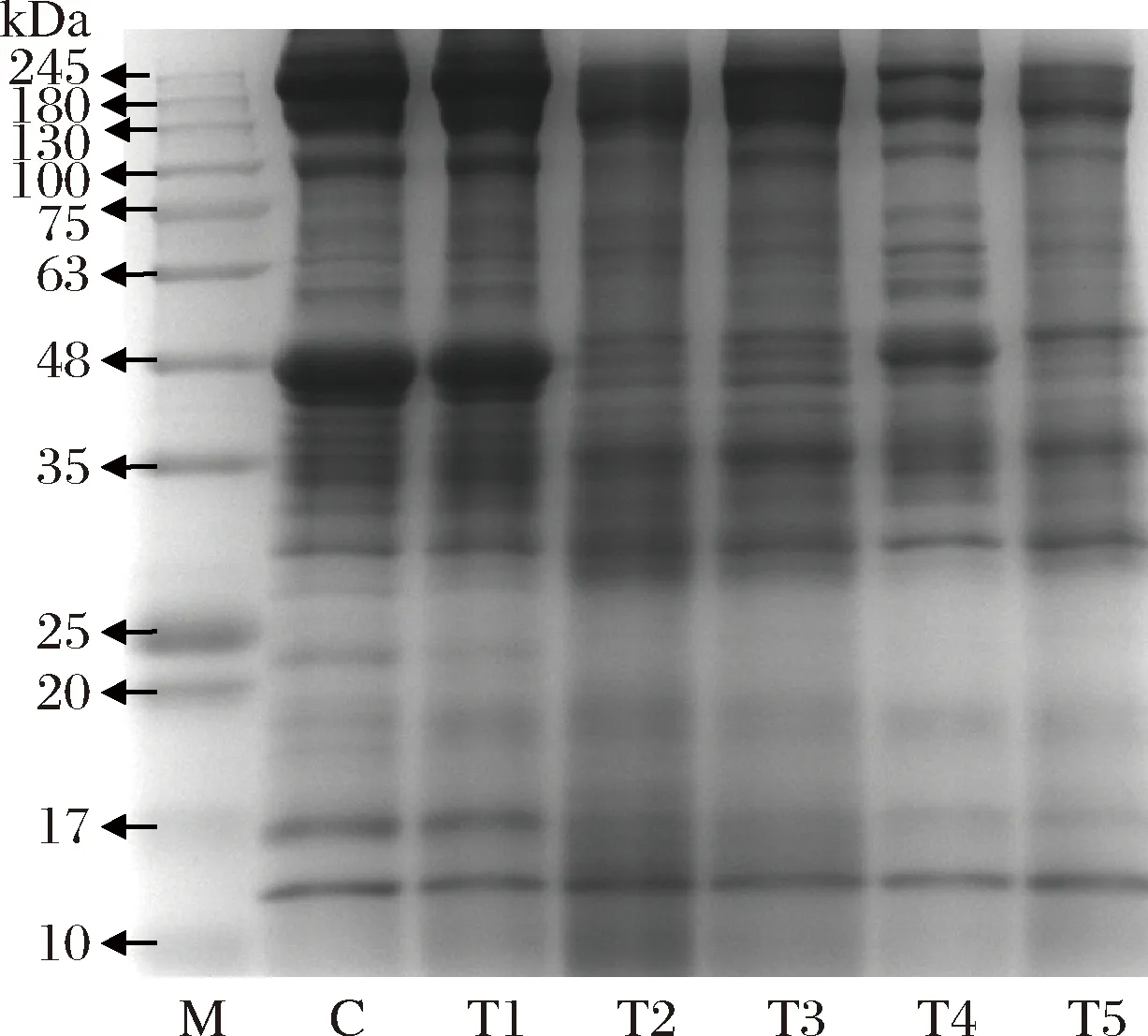
M-Marker;C-对照组;T1-超声波组;T2-木瓜蛋白酶组;T3-超声波辅助木瓜蛋白酶组;T4-发酵组;T5-超声波辅助木瓜蛋白酶+发酵组图3 不同嫩化方法处理牦牛肉的蛋白质SDS-PAGE图Fig.3 SDS-PAGE electrophoretogram of proteins from yak meat by different tenderization treatments
2.4 不同嫩化处理对牦牛肉质构的影响
表2为不同嫩化方法处理后的牦牛肉的硬度、弹性、内聚性和咀嚼性的影响。与对照组相比,5种嫩化处理均能降低牦牛肉的硬度、弹性、内聚性和咀嚼性,硬度关系为T3
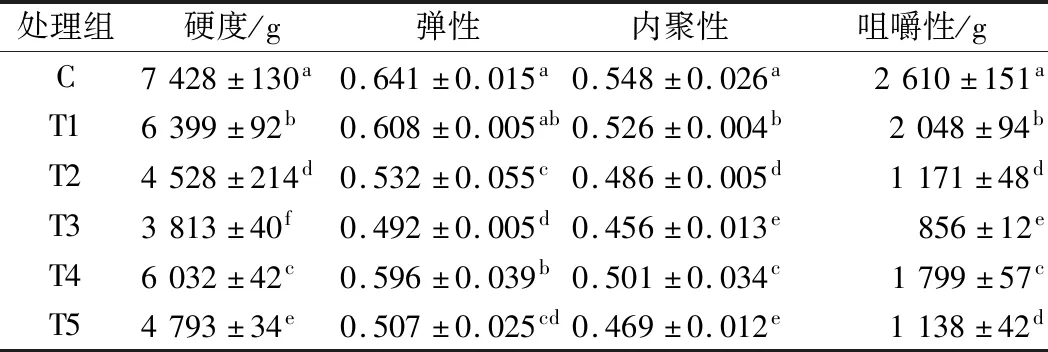
表2 不同嫩化处理对牦牛肉质构的影响Table 2 Effects of different tendering methods on texture of yak meat
注:表中数据表示为平均数,同列数字标有不同字母,表示差异显著(P<0.05)。
3 结论
本文通过超声波、木瓜蛋白酶、超声波辅助木瓜蛋白酶、发酵、超声波辅助木瓜蛋白酶+发酵5种嫩化方法对牦牛肉进行嫩化处理,研究不同嫩化方法嫩化后可溶性蛋白含量(CSP)、肌原纤维小片化指数(MFI)、质构特性及蛋白质降解的变化。相对于未处理的牦牛肉,5种嫩化方法都可对牦牛肉起到不同程度的嫩化作用,均可显著提高牦牛肉CSP、MFI(P<0.05),改善牦牛肉质构特征,显著降低硬度、弹性、内聚性和咀嚼性(P<0.05),其中超声波辅助木瓜蛋白酶组对牦牛肉质构特性的改善最显著,MFI最高,超声波、木瓜蛋白酶和发酵3种方法结合处理的牦牛肉中CSP最多。经过SDS-PAGE电泳,不同嫩化处理对牦牛肉蛋白质有不同程度的降解,其中超声波对蛋白降解程度低于其他处理组,木瓜蛋白酶和发酵对蛋白质的降解比较明显,尤其是超声波辅助木瓜蛋白酶结合发酵处理可将大分子蛋白显著降解为小分子蛋白。
