阻塞性睡眠呼吸暂停低通气综合征对老年高血压患者全天血压的影响
2020-01-10韩玉娟徐浩明李亚奥王营营牛丽洁
韩玉娟 徐浩明 李亚奥 王营营 牛丽洁
阻塞性睡眠呼吸暂停低通气综合征[1](OSAHS)是睡眠时上气道狭窄或堵塞引起呼吸暂停和通气不足,常伴有夜间睡眠时打鼾、白天嗜睡等症状。故患者在夜间睡眠时常反复发生低氧、高碳酸血症,可能导致高血压患者夜间血压增高,夜间心血管事件如心绞痛、心肌梗死、心律失常等发生率也明显增加[2]。随着老龄化社会发展,我国人口寿命逐渐延长,老年高血压患者数量也呈逐年上升趋势,且随年龄的增长而升高,60岁以上老年人高血压患病率达30%,65岁以上达50%,80岁以上达65%[3]。高血压与OSAHS之间相关性已不言而喻,资料显示高血压患者合并OSAHS占70.5%[4],明显高于一般人群高血压的患病率。这两种疾病均属于引发心血管疾病出现的危险因素,合并出现时会促使心血管疾病风险性显著增加[5]。为了提高这两种疾病的防控水平,研究这两者之间的相关性十分必要[6]。本研究通过对合并OSAHS的老年高血压全天血压进行分析比较,了解这些患者的血压情况,为合并OSAHS老年高血压患者血压采取更好治疗方法、更好达标提供依据。
1.资料与方法
1.1 一般资料 选择2017年1月至2018年12月在我院综合内科及护理中心病房收治老年高血压患者194例,根据AHI结果不同分四组:单纯高血压组(A组)患者50例,男性34例,女性16例,年龄74~92岁,平均(78.46±3.21)岁;轻度OSAHS合并高血压组(B组)49例,男性35例,女性14例,年龄72~89岁,平均(79.51±3.19)岁;中度OSAHS合并高血压组(C组)52例,男性38例,女性14例,年龄71~90岁,平均(76.54±3.21)岁;重度OSAHS合并高血压组(D组)20例,男性34例,女性16例,年龄74~92岁,平均(81.56±2.13)岁;各组性别、年龄相比P>0.05,一般情况具有可比性。本研究经过我院伦理委员会批准,所有入组患者对本研究知情同意。
1.2 入选及排除标准
1.2.1 老年高血压:根据《中国高血压防治指南》(2010年修订版)[7]的高血压诊断标准,年龄≥65岁,血压值持续或非同日3次以上,收缩压≥140mmHg(1mmHg=0.133kPa)伴或不伴舒张压≥90mmHg;或既往有高血压的老年患者服药状态下血压虽然低于140/90mmHg,也应诊断为高血压。
1.2.2 OSAHS:根据2011年中华医学会呼吸病学分会睡眠呼吸疾病学组制订的诊断标准[8]:每夜7h的睡眠呼吸过程中,呼吸暂停及低通气反复发作30次以上,或睡眠呼吸暂停低通气指数(AHI)≥5次/h。据AHI结果不同分为:5~15次/h为轻度OSAHS,>15~30次/h为中度OSAHS,>30次/h为重度OSAHS。
1.2.3 排除标准:中枢型睡眠呼吸暂停综合征(CSAS);合并慢性阻塞性肺疾病、支气管哮喘、间质性肺炎等夜间呼吸困难和慢性呼吸衰竭者;继发性高血压患者(如肾性、肾血管性高血压、原发性醛固酮增多症、嗜铬细胞瘤等)。
1.3 方法
1.3.1 睡眠呼吸检测:对符合条件的研究对象采用多导睡眠监测仪进行全夜(≥7h)的睡眠监测,监测当天忌饮酒、茶、咖啡等提神饮品,且不服用镇静安眠类药物等。由专业人员对记录资料进行分析报告。计算机自动分析结果,人工进行校正。
1.3.2 24h动态血压测量:采用深圳星脉医疗仪器有限公司WBP-02A无创性携带式动态血压测量仪。测量时间为连续24h,袖带绑于受试者非劳动手臂侧,仪器自动充气完成收缩压及舒张压测量。设置晨起6:00~晚22:00为白天监测血压时间,白天测量血压时间调整为每0.5h测量1次;晚22:00~晨6:00为夜间测血压时间,夜间测量血压时间调整为每1h测量1次,有效测定≥90%者入选。监测期间嘱患者避免剧烈运动、情绪激动等。观察指标:24h平均收缩压(24hSBP)与24小时平均舒张压(24hDBP),白天平均收缩压(dSBP)与白天平均舒张压(dDBP),夜间平均收缩压(nSBP)与夜间平均舒张压(nDBP)。
1.3.3 BMI(体重指数)计算:所有患者于空腹12h晨起测量体重、身高,计算BMI,BMI=体重/身高2(kg/m2);同时测量患者颈围。
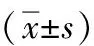
2.结果
2.1 四组BMI与颈围比较 四组体重指数(BMI)、颈围比较差异有统计学意义,P<0.05,且BMI与颈围数据随着OSAHS严重而增大,详见表1。

表1 四组患者BMI、颈围比较
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05。
2.2 四组血压监测结果比较 四组患者各项血压值随着OSAHS加重均有所升高,各组间相比P<0.05,差异有统计学意义,详见表2。

表2 四组患者血压比较(mmHg)
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05。
3.讨论
研究已证实,OSAHS是多种心血管疾病,比如冠心病、高血压、心律失常等的独立危险因素[9],并且是引起继发性高血压发病的主要原因之一[10]。目前关于OSAHS升压机制尚不完全明了,有资料显示:OSAHS患者由于慢性间歇性缺氧,导致患者外周化学感受器敏感性以及交感神经兴奋性均增高[11],引起心血管系统功能亢进,患者出现心率增快,心肌收缩力增强,从而增加心排血量,因血液中儿茶酚胺含量增加,外周血管阻力增加,导致患者血压升高。另外[12]反复缺氧还可引起肾脏缺氧,从而激活肾素血管紧张素醛固酮系统(RASS),释放缩血管物质,作用于血管平滑肌致血管收缩,而升高血压。另有研究表明夜间反复出现低氧血症刺激炎性介质产生,可导致局部和全身炎症反应,增加多种炎性因子释放,促进血管内皮的重塑,降低舒张血管物质一氧化碳水平,导致血管收缩。OSAHS还可以导致胰岛素抵抗(IR),使远端肾小管重吸收增加,体内水钠潴留[13]。
本研究结果显示,合并OSAHS老年高血压患者,随着OSAHS加重,老年高血压患者血压进行性升高,这与AHI与高血压存在计量反应关系,二者正相关[14]有关研究结果一致。本研究还显示BMI、颈围与OSAHS严重程度正相关,可以简单估计OSAHS严重程度,这与张祎祥研究结果一致[15],充分体现肥胖与OSAHS的关系。因此合并OSAHS的高血压患者,血压达标较普通老年人群更难,所以在合理控制体重及积极降压的同时,若对老年OSAHS能早诊断、早治疗,可降低老年高血压患病率和病死率,从而使老年人生活质量、健康状况得到改善,寿命也将延长。但目前我们对老年OSAHS的诊断率及治疗率以及患者治疗的依从性仍较低,有可能是导致老年高血压控制率低的因素之一,将来值得我们去关注及反思。
