雷公藤生物碱类成分及其药理活性研究进展
2020-01-09舒积成刘建群
刘 莉,闫 君,舒积成,刘建群
江西中医药大学 现代中药制剂教育部重点实验室,南昌 330004
雷公藤(TripterygiumwilfordiiHook.f.),又名黄藤根、断肠草等,属卫矛科雷公藤属植物,首载于《神农本草经》,主产于我国长江中下游流域,如浙江、福建、安徽等地。雷公藤味苦,性寒,皮有大毒,归肝、肾二经,具有清热解毒、祛风通络、舒筋活血、消肿止痛、杀虫止血等功效,有着悠久的药用历史[1]。雷公藤用于治疗类风湿性关节炎等自身免疫性疾病疗效显著,常作为治疗风湿顽痹之要药[2],但其肝、肾和血液系统等毒副作用大,其有效成分通常也为其毒性成分,严重地制约了其临床应用[3,4]。现代研究表明,雷公藤具有抗炎、抗病毒、抗肿瘤、杀虫等多种药理作用,具有极大的药用价值,值得深入研究。雷公藤的化学成分复杂,主要有效成分包括生物碱、二萜、三萜和木脂素等[5- 8]。生物碱是雷公藤中一类重要的化学成分,结构丰富多样,具有广泛的药理活性。笔者课题组研究发现经200 ℃烘箱煨制后的雷公藤对治疗类风湿性关节炎有着显著的减毒增效作用[9],并且煨制后,南蛇藤糠酰胺碱、1- 去乙酰基雷公藤定碱等生物碱含量显著下降,生物碱为雷公藤抗炎有效成分之一,且毒性较大,因此,生物碱的含量变化可能是雷公藤煨制减毒增效的物质基础[10,11]。生物碱类成分因其显著的药理活性[12],一直是现代研究的热点,雷公藤生物碱具有广泛的药理活性,有着极大的研究价值。迄今为止,已见报道的雷公藤生物碱类成分超过160个,结构丰富多样。本文系统、全面总结了至今国内外雷公藤生物碱类成分及其药理活性的研究情况,以期为该类成分的进一步研究开发提供参考。
1 化学成分
生物碱类成分是雷公藤的主要活性成分之一,迄今为止,雷公藤中已见报道的生物碱类成分共161个(见表1~4),从结构特点来看主要包括两大类:倍半萜大环内酯类生物碱,共92个(化合物1~92);倍半萜非大环内酯类生物碱,共58个(化合物93~150)。同时雷公藤中还含有少数其他类型生物碱,共11个(化合物151~161)。
1.1 倍半萜大环内酯生物碱
倍半萜大环内酯生物碱是雷公藤内含有数量最多的一类生物碱,目前已见报道的雷公藤倍半萜大环内酯生物碱共92个,从结构特点来看,主要可以将其分为两大类:吡啶环2′,3′位与大环相连的倍半萜大环内酯生物碱(1~69)及吡啶环3′,4′位与大环相连的倍半萜大环内酯生物碱(70~92)。倍半萜部分可连基团位置的多样性及可取代基团的复杂性,决定了该类化合物种类的多样性。
1.1.1 吡啶环2′,3′位与大环连接
雷公藤所含此类生物碱见表1,对应结构见图1。
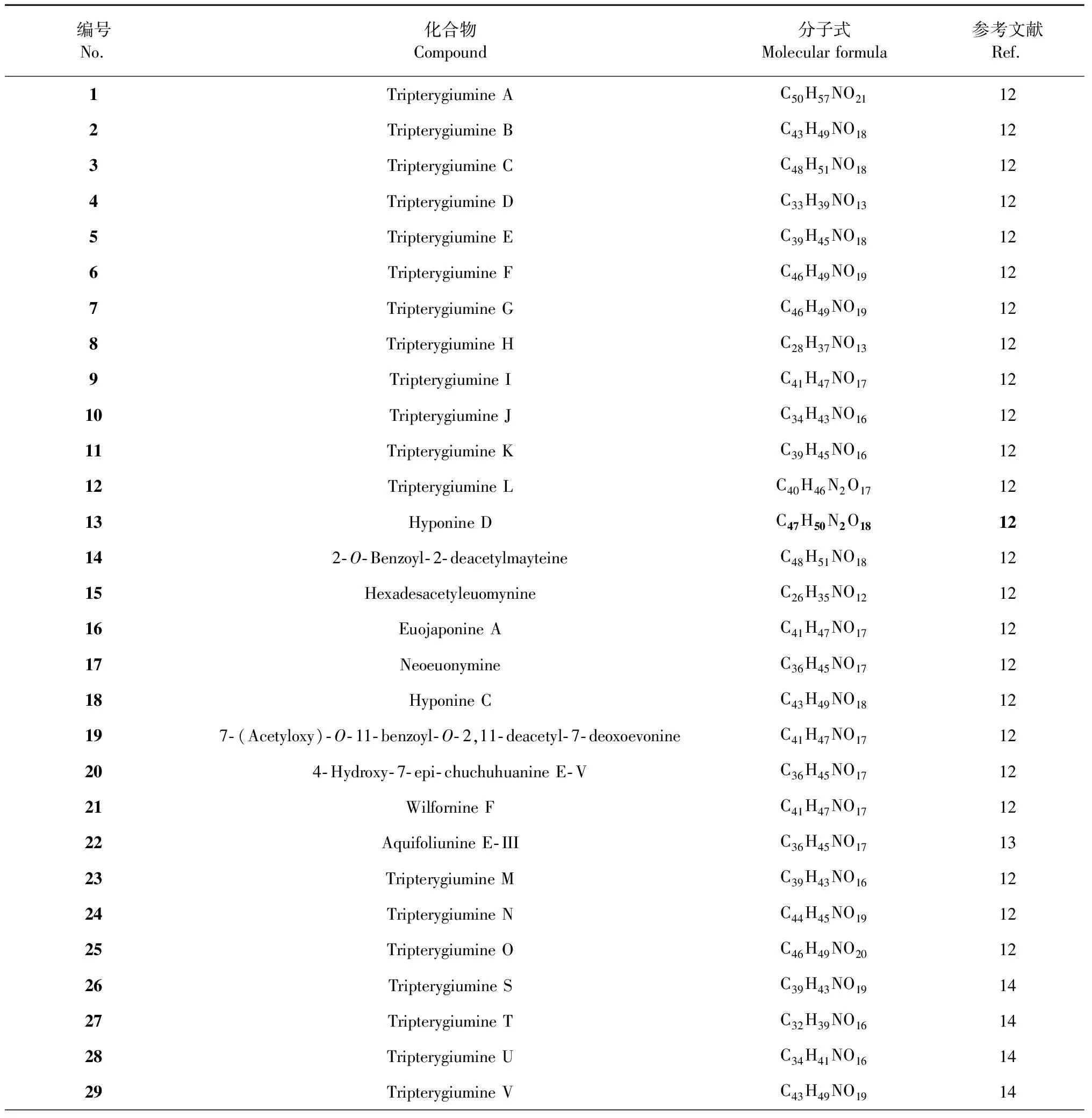
表1 雷公藤吡啶环2′,3′位与大环连接的生物碱
续表1(Continued Tab.1)

编号No.化合物Compound分子式Molecular formula参考文献Ref.302-Debenzoyl-2-nicotinoylwilforineC42H48N2O1814319′-O-3-Furoyl-wilfortrineC46H49NO221232AlatamineC41H45NO181233AlatusinineC38H47NO191234WilforzineC41H47NO171535WilforjineC36H45NO171236Tripterygiumine PC35H41NO151237Tripterygiumine QC33H39NO161238Euonine (Wilformine)C38H47NO181639WilfortrineC41H47NO2017409′-O-Acetyl-7-deacetoxy-7-oxowilfortrineC41H45NO2018419′-O-AcetylwilfortrineC43H49NO2118429′-O-FuranoylwilfordineC48H51NO2118437-O-Benzoyl-5,7-dideacetylWilformineC41H47NO171844WilforgineC41H47NO191745WilfordineC43H49NO191746WilforineC43H49NO181747WilforidineC36H45NO181948Wilfornine AC45H51NO201449Wilfornine BC43H49NO192050Wilfornine CC50H53NO202151Wilfornine DC43H49NO211452Wilfornine EC36H43NO182053Cangorinine E-1C43H49NO181854Ebenifoline E-IIC48H51NO181855EuonymineC38H47NO181856MayteineC43H49NO182057Tripterygiumine WC44H47NO181458Wilfornine HC44H47NO202259Hyponine BC41H47NO19960Hyponine EC45H48NO1923611-DesacetylwilforgineC39H45NO189621-DesacetylwilforineC41H47NO1722631-DesacetylwilfordineC41H47NO189641-DesacetylwilfortrineC39H45NO1915652-Debenzoyl-2-nicotinoylwilforineC42H48N2O1815669′-Hydroxy-2-nicotinoylwilforineC42H48N2O192267Tripfordine AC36H45NO182168Tripfordine BC36H45NO172469Triptonine AC45H54NO219

图1 雷公藤吡啶环2′,3′位与大环连接的生物碱结构式Fig.1 Structures of T.wilfordii alkaloid,of which pyridine ring 2′,3′ position connected to macrocyclic
1.1.2 吡啶环3′,4′位与大环连接
雷公藤所含此类生物碱见表2,对应结构见图2

表2 雷公藤吡啶环3′,4′位与大环连接的生物碱
续表2(Continued Tab.2)

编号No.化合物Compound分子式Molecular formula参考文献Ref.78Wilfordinine JC36H45NO172079Wilfordinine BC38H47NO192780Wilfordinine CC43H49NO192781IsowilfortrineC41H47NO201982WilfordsineC42H49NO191383Wilfordinine EC38H47NO181684WilfordinineDC41H47NO192885WilfordinineFC43H49NO182886WilfordinineGC36H43NO182887WilfordinineHC41H47NO202888IsowilfordineC43H49NO182889WilfornineGC42H48N2O182990Tripfordine CC36H45NO172491HypoglaunineBC41H48NO202692Triptonine BC45H54NO2225
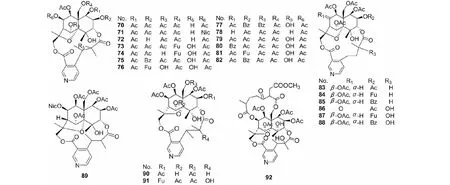
图2 雷公藤吡啶环3′,4′位与大环连接的生物碱结构式Fig.2 Structures of T.wilfordii alkaloid,of which pyridine ring 3′,4′ position connected to macrocyclic
1.2 倍半萜非大环内酯生物碱
倍半萜非大环内酯生物碱是雷公藤中含有的另一类数量极为庞大的生物碱。该类化合物种类的多样性决定于其可连基团位置的多样性及可取代基团的复杂性。雷公藤中所含此类生物碱见表3,对应结构见图3。
1.3 其他类型生物碱
雷公藤所含其他生物碱共有以下几种,如大环多胺类生物碱。雷公藤所含此类生物碱见表4,对应结构见图4。图1~4生物碱结构式中涉及的一些取代基结构见图5。
2 药理作用
2.1 免疫抑制
雷公藤的多种生物碱单体均具有免疫抑制作用,如雷公藤康碱、异雷公藤春碱、雷公藤新碱、雷公藤碱戊、雷公藤吉碱、雷公藤明碱等。雷公藤康碱、雷公藤明碱、异雷公藤春碱、雷公藤春碱、雷公藤新碱对特异性免疫、非特异性免疫功能均有抑制作用,雷公藤碱戊对B细胞功能的多个环节均具有抑制作用。其中雷公藤春碱、雷公藤新碱对体液免疫、细胞免疫、非特异性免疫功能均有抑制作用。Zheng等[42]研究发现在一定浓度条件下雷公藤春碱对移植物抗宿主反应为指标的细胞免疫有一定的抑制作用,雷公藤新碱对DNCB所致迟发型超敏反应具有明显的抑制作用,两者均能够明显抑制溶血素抗体的形成、显著降低小鼠碳粒廓清速率,对网状内皮系统吞噬功能具有抑制作用。Luo等[12]研究发现tripterygiumine Q对人外周单核细胞具有免疫抑制活性,IC50值为8.67 μM,即使在100 μM时也没有细胞毒性,这表明tripterygiumine Q可能是开发新免疫抑制剂的新途径。

表3 雷公藤倍半萜非大环内酯生物碱
续表3(Continued Tab.3)

编号No.化合物Compound分子式Molecular formula参考文献Ref.132Wilforsinine CC40H44N2O1530133Wilforsinine DC36H41NO1330134Wilforsinine EC40H42N2O1330135Wilforsinine GC40H42N2O1330136Wilforsinine HC35H40N2O13301372β,6α,12-Triacetoxy-1β,9β-bis(benzoyl-8β-(β-nicotinoyloxy)-β-dihydroagarofuranC41H43NO13301381β,2β,5α,8β,11-Pentaacetoxy-4α-hydroxy-3α(2′-methylbutanoyl)-15-nicotinoyl-7-oxo-dihydroagarofuranC36H45NO1735139Triptersinine UC38H44NO19261401β,5α,11-Triacetoxy-7β-benzoyl-4α-hydroxy-8β-nicotinoy-dihydroagarofuranC34H39NO12351411β,2β,5α,11-Tetraacetoxy-8α-benzoyl-4α-hydroxy-7β-nicotinoyl-dihydroagarofuranC36H41NO1435142Triptogelin F-1C30H35NO736143Triptogelin C-2C32H37NO937144Triptogelin C-4C30H35NO838145Triptogelin A-10C44H43NO1137146Triptogelin A-5C42H47NO1137147Triptogelin A-6C44H43NO1137148Triptogelin A-7C30H35NO937149Triptogelin A-9C43H49NO1137150Triptogelin B-2C37H39NO937
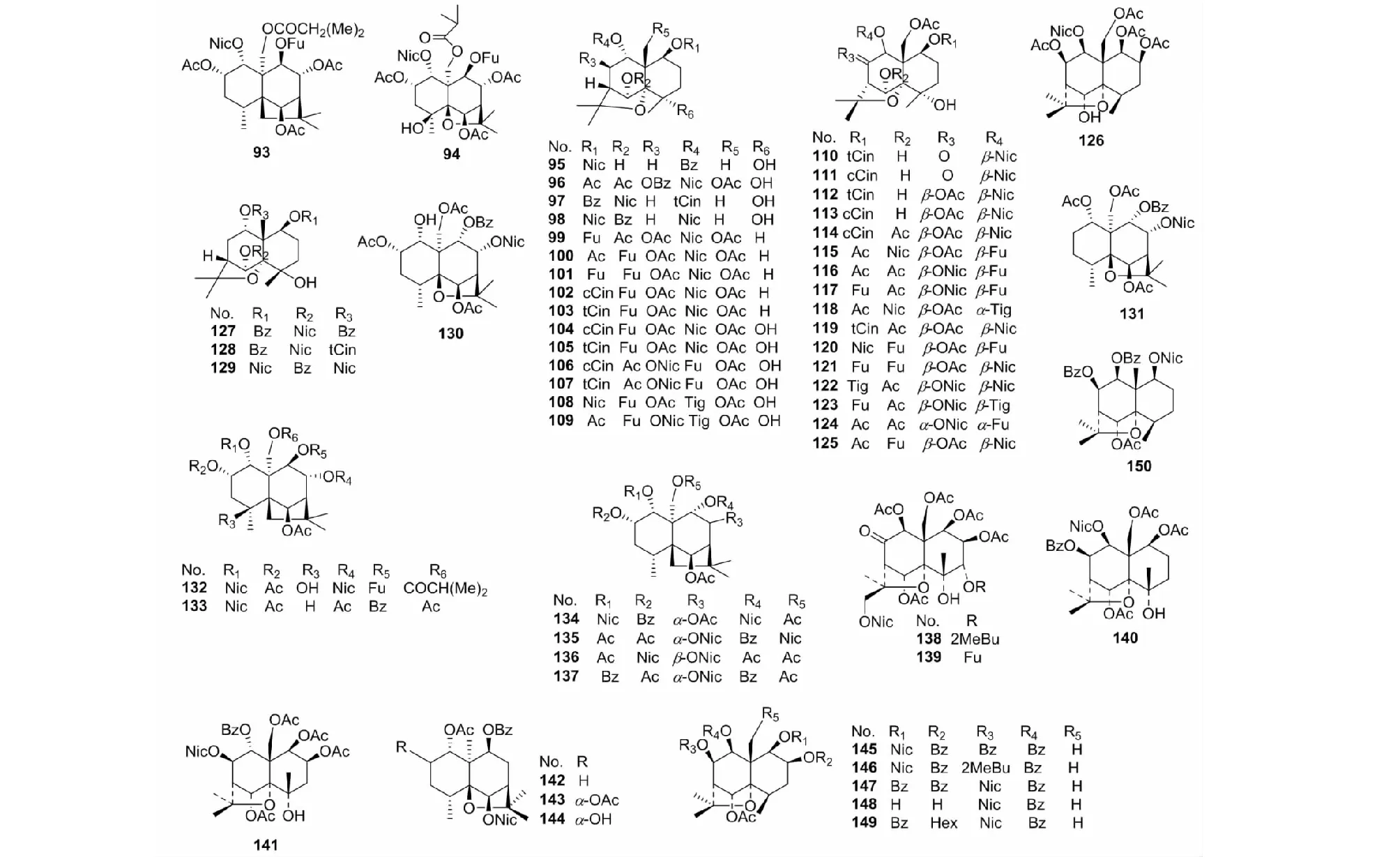
图3 雷公藤倍半萜非大环内酯生物碱结构式Fig.3 Structures of sesquiterpene non- macrolide Tripterygium wilfordii alkaloid

表4 雷公藤其他类型生物碱
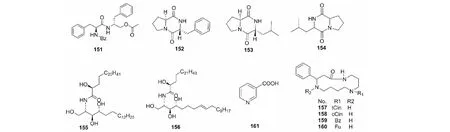
图4 雷公藤其他类型生物碱结构式Fig.4 Structures of other type alkaloids from Tripterygium wilfordii

图5 一些取代基的结构Fig.5 The structures of some substituted group
2.2 抗HIV
雷公藤中所含的多种生物碱类单体均具有抗HIV活性,如wilfordine、wilfortrine、hypoglaunine A、hypoglaunine B、triptonine A、triptonine B、cangoronine E- 1、euonymine、neoeuonymine、hyponine B等。Duan[27]评估了triptonine A、triptonine B和几种相关化合物的抗艾滋病毒活性。其中triptonine B显示出了有效的抗艾滋病毒活性,EC50<0.1 μg/mL,其体外治疗指数值>1000。同时雷公藤生物碱类成分hypoglaunine B、hyponine B、wilfortrine也具有一定的抗HIV病毒活性。Horiuch等[24]对12种从雷公藤中提取的吡啶生物碱的抗艾滋病毒活性进行了测定, 基于新分离化合物的筛选结果和已知倍半萜吡啶生物碱的先前数据,提出了这种类型化合物的抗艾滋病毒结构- 活性关系:羧基烷基链在吡啶部分的位置并不重要,因为2′- 和4′- 取代的化合物都表现出高抗艾滋病毒活性(EC500.1 μg/mL);相反,在C- 8′(羧丙基侧链)或C- 9′(羧丁基侧链)的羟基影响其抗艾滋病毒活性。
2.3 抗肿瘤
雷公藤的部分生物碱类成分还具有抗肿瘤的药理作用。Yue等[43]研究发现wilfortrine能有效抑制癌细胞增殖,抑制其侵袭能力。Wilfortrine治疗后肝癌HepG2细胞的凋亡率明显增加,尤其是早期凋亡率(P< 0.05),然而,wilfortrine并没有改变HepG2细胞的细胞周期。Wilfortrine治疗后,Bcl- 2表达明显降低(P<0.05),而Bax表达较对照组明显增加(P<0.05)。以上结果表明wilfortrine能诱导HepG2凋亡,但对其细胞周期并无影响,主要通过促进Bax表达和抑制抗凋亡蛋白Bcl- 2表达实现。
异雷公藤春碱、雷公藤康碱对白血病细胞具有抑制作用。Lin等[44]用MTT法检测雷公藤康碱在体外对K562细胞(红白血病细胞)及HL60细胞(急性髓性白血病细胞)的杀伤作用。实验结果显示在3.00 μg/mL浓度时,雷公藤康碱对K562细胞的抑制率为87%,对HL60细胞的抑制率为90%,经Student检验,与对照组相比,P<0.001。Chen等[45]采用MTT法,研究雷公藤总生物碱及倍半萜类生物碱共5 种组分对人CIK细胞、结直肠腺癌HCT116细胞及肝癌HepG2细胞的增殖抑制作用,以及筛选出的LGT-ZF1组分在不同时间点对这3种细胞的抑制作用。实验结果显示雷公藤总生物碱及3种倍半萜类生物碱组分 (LGT- ZF1、2、3) 具有细胞增殖抑制活性,LGT- ZF1组分对人CIK细胞、HCT116细胞、HepG2细胞的抑制效应呈时间剂量依赖性,同时结果表明LGT-ZF1组分具有较好的免疫抑制活性及抗肿瘤作用。
2.4 抗炎
雷公藤总生物碱具有抗炎作用,Zhai等[46]采用二甲苯小鼠耳肿胀模型、大鼠棉球肉芽肿、小鼠毛细血管通透性实验法研究雷公藤总生物碱(ATW)的抗炎作用,研究结果表明ATW能明显抑制小鼠耳廓肿胀,抑制棉球肉芽肿的增重,降低小鼠腹腔毛细血管通透性,具有抗炎作用。
部分雷公藤生物碱单体也具有抗炎作用,Zhang等[47]研究发现雷公藤新碱能够抑制LPS 诱导的小鼠树突状细胞(DCs)成熟与分化,增加DCs抗原吞噬能力,并抑制其细胞因子分泌,雷公藤新碱可减轻DCs介导的炎症反应。Yang等[48]通过对雷公藤次碱(wilforine)对脂多糖(LPS)诱导的小鼠单核/巨噬细胞系RAW264.7细胞炎症模型中炎症因子的影响的观察发现,wilforine可以抑制LPS诱导的RAW264.7细胞炎症反应,其抗炎作用与减少炎性细胞因子TNF-α、IL- 6和NO的产生有关。Gao等[14]通过测量脂多糖诱导的小鼠巨噬细胞系RAW264.7产生的一氧化氮来评价多种化合物的抗炎活性发现,生物碱类成分9′-O- acetyl- 7- deacetoxy- 7- oxowilfortrine及tripterygiumine S具有有效的一氧化氮抑制活性,IC50值在2.99至28.80 μM范围内,对RAW264.7细胞的生存能力没有任何影响,化合物9′-O- acetyl- 7- deacetoxy- 7- oxowilfortrine、tripterygiumine S,特别是9′-O- acetyl- 7- deacetoxy- 7- oxowilfortrine,被认为是有希望的抗炎候选药物。
2.5 镇痛
Zhai等[46]采用小鼠温浴法、超声波甩尾法、热板法和扭体法研究ATW的镇痛作用,研究结果表明雷公藤总生物碱对冰醋酸、超声波、热刺激所诱发的小鼠疼痛均有抑制作用,具有镇痛的药理作用。
2.6 杀虫
雷公藤总生物碱是雷公藤中主要杀虫活性物质,对鳞翅目、双翅目、鞘翅目等多种昆虫表现出较强的胃毒、拒食、麻醉、生长发育抑制和种群抑制等多种特异性杀虫作用,是一个很有发展潜力的生物碱杀虫剂。目前已从雷公藤中分离出的生物碱中,wilforgine、wilfordine、wilforine、wilforzine、wilfotrine、euonine这6种生物碱已经确定其确切的杀虫作用。雷公藤生物碱毒杀昆虫的机理是作用于昆虫的神经系统,麻醉昆虫,中毒后昆虫的中肠肠壁细胞遭到破坏,影响其取食和代谢,雷公藤总生物碱引起昆虫的中毒症状依次表现为行动迟缓、停止取食、麻醉、复苏或死亡,复苏后可再次取食、麻醉、复苏或死亡,反复多次,直至死亡,此外,昆虫的呼吸系统也受到一定影响[49]。
2.7 神经保护
雷公藤中的部分生物碱还具有神经保护作用,Chen等[32]测试了13种雷公藤叶中分离得到化合物对用okadaic acid(OKA)处理的PC12细胞的神经保护活性。神经生长因子(NGF)用作阳性对照,在10 μM 时triptersinines Z4、Z5、Z7、Z8处理的经OKA处理的PC12细胞存活率增加,分别从60.4%±23.0%增加到86.2%±25.5%,这几种雷公藤中生物碱显示出适度的神经保护活性,同时活性的比较表明,在C- 4处没有羟基的化合物比含有这种基团的化合物更有效。
2.8 毒性作用
雷公藤中生物碱类成分具有多种器官毒性,尤其是其肝毒性及对生殖系统的毒性,生物碱类成分的肝毒性最大,能引起肝损伤,破坏红细胞并可导致进行性贫血,甚至诱发肾小管缺氧性损害和严重营养不良[50]。Zhang等[51]研究分析雷公藤柱层析中段和末段组分对小鼠急性毒性和大鼠急性肝损伤的影响发现,雷公藤柱层析中段组分的毒性强于末段组分,毒性物质基础以二萜、生物碱类为主,毒性主要表现为急性肝损伤,毒性成分与毒性存在量效关系。
3 展望
雷公藤治疗类风湿性关节炎等疾病的显著疗效及其广泛的药理活性使其备受国内外研究者关注。目前已从雷公藤中分离得到生物碱类化合物共有160多个,其广泛的药理活性显示出了这类成分巨大的研究价值。然而其严重的毒副作用大大制约了其应用,国内外学者为提高其临床应用安全性和有效性进行了大量研究。虽然雷公藤生物碱类成分具有一定的毒副作用,但已有研究表明雷公藤生物碱类成分毒性小于其二萜类成分,且其药效作用显著,因而通过一些技术手段实现对雷公藤生物碱类成分的减毒增效有着极大的研究价值。例如通过炮制降低其毒性,从降毒效果来看,煨制、米醋蒸制和药汁制可能具有较好前景[52],其中本课题组发现煨制能使雷公藤中20余种生物碱类成分发生变化[9],能实现治疗类风湿性关节炎的减毒增效作用,但仍存在物质变化机理及规律不明、作用机制不清,对其变化产物研究不足等问题。同时目前对雷公藤生物碱类成分的研究主要集中在倍半萜类生物碱及吡啶生物碱的研究,针对从雷公藤中分离出的大环多胺类生物碱研究较少,目前从植物中分离得到的大环多胺类生物碱不足50个,且对其报道多为其合成方面,其药理活性方面研究严重不足,具有较大的潜在研究价值。
综上所述,雷公藤中生物碱类化学成分含量丰富,具有广泛的药理活性,特别是免疫抑制、抗炎、镇痛、抗肿瘤、抗HIV、杀虫、神经保护等,具有广阔的应用前景。随着研究的不断深入,针对雷公藤生物碱结构与活性之间、活性与活性之间的相关研究,可为了解药物作用机理、毒性机制、优化先导化合物结构、阐释传统中药作用机制提供研究基础,亦可为实现其临床用药奠定基石。
