酵母诱导欧洲花楸悬浮细胞的化学成分及抑菌活性
2020-01-09李佳兴李慧梁周良云张卫东郭兰萍
李佳兴,李慧梁,周良云,黄 蕾,杨 健,张卫东*,郭兰萍*
1中国中医科学院中药资源中心 道地药材国家重点实验室,北京100700;2第二军医大学药学院,上海 200433
药用植物在生长过程中经常遭受环境中物理、化学、生物等不利因素的影响,这种环境胁迫影响可引起植物次生代谢产物的变化并启动体内防御机制,从而降低或避免自身受到伤害,使植物呈现一定的抗逆性。如欧洲花楸(Sorbusaucuparia)等苹果亚科(Pyrinae)植物感染火疫病后,在病灶周围可产生联苯类化合物,抑制火疫病欧文氏菌的进一步增殖[1,2]。最近,我们还发现以酵母提取物(yeast extract,YE)作为生物诱导子,刺激花楸树悬浮细胞(S.pohuashanensissuspension cell,SPSC)一定时间后,会诱导联苯类植保素(phytoalexin)noraucuparin和2′- hydroxyaucuparin从头合成[3]。另一方面,药用植物次生代谢产物通常是其有效成分,对于环境胁迫和药用植物有效成分的形成,存在一个广泛认同的结论,即环境胁迫下,植物次生代谢产物的数量会增加,从而导致植物有效成分积累[4]。
欧洲花楸(S.aucuparia)为蔷薇科(Rosaceae)苹果亚科(Pyrinae)花楸属乔木或小乔木,原产于欧洲和亚洲西部,在我国北方部分地区生长[5,6]。该植物富含黄酮、花青素、双联苯酚、类山梨酸苷、生氰苷等化学成分;具有抗氧化、抗癌、抗炎、降血糖、利尿和扩张血管等生物活性和药理作用[6]。其果实、枝叶及茎皮皆可入药,用于治疗肾病、痛风、风湿和感冒等疾病[7]。作为药用植物,欧洲花楸需要生长一定时间后方可入药,且植株药用成分含量低,产量及质量不稳定。用植物细胞培养技术来生产药用次生代谢产物,具有产生速度快,生长条件易控的特点,目前已成为生物技术重要的研究与发展领域。为研究欧洲花楸细胞在环境胁迫条件下的活性代谢产物,我们利用前期研究建立的欧洲花楸悬浮细胞(S.aucupariasuspension cell,SASC)培养体系[3,8,9],选择能迅速引起SASC次生代谢响应的YE作为外加诱导子[8],形成真菌次生代谢产物对欧洲花楸细胞的化学胁迫,并对悬浮细胞富集培养,进一步从中分离鉴定出13个化合物,分别为eriobofuran(1)、4,5- dihydroxy- 3- methoxybiphenyl(2)、2′- hydroxyaucuparin(3)、aucuparin(4)、trans- cinnamic acid(5)、citrostadienol(6)、β- 谷甾醇(7)、uvaol(8)、白桦脂酸(9)、tormentic acid(10)、alphitolic acid methyl ester(11)、fupenzic acid(12)、亚油酸(13)。选择化合物1~3、5、8和12对15种植物病原真菌进行抑菌活性测试,其中联苯类化合物1和2对苹果轮纹菌具有显著的抑制活性,MIC分别为3.13和6.25 μg/mL。
1 仪器和材料
1.1 仪器与试剂
核磁共振光谱仪(Bruker AV- 400 MHz,AV- 500 MHz和Avance Ⅲ 600);ZF- 1型紫外检测仪(力辰仪器科技有限公司生产);RE52C型旋转蒸发仪(上海亚荣生化仪器厂);SHB- 3型循环式多用真空泵(郑州长城仪器有限公司);FA1604A型电子分析天平(河南恒信仪器设备有限公司);柱层析正相硅胶(200~300目,青岛海浪硅胶干燥剂有限公司);半制备型HPLC(AS20005,Dubhe C18column,10 μm,20 × 250 mm,江苏汉邦科技有限公司);Sephadex LH- 20(Amersham Biosciences,Sweden);超高效液相色谱串联四级杆飞行时间质谱(UPLC- Q- TOF- MS,Acquity UPLC- I- Class串联Xevo- G2- S Q- TOF系统,Waters公司);高温灭菌锅(上海申安医疗器械厂);SW- CJ- 2FBC超净工作台(苏州智净净化仪器有限公司);HNY- 211B恒温摇床(天津欧诺仪器股份有限公司);恒温培养箱(上海精宏实验设备有限公司);酮康唑(阿达玛斯试剂有限公司);甲醇、乙酸乙酯、二氯甲烷、石油醚、二甲基亚砜(成都市科龙化学品有限公司);氘代氯仿、氘代吡啶(美国Cambridge Isotope Laboratories 公司)。
1.2 实验材料
SASC(中国科学院植物研究所叶和春研究员实验室);15株病原真菌(河南农业大学麻兵继教授实验室);马铃薯葡萄糖肉汤(PDB,北京奥博星生物技术有限责任公司)。
2 YE诱导SASC培养与富集
YE诱导SASC培养实验采用课题组前期建立的方法[9]。SASC培养于200 mL MS固体培养基的500 mL广口瓶中,每7~10天继代一次,25 ℃摇床转速120 r/min暗培养。实验中将减压过滤后的3.5 g(70 g/L)悬浮细胞接种于含有50 mL MS液体培养基的250 mL三角瓶中,培养5天后给予YE诱导处理。用蒸馏水溶YE粉末,处理终浓度为3 g/L;处理时间分别设置为:处理后6、12、24、48 h。对照组加入与处理组等体积的蒸馏水,未处理细胞同为对照,记作:0 h。每个处理3个重复。收取细胞样品用于检测YE诱导前后SASC代谢物的变化情况。经UPLC- Q- TOF- MS检测,其结果与课题组前期研究报道基本一致[9],即与对照组相比,YE诱导后,SASC中联苯类植保素出现一定程度的积累,并且当YE诱导SASC 48 h[9]时,联苯类植保素的积累整体处于较高水平。为分离包括联苯类的次生代谢产物,扩大SASC培养体系至300 L,接种新鲜SASC(70 g/L),培养至第7天,进行YE诱导,选择诱导48 h时收集细胞,烘干,用于化合物分离。
3 提取与分离
取干燥的花楸悬浮细胞1 kg,用甲醇在室温条件下冷浸提取3次,每次72 h,合并提取液,减压浓缩得到浸膏约0.3 kg。所得浸膏经正相硅胶柱色谱粗分,先用石油醚洗脱,后用二氯甲烷/甲醇溶剂系统(100∶0→0∶100)梯度洗脱得到组分A~K。组分A(石油醚洗脱组分)经硅胶和Sephadex LH- 20凝胶柱色谱分离,得到1(3 mg)和5(2 mg)。组分C(二氯甲烷/甲醇99∶1洗脱组分)经正相硅胶和Sephadex LH- 20柱层析分离,得到化合物6(3 mg)、7(50 mg)和13(3 mg)。组分D(98∶2洗脱组分)经正相硅胶和Sephadex LH- 20柱色谱纯化,得到化合物8(6 mg)和9(15 mg)。组分E(97∶3洗脱组分)经正相硅胶、Sephadex LH- 20柱层析和Semi- Prep.HPLC分离,得到化合物2(2 mg)、4(2 mg)和11(2 mg)。组分F(95∶5洗脱组分)经正相硅胶和C- 18柱色谱分离,得到化合物3(2 mg)、10(3 mg)和12(5 mg)。
4 结构鉴定
化合物1无色晶体(CHCl3);1H NMR(CDCl3,600 MHz)δ:7.82(1H,d,J= 7.6 Hz,H- 9),7.55(1H,d,J= 7.6 Hz,H- 6),7.37(1H,td,J= 7.5,1.3 Hz,H- 7),7.30(1H,d,J= 7.8 Hz,H- 8),7.11(1H,s,H- 1),5.83(1H,s,3- OH),4.27(3H,s,4- OCH3),4.01(3H,s,2- OCH3);13C NMR(CDCl3,150 MHz)δ:156.1(C- 5a),144.7(C- 2),142.6(C- 4a),137.5(C- 3),132.5(C- 4),125.6(C- 7),124.7(C- 9a),122.6(C- 8),119.6(C- 9),116.0(C- 9b),111.5(C- 6),96.2(C- 1),60.9(4- OCH3),56.7(2- OCH3)。以上数据与文献[10]对照基本一致,故化合物1鉴定为eriobofuran。
化合物2白色粉末(CHCl3);1H NMR(CDCl3,400 MHz)δ:7.53(2H,d,J= 7.5 Hz,H- 2′,H- 6′),7.41(2H,t,J= 7.6 Hz,H- 3′,H- 5′),7.32(1H,t,J= 7.3 Hz,H- 4′),6.87(1H,s,H- 2),6.70(1H,s,H- 6),5.54(2H,brs,4- OH,5- OH),3.98(3H,s,3- OCH3);1H NMR(400 MHz,CD3OD)δ:7.51(2H,d,J= 7.4 Hz,H- 2′,H- 6′),7.35(2H,t,J= 7.6 Hz,H- 3′,H- 5′),7.23(1H,t,J= 7.3 Hz,H- 4′),6.72(2H,m,H- 2,H- 6),3.88(s,3H)。以上数据与文献[3]对照基本一致,故化合物2鉴定为4,5- dihydroxy- 3- methoxybiphenyl。
化合物3白色粉末(CHCl3);1H NMR(CDCl3,600 MHz)δ:7.28~7.22(2H,m,H- 4′,H- 6′),7.01~6.96(2H,m,H- 3′,H- 5′),6.66(2H,s,H- 2,H- 6),5.62(1H,s,- OH),5.37(1H,s,- OH),3.91(6H,s,3- OCH3,5- OCH3)。以上数据与文献[3]对照基本一致,故化合物3鉴定为2′- hydroxyaucuparin。
化合物4白色粉末(CHCl3);1H NMR(CDCl3,500 MHz)δ:7.54(2H,d,J= 7.4 Hz,H- 2′,H- 6′),7.43(2H,t,J= 7.4 Hz,H- 3′,H- 5′),7.33(1H,t,J= 7.4 Hz,H- 4′),6.80(2H,s,H- 2,H- 6),5.54(1H,brs,4- OH),3.96(6H,s,3- OCH3,5- OCH3)。以上数据与文献[11]对照基本一致,故化合物4鉴定为aucuparin。
化合物5无色针晶(CHCl3);1H NMR(CDCl3,600 MHz)δ:7.81(1H,d,J= 16.1 Hz,H- 3),7.58(2H,m,H- 3′,5′),7.42(3H,m,H- 2′,4′,6′),6.47(1H,d,J= 16.1 Hz,H- 2);13C NMR(CDCl3,150 MHz)δ:172.1(C=O),147.1(C- 3),134.0(C- 1′),130.7(C- 4′),128.9(C- 6′),128.9(C- 2′),128.4(C- 3′),128.4(C- 5′),117.2(C- 2)。以上数据与文献[12]对照基本一致,故化合物5的结构鉴定为trans- cinnamic acid。
化合物6白色粉末(CHCl3);1H NMR(CDCl3,500 MHz)δ:5.18(1H,brd,J= 4.4 Hz,H- 7),5.11(1H,q,J= 6.7 Hz,H- 28),3.12(1H,td,J= 10.5,4.4 Hz,H- 3),2.83(1H,m,H- 25),1.59(3H,d,J= 6.8 Hz,CH3- 29),0.95(3H,d,J= 6.8 Hz,CH3- 21),0.97(6H,d,J= 6.6 Hz,H3- 26,CH3- 27),0.98(3H,d,J= 6.5 Hz,4- CH3),0.83(3H,s,CH3- 19),0.54(3H,s,CH3- 18);13C NMR(CDCl3,125 MHz)δ:145.8(C- 24),139.1(C- 8),117.4(C- 7),116.4(C- 28),76.2(C- 3),56.0(C- 17),54.9(C- 14),49.6(C- 9),46.6(C- 5),43.3(C- 13),40.2(C- 4),39.5(C- 12),37.0(C- 1),36.5(C- 20),35.9(C- 22),34.8(C- 10),30.9(C- 2),28.6(C- 25),28.0(C- 16),27.9(C- 23),26.6(C- 6),22.9(C- 15),21.3(C- 11),21.0(C- 27),21.0(C- 26),18.9(C- 21),15.1(4- CH3),14.1(C- 19),12.7(C- 29),11.8(C- 18)。以上数据与文献[13]对照基本一致,故化合物6鉴定为citrostadienol。
化合物7无色针晶(CHCl3);1H NMR(CDCl3,400 MHz)δ:5.34(1H,m,H- 6),3.52(1H,m,H- 3),1.00(3H,s,CH3- 19),0.91(3H,d,J= 6.4 Hz,CH3- 21),0.79~0.87(9H,m,CH3- 26,CH3- 27,CH3- 29),0.67(3H,s,CH3- 18)。以上数据与文献[14]对照基本一致,故化合物7鉴定为β- 谷甾醇。
化合物8白色粉末(CH3OH);1H NMR(CDCl3,400 MHz)δ:5.12(1H,t,J= 3.5 Hz,H- 12),3.51(1H,d,J= 10.8 Hz,H- 28β),3.21(1H,m,H- 3),3.16(1H,d,J= 11.3 Hz,H- 28α),1.08(3H,s),0.97(3H,s),0.93(3H,s),0.91(3H,d,J= 5.8 Hz),0.84(3H,d,J= 5.8 Hz),0.77(3H,s),0.73(3H,d,J= 8.9 Hz);13C NMR(CDCl3,100 MHz)δ:138.6(C- 13),124.9(C- 12),78.9(C- 3),69.8(C- 28),55.1(C- 5),53.9(C- 18),47.6(C- 9),42.0(C- 14),39.9(C- 8),39.4(C- 19),39.3(C- 20),38.7(C- 1),37.9(C- 4),36.8(C- 10),36.8(C- 17),35.1(C- 22),32.7(C- 7),30.6(C- 21),28.1(C- 23),27.2(C- 2),25.9(C- 15),23.3(C- 11),23.3(C- 16),23.2(C- 27),21.3(C- 30),18.3(C- 6),17.3(C- 29),16.7(C- 26),15.6(C- 24),15.6(C- 25)。以上数据与文献[15]对照基本一致,故化合物8的结构鉴定为uvaol。
化合物9白色粉末(CH3OH);1H NMR(pyridine-d5,400 MHz)δ:4.94(1H,s,H- 29a),4.77(1H,s,H- 29b),3.43- 3.54(2H,m,H- 3,H- 22b),1.79(3H,s),1.22(3H,s),1.07(3H,s),1.05(3H,s),1.01(3H,s),0.82(3H,s)。以上数据与文献[16]对照基本一致,故化合物9鉴定为白桦脂酸。
化合物10无色晶体(CHCl3);1H NMR(pyridine-d5,500 MHz)δ:0.99(3H,s,CH3- 25),1.07(3H,s,CH3- 24),1.09(3H,s,CH3- 26),1.10(3H,d,J= 6.5 Hz,CH3- 30),1.25(3H,s,CH3- 23),1.42(3H,s,CH3- 29),1.70(3H,s,CH3- 27),3.04(1H,s,H- 18),3.38(1H,d,J= 9.2 Hz,H- 3),4.10(1H,ddd,J= 10.5,9.5,4.1 Hz,H- 2),5.57(1H,brs,H- 12)。以上数据与文献[17]对照基本一致,故化合物10鉴定为tormentic acid。
化合物11白色粉末(CHCl3);1H NMR(CDCl3,500 MHz)δ:4.73(1H,s,H- 29a),4.60(1H,s,H- 29b),3.66(3H,s,- OCH3),3.65(1H,m,H- 2),2.98(1H d,J= 9.2 Hz,H- 3),1.68(3H,s,CH3- 30),1.00(3H,s),0.96(3H,s),0.91(3H,s),0.89(3H,s),0.79(3H,s);13C NMR(CDCl3,125 MHz)δ:176.7(C- 28),150.4(C- 20),109.7(C- 30),83.9(C- 3),69.3(C- 2),56.5(C- 17),55.4(C- 5),51.3(- OCH3),50.5(C- 9),49.4(C- 19),47.0(C- 1),46.7(C- 18),42.4(C- 14),40.7(C- 8),39.2(C- 4),38.6(C- 13),38.2(C- 10),36.9(C- 22),34.2(C- 7),32.2(C- 16),30.6(C- 15),29.6(C- 21),28.4(C- 23),25.4(C- 12),21.0(C- 11),19.4(C- 29),18.3(C- 6),17.4(C- 26),16.5(C- 25),16.0(C- 24),14.7(C- 27)。以上数据与文献[18,19]对照基本一致,故化合物11鉴定为alphitolic acid methyl ester。
化合物12白色粉末(CHCl3);1H NMR(600 MHz,CDCl3)δ:6.35(1H,s,H- 1),5.97(1H,s,- OH),5.38(1H,t- like,H- 12),2.52(1H,s,H- 18),2.13(1H,m,H- 11a),2.22(1H,m,H- 11b),1.25(3H,s,CH3- 27),1.23(3H,s,CH3- 25),1.21(each 3H,s,CH3- 23,CH3- 29),1.09(3H,s,CH3- 24),0.94(3H,d,J= 6.6 Hz,CH3- 30),0.80(3H,s,CH3- 26);13C NMR(CDCl3,150 MHz)δ:201.1(C- 3),184.2(C- 28),143.7(C- 2),138.4(C- 13),128.6(C- 1),128.1(C- 12),73.0(C- 19),53.7(C- 5),52.9(18),47.8(C- 17),43.9(C- 4),42.6(C- 9),41.5(C- 10),41.1(C- 20),40.6(C- 18),38.4(C- 8),37.4(C- 22),32.5(C- 7),28.1(C- 15),27.4(C- 23),27.1(C- 29),25.9(C- 21),25.2(C- 16),24.5(C- 27),23.6(C- 11),21.8(C- 24),19.6(C- 25),18.7(C- 6),17.3(C- 30),16.1(C- 26)。以上数据与文献[20,21]对照基本一致,故化合物12鉴定为fupenzic acid。
化合物13无色油状物(CHCl3);1H NMR(CDCl3,500 MHz)δ:5.34(4H,m,H- 9,H- 10,H- 12,H- 13),2.77(2H,m,CH2- 11),2.34(2H,t,J= 7.5 Hz,CH2- 2),2.04(4H,m,CH2- 8,CH2- 14),1.63(2H,m,CH2- 3),1.25(14H,m,7×CH2),0.87(3H,t,J= 6.9 Hz,CH3- 18)。以上数据与文献[22]对照基本一致,故化合物13鉴定为亚油酸。
5 抗菌活性测定
选取15株植物病原真菌(见表1),采用二倍稀释法[23]测定6个单体化合物(1~3、5、8和12)的抗真菌活性。
配制抗菌活性所需的PDB培养基,分装至锥形瓶中,每瓶装入100 mL,高压蒸汽灭菌后晾凉,取保存于4 ℃斜面中的植物病原真菌接种至PDB培养基中,28 ℃,160 rpm振摇培养2天。在超净工作台中操作,取培养好的真菌1 mL加入100 mL PDB培养基中稀释100倍。在96孔板的第一排加入198 μL稀释后的菌液,第二至八排中加入100 μL稀释后的菌液。第一排孔中分别加入样品,阴性对照(二甲基亚砜),阳性对照(酮康唑)2 μL,移液枪抽吸混合均匀后吸取100 μL混合液至第二排,将其混合均匀后吸取100 μL混合液至第三排,后几排操作同上,最后一排吸出的混合液弃去。
结果观察:将处理好的96孔板置于28 ℃的恒温培养箱中培养24、48、60 h后观察活性结果,将最后一排澄清的孔所对应的样品浓度定为该化合物的最小抑菌浓度,结果见表1。
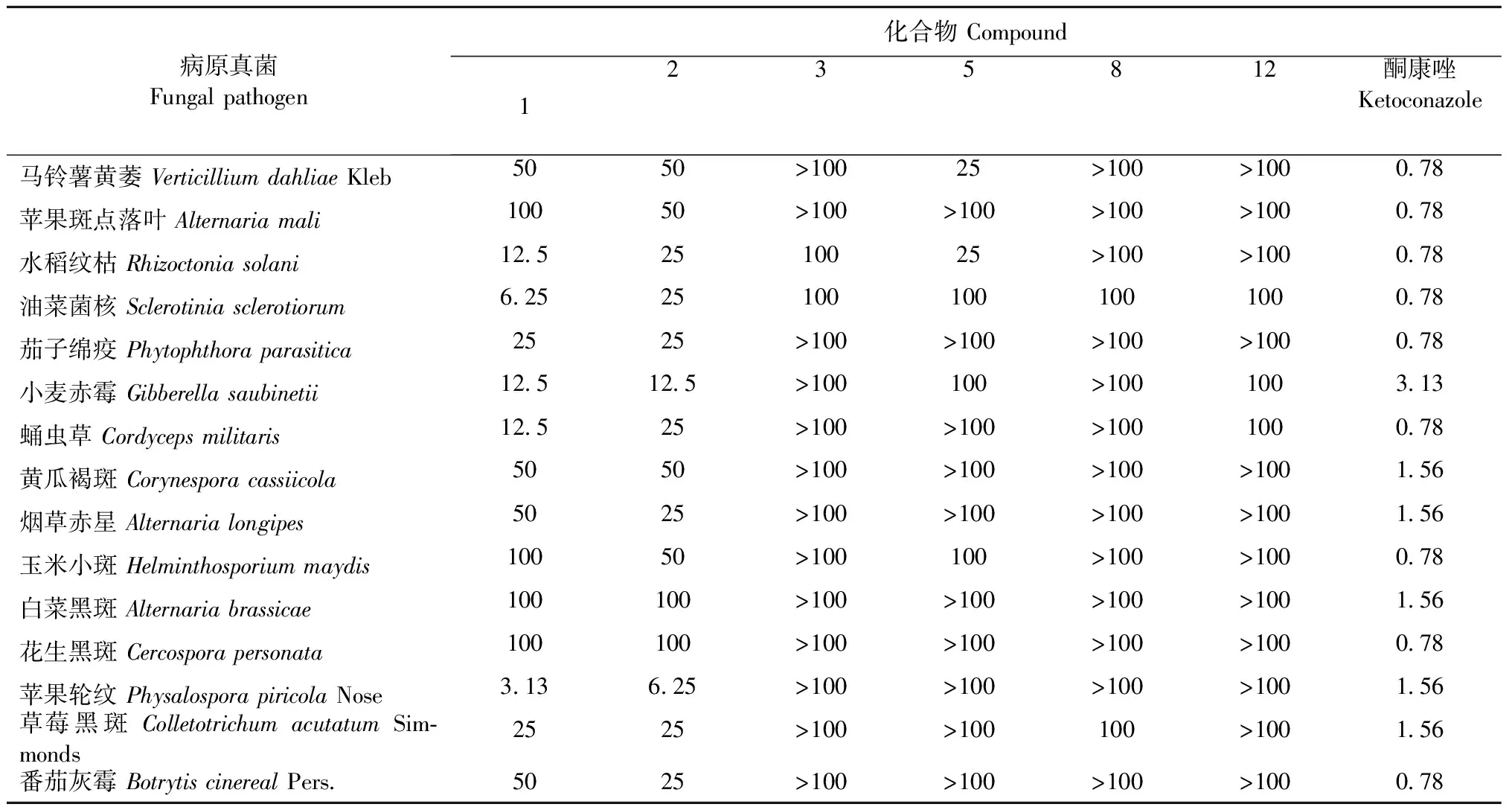
表1 化合物1~3、5、8和12的抗真菌活性(MIC,μM)
6 结论
多种物理、化学、生物胁迫会引起植物体内次生代谢产物积累的增加。利用生物技术手段建立药用植物细胞培养体系并形成生长胁迫环境,有助于从中挖掘更多结构特异、活性显著的抑菌化合物,对药用植物资源深度开发具有重要意义。我们利用前期研究建立的SASC培养体系,以YE作为外加诱导子,形成真菌次生代谢产物对SASC的化学胁迫,并对SASC进行化学成分与抑菌活性研究。从中分离得到13个化合物,包括4个特征性联苯(1~4),1个苯丙酸(5),2个甾体(6和7),5个三萜(8~12)和1个脂肪酸(13)。其中,化合物5~13为首次从SASC中分离得到。选取15株植物病原真菌,采用二倍稀释法测定了6个单体化合物(1~3、5、8和12)的抗菌活性,发现联苯类化合物eriobofuran(1)和4,5- dihydroxy- 3- methoxybiphenyl(2)对苹果轮纹菌具有显著的抑制活性,MIC分别为3.13和6.25 μg/mL。以上研究结果为SASC在抑菌方面的应用提供了理论依据。
