稀有L-糖氟苷的合成❋
2020-01-09丁瀚,王鹏,李明
丁 瀚, 王 鹏, 李 明
(中国海洋大学医药学院海洋药物教育部重点实验室, 山东 青岛 266003)
L-糖存在于多种天然产物和药物中,是组成这些化合物的核心结构,也是其发挥生理活性的重要结构基础。然而,自然界中L-糖的含量很低,商业可得的L-糖也存在价格昂贵的缺点[1-2]。因此,L-糖的高效合成始终是糖化学研究的热点与难点。截至目前,已有多种方法用于合成L-糖砌块[3],但这些路线具有操作复杂,步骤冗长,或环境不友好,难以用于构建稀有L-糖骨架等缺点。
氟苷是一类重要的糖基给体,不仅易于保存,而且能在温和的条件下被活化,与亲核试剂反应用于构建各种糖苷键[4]。截至目前,L-糖氟苷的合成与应用主要局限于L-岩藻糖氟苷等糖[5],这些糖在自然界中以L-糖为主;而天然存在稀少的L-葡萄糖,L-甘露糖等L-糖氟苷在此前均无报道。因此,本文以烷氧自由基的β-裂解(AOF, alkoxy radical β-fragmentation)氟化反应关键方法,采用“头尾翻转”策略[6]发展一条简洁、高效可用于构建复杂的稀有L-糖氟苷。
1 实验部分
1.1 主要实验仪器及试剂
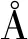
1.2 化合物的合成
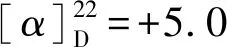
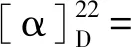
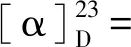
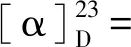
1.2.5 化合物2,3,4-三-O-苯甲酰基-6,8-二-脱氧-7-氧代-L-葡萄八碳糖氟苷 (3a) 将化合物2a(100 mg,0.19 mmol,1.0 equiv)溶于丙酮/水(v/v=6/1,3.5 mL)中,依次向溶液中加入碳酸银 (26 mg,0.09 mmol,0.5 equiv)和Selectfluor®(333 mg,0.94 mmol,5.0 equiv),反应体系重复抽真空—氩气置换步骤3次,反应液在室温下剧烈搅拌1 h,过滤除去银盐。将滤液倾入水中,水相用二氯甲烷萃取。合并并用无水硫酸钠干燥有机相,过滤。浓缩滤液后残余物经硅胶柱层析(石油醚∶乙酸乙酯 =6∶1)纯化得到白色泡沫状化合物3a(76 mg,0.15 mmol,78%,α∶β=3∶1)。3aα:1H NMR (500 MHz,CDCl3)δ7.97—7.96 (m,2H),7.92—7.91 (m,2H),7.83—7.81 (m,2H),7.52—7.23 (m,9H),6.14 (t,J=10.0 Hz,1H),5.91 (d,JH-F=52.8 Hz,1H),5.48 (t,J= 10.0 Hz,1H),5.33 (ddd,J=10.3,2.3,Hz,JH-F=23.6 Hz),4.80 (m,1H),2.85 (dd,J=16.7,8.8 Hz,1H),2.70—2.64 (m,1H),2.16 (s,3H);13C NMR (126 MHz,CDCl3)δ204.3,165.8,165.6,133.8,133.4,130.1,130.0,129.8,129.0,128.8,128.7,128.6,128.5,103.8 (JC-F=230.9 Hz),71.5 (JC-F=24.7 Hz),71.3,69.7,68.5 (JC-F=3.9 Hz),45.0,30.9;19F NMR (470 MHz,CHCl3)δ-149.2 (dd,J=52.7,23.6 Hz,1F); HRMS (ESI)m/zCalcd for C29H29O8NF[M+NH4]+538.1872,found: 538.1865. 3aβ:1H NMR (500 MHz,CDCl3)δ7.97—7.96 (m,2H),7.92—7.91 (m,2H),7.83—7.81 (m,2H),7.52—7.23 (m,9H),5.83 (t,J=9.2 Hz),5.60 (dd,J=6.2 Hz,JH-F=52.9 Hz,1H),5.55 (t,J=11.2 Hz,1H),5.48 (m,1H),4.54 (m,1H),3.00 (dd,J=17.2,8.9 Hz,1H),2.70—2.64 (m,1H),2.16 (s,3H); 204.4,165.6,165.6,165.1,133.7,133.5,130.0,129.9,129.0,128.8,128.6,128.5,106.8 (JC-F=219.8 Hz),71.9 (JC-F=24.1 Hz),71.1,70.4 (JC-F=4.5 Hz),68.8,45.3,31.2;19F NMR (470 MHz,CHCl3)δ-137.8 (dd,J=50.8,10.5 Hz,1F); HRMS (ESI)m/zCalcd for C29H29O8NF[M+NH4]+538.187 2,found: 538.186 5。
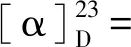
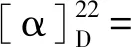

2 结果与讨论
本文通过5-氟-β-吡喃糖碳苷的“头尾翻转”实现L-糖氟苷的合成。此氟代糖可由(-吡喃糖碳苷伯羟基的烷氧自由基β-裂解(AOF)氟化反应生成(见图1)。
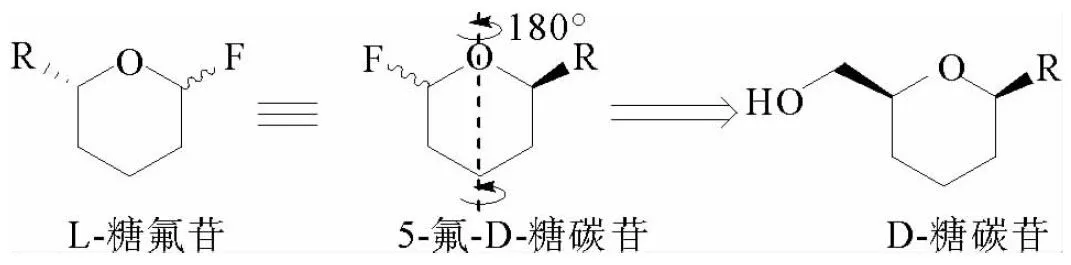
图1 稀有L-氟苷的合成设计Fig. 1 Design of synthesizing rare L-glycosyl fluorides
首先,合成了6位羟基裸露的β-吡喃糖碳苷(见图 2)。葡萄糖丙酮碳苷1经选择性硅基保护6位,2,3,4位苯甲酰化后用TBAF脱除硅基得到化合物2a。全乙酰半乳糖丙酮碳苷3及氰苷4在[(t-Bu)2SnCl(OH)]2催化下,发生酯交换反应脱除6位保护基分别得到2b及2c。全乙酰化半乳糖醇5在甲醇钠的催化下脱除乙酰基,用三苯甲基(Tr)选择性保护伯羟基后将2,3,4位苯甲酰化,随后脱除三苯甲基保护基,以三步41%的收率得到化合物2d。
完成化合物2a-d的制备后,开始利用AOF氟化反应制备L-糖氟苷(见图3)。经过条件筛选,以得到的最优条件,即在银盐的促进下,以Selectfluor®为氧化剂及氟源,2a在丙酮/水中能够发生反应以78%的收率及3∶1的非对映选择性得到氟代糖3a,即L-葡萄八碳糖氟苷。2b-c同样高收率地转化为L-甘露八碳糖3b及5-氰基-L-来苏吡喃糖3c。标准条件下,2d以78%的收率也可以单一地得到L-来苏糖氟苷。2b-2d均为半乳糖碳苷,这些化合物经AOF氟化反应后生成单一构型的产物可能是其4位直立键保护基的类高异头位效应(Quasi homo anomeric effect)导致的[11]。以2a的转化为例,提出了如下反应机理:一价银被Selectfluor®氧化为二价银,该高价银盐与底物2a中的伯羟基发生配位生成二价烷氧基银I,随后该中间体的氧银键自发断裂生成烷氧自由基II,同时将银盐还原为一价。II随后发生AOF反应被转化为吡喃糖自由基III,该自由基与Selectfluor®发生自由基氟化反应生成氟代糖,此氟代糖通过“头尾翻转”旋转180°即可当作L-八碳葡萄糖氟苷3b。
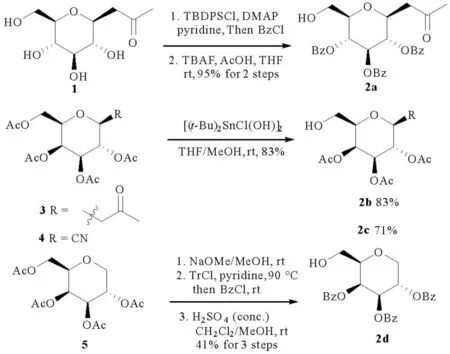
图2 6位裸露吡喃糖的合成Fig. 2 Synthesis of D-pyranosides with 6-OH liberated
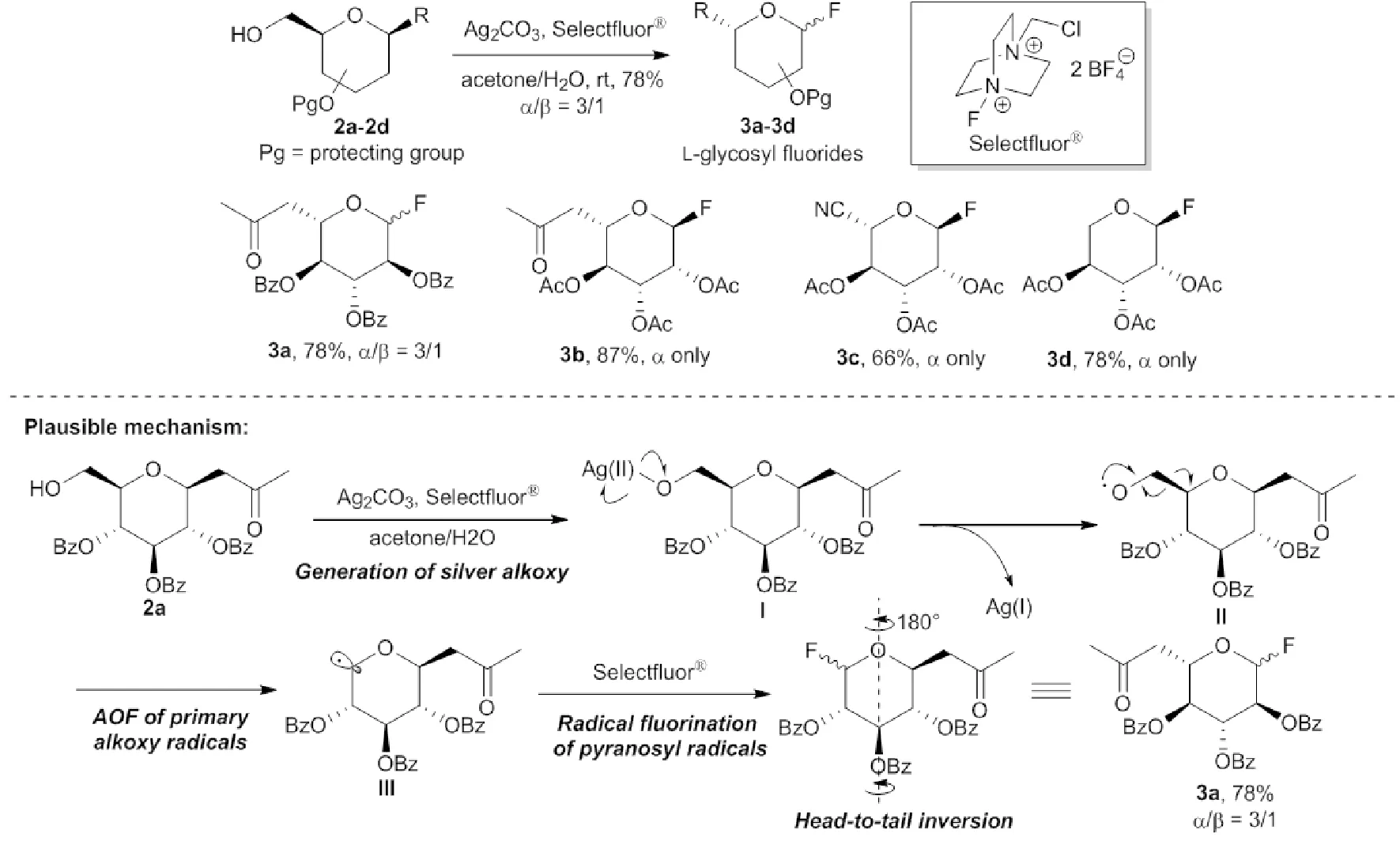
图3 L-糖氟苷的合成及反应机理Fig. 3 Synthesis of L-glycosyl fluorides and plausible mechanism
3 结语
本文分别以6位伯羟基裸露的葡萄糖、半乳糖及半乳糖醇碳苷通过AOF氟化反应,采用“头尾翻转”策略成功地合成稀有L-葡萄糖氟苷,L-甘露糖氟苷及L-来苏糖氟苷,为此类化合物的制备提供了新颖手段,同时为其进一步的生理活性及应用研究奠定了坚实基础。
