多孔芳香骨架负载二氧化锡锂电负极的制备与性能
2020-01-08赵永男王祉健董正洪黄志强
赵永男 ,王祉健 ,董正洪 ,王 骞 ,黄志强
(1.天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387;2.天津工业大学 材料科学与工程学院,天津 300387;3.天津中材工程研究中心有限公司,天津 300400)
便携式电子设备、无人机、电动汽车的快速发展,对锂离子电池的容量提出了更高的要求,因而传统的石墨负极(容量为372 mA·h/g)越来越难以满足人们的需求[1]。负极作为锂离子电池重要的组成部分,对锂离子电池容量影响巨大,TiO2[2]、MnO2[3]、Fe2O3[4]、SnO2[5]等金属氧化物负极材料具有较高的理论容量,近年来引起广泛研究。其中,SnO2具有成本低、环境友好、理论比容量高、工作电压平台低等特点,在众多候选材料中脱颖而出[6]。SnO2负极在充放电过程中主要涉及以下两个电化学反应[7]:

微米级SnO2的第一步反应被认为是不可逆的,无法贡献容量,第二步反应可逆从而可以提供容量,因此理论容量为 780 mA·h/g[8]。近年来,Kim 等[9]发现,电池的容量随着SnO2颗粒尺寸的缩小有上升趋势。Zhou等[7]发现,当SnO2的颗粒尺寸小于2 nm 时,第一步反应变为可逆,SnO2的理论容量提高至1 494 mA·h/g。
Sn 与Li+反应生成为LixSn 时体积会发生明显的变化(358%)[9],导致SnO2在电化学反应过程中发生破裂与粉化,材料表面生成额外的固体电解质界面膜(SEI),使SnO2负极的循环稳定性变差、库伦效率降低[7-10]。降低 SnO2颗粒尺寸,如制备 SnO2纳米粒子[9]、纳米线[12]、纳米球[13]等,能明显缓解体积膨胀并缩短电子和锂离子的迁移距离[14],提高循环稳定性。将SnO2制成多孔或中空结构,较大的内部空间也可以缓解体积变化引起的问题[15-16]。虽然减小SnO2的颗粒尺寸能有效提高其循环稳定性,但是在电化学反应过程中纳米级的Sn微粒依然会团聚成较大且无活性的Sn 颗粒[9,11]。利用碳纳米管[17]、多孔碳[18]、石墨烯[19]等碳材料与 SnO2复合,可以缓解充放电过程中的体积膨胀,同时可以显著改善SnO2的导电性。
近年来,由于有机多孔材料的孔结构和孔壁功能基团的可设计性、低密度、高比表面积、永久孔隙率、热稳定性好、耐化学溶剂等特点,使其在气体吸附、气相分离、催化、储能等领域具有广泛的应用前景[20]。本文选用多孔芳香烃骨架(PAF-41)负载SnO2,其单分散的纳米孔道(2.0 nm)可限制SnO2的生长并有效抑制充放电过程的粉化团聚,同时改善SnO2的导电性,提高其电化学性能。
1 实验部分
1.1 试剂与仪器
试剂:三氯甲烷(CHCl3)、氯化铝(AlCl3)、三苯基胺(C18H16N)和氯化亚锡二水合物(SnCl2·2H2O),均为分析纯,上海阿拉丁有限公司产品;聚偏氟乙烯(PVDF)、N-甲基吡咯烷酮(NMP),均为分析纯,天津市科密欧试剂化学有限公司产品;高纯锂片,天津中能锂业有限公司产品。
仪器:D8 ADVANCE 型 X 射线衍射仪(XRD),Cu-Kα 射线,λ =0.154 06 nm,德国 Bruker 公司产品;HitachiS-4800 型扫描电子显微镜,日立公司产品;LAND CT2001A 型蓝电电池测试系统,武汉兰德电子有限公司产品;AUTOLAB PGSTAT302N 型电化学工作站,测试频率范围为10-1~105Hz,瑞士万通公司产品;STA-409PC 热重分析仪,德国耐驰公司产品。
1.2 样品的合成
按照 AlCl3和 C18H15N 摩尔比 5 ∶2 称取 2.5 g AlCl3与1.835 g C18H15N,分别溶解在200 mL CHCl3与100 mL CHCl3中,期间尽量避免与空气接触,之后密封静置。将溶解2.5 g AlCl3的CHCl3溶液转移至烧瓶中,在80 ℃下加热回流3 h。随后缓慢滴加C18H15N 的CHCl3溶液,在80 ℃下继续反应24 h。反应结束后,当温度降到室温,用1 mol/L 的盐酸、甲醇、丙酮清洗得到的粗产品,除去未反应的单体和催化剂。产物PAF-41 在100 ℃真空干燥12 h。
取200 mg PAF-41 分散在250 mL CHCl3溶液中,加入适量HCl 控制溶液pH 值为2 后超声10 min,之后加入2.5 g SnCl2继续超声4 h,期间温度保持为室温,避免与空气接触。过滤后用蒸馏水洗涤3 次、乙醇洗涤1 次,然后将样品在60 ℃真空干燥12 h。所得样品于550 ℃在氩气气氛下热处理2 h,得到最终产物SnO2/PAF-41。
1.3 电化学测试
以 NMP 为溶剂,将质量比为 8 ∶1 ∶1 的 SnO2/PAF-41、乙炔黑、PVDF 混合并研磨均匀成糊状。将糊状物均匀涂覆于集流体铜箔上,首先在60°C 常压下干燥2 h,之后在60°C 真空中干燥12 h 以完全除去NMP。用冲片机加工成直径为16 mm 的工作电极。以LiPF6(1.0 MEC ∶DMC ∶DEC=1 ∶1 ∶1)为电解液,锂片为正极,组装CR2430 型扣式电池,采用LAND CT2001A 型电池测试仪进行恒流充放电测试,电压测试范围为0.01~3 V。循环伏安测试(CV)由CHI 660D 型电化学工作站完成,扫描速率为0.05 mV/s。
2 结果与讨论
2.1 结构与形貌分析
材料的比表面积通过低温N2吸脱附方法测定,孔径分布由Density Functional Theory 模型计算得出。图1给出了PAF-41 和SnO2/PAF-41 复合材料的氮气吸脱附等温线和孔径分布图。
从图 1(a)中可以看出,2 个样品在 P/P0=0.1 之前吸附量急剧上升,表明材料都存在大量的微孔结构,且两者都属于I 型吸附曲线。PAF-41 在吸附曲线和脱附曲线之间存在明显的滞后环,表明材料中还存在大量的介孔,PAF-41 的比表面积为513 m2/g,总孔容为0.3 cm3/g,高的比表面积与大量的介孔能更好地分散SnO2以及可以给SnO2反应提供足够的反应空间。SnO2/PAF-41 复合材料的比表面积为320 m2/g,总孔容0.27 cm3/g,与未负载的PAF-41 相比比表面积降低了193 m2/g,降低百分比为37.6%,孔容降低了0.03 cm3/g,降低百分比为10%,比表面积降低的幅度远高于孔容降低的幅度。负载SnO2后的吸附曲线与脱附曲线之间的滞后环明显变小,介孔数量有所降低,表明负载SnO2之后的PAF-41 中大多数介孔被SnO2填充,并且SnO2存在于PAF-41 孔道中的同时也保留了一部分的空间,这有利于缓解反应过程中SnO2的体积效应。由图1(b)可见,PAF-41 的孔径分布显示为3 个峰值,分别位于1.7 nm、1.9 nm 和2.2 nm 处,特殊的分级多孔结构对SnO2负极材料具有非常积极的意义,这种介孔与微孔共存的分级多孔结构有利于SnO2的分散,也能在反应中保护SnO2微粒减缓体积效应与防止活性单质Sn 的团聚,同时微孔能够提供电化学反应界面,从而实现SnO2的高效利用。SnO2/PAF-41 的孔径主要分布位于1.0 nm 附近,表明SnO2主要分散到介孔中,而PAF-41 中仍存在大量微孔,有利于电化学反应。

图1 PAF-41 和SnO2/PAF-41 复合材料的氮气吸脱附曲线Fig.1 N2 sorption isotherm of PAF-41 and SnO2/PAF-41 composites
图2 为经过热处理的PAF-41 与经过同样热处理的SnO2/PAF-41 复合材料的XRD 图谱。

图2 PAF-41 和SnO2/PAF-41 复合材料的XRD 图谱Fig.2 XRD pattern of PAF-41 and SnO2/PAF-41 composites
由图2 可以看到,PAF-41 仅在20°附近出现一个宽化的衍射峰,表明PAF-41 为非晶结构。SnO2/PAF-41 复合材料的衍射谱图与四方金红石结构的SnO2标准谱图峰位一致(JCPDS 标准卡片No.41-1445),在26.5°、33.7°、37.2°、51.9°、65.4°处的 5 个较强的衍射峰,分别对应 SnO2 的 (110)、(101)、(200)、(211)和(301)晶面。550°C 热处理后的复合材料与经过同样处理的PAF-41 的热重分析结果如图3 所示。

图3 PAF-41 和SnO2/PAF-41 复合材料的TG 曲线Fig.3 TG curves of PAF-41 and SnO2/PAF-41 composites
由图3 可知,空气气氛中,热处理后的PAF41 在600 ℃会被完全氧化形成CO2与H2O,载锡后的复合材料在700 ℃时的残留物质全部为SnO2,可以得出热处理后的PAF-41/SnO2复合材料中SnO2的质量分数为20%。由于在聚合反应过程中,取代反应并不是都发生在中心原子的对位上,可能在中心原子的邻位上,或者间位上也有取代反应发生,而这些杂乱无序的取代反应便导致了结构上的无序性,在TG 曲线中的质量下降不仅是碳的损失,因此复合材料中的碳含量无法准确得出。
为了研究PAF-41 及SnO2/PAF-41 复合材料的微观形貌,分别对其进行了SEM、TEM 和HRTEM 表征。图4 为PAF-41 与SnO2/PAF-41 复合材料的SEM 图像。

图4 PAF-41 和SnO2/PAF-41 复合材料的SEM 图像Fig.4 SEM images of PAF-41 and SnO2/PAF-41 composites
由图 4(a)得知,PAF-41 为类球形结构,粒径大多在1 μm 左右,虽然部分颗粒之间存在粘连现象,但整体分散性良好。由图4(b)可以看出,负载了SnO2的PAF-41 与PAF-41 本身没有太大差别,SnO2微粒也没有在颗粒外表面团聚,表明在洗涤过程中已充分除去表面吸附的锡离子。
图5 为SnO2/PAF-41 复合材料的TEM 图像。

图5 SnO2/PAF-41 复合材料的TEM 图像Fig.5 TEM images of SnO2/PAF-41 composites
从图 5(a)可以看出,SnO2/PAF-41 表面光滑,没有大颗粒SnO2吸附在表面。由图5(b)HRTEM 中可以看到PAF-41 材料本身具备发达的孔隙结构,这与N2吸脱附测试结果一致。由图5(c)能清晰地看到间距为0.3411 nm 的晶格条纹,对应 SnO2的(110)晶面,PAF-41 内未发现较大的SnO2颗粒以及团聚现象,HRTEM的结果表明SnO2颗粒尺寸受孔道限制作用而小于10 nm,分散性良好。
2.2 电化学性能分析
SnO2/PAF-41 电极的CV 曲线如图6 所示。
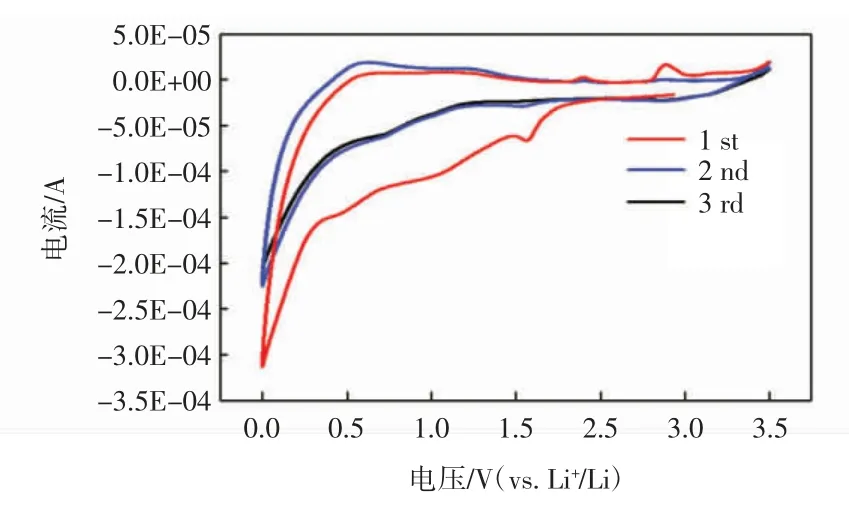
图6 SnO2/PAF-41 复合负极材料的CV 曲线Fig.6 The CV profiles of SnO2/PAF-41 composites
由图6 可以看出,与Zhou 等[18]制备的纳米级SnO2CV 曲线类似,SnO2/PAF-41 复合材料第1 周的还原曲线在0.75 V 附近出现还原峰,1.5 V 附近的还原峰对应 SnO2与 Li 反应并转化为 Sn 与 Li2O,0.5 V 处的宽峰对应Sn 与Li 形成LixSn 的合金化反应。0.5 V 处的氧化峰对应LixSn 的去合金化,1.25 V 处较弱的氧化峰对应的为Li2O 与Sn 反应形成SnO。与首周循环伏安曲线相比,在第2 周、第3 周的还原峰有明显的衰弱,其中1.5 V 处的还原峰几乎消失,表明SnO2形成Sn 与Li2O 的反应非常微弱,而0.5 V 时Sn 与 Li 形成LixSn 合金化反应的峰则移动到了0.75 V 附近。第2 周的氧化峰没有发生偏移与减弱,而0.5 V 处的去合金化与1.25 V 处的氧化峰强度有所增加,这表明了复合材料中SnO2与Li2O 的反应在一定程度上可逆。首周不可逆的部分为电解液在PAF-41 表面分解形成固体电解质界面膜以及SnO2与Li 发生部分不可逆的转化反应。首次循环后,还原峰的峰面积有一个较大的减少,而第2 周、第3 周还原峰电位变化非常小,这意味着电池系统趋于一个平衡状态,与典型的SnO2CV曲线不同,典型的纳米SnO2电极在第2 圈、第3 圈还原峰的峰面积依然有较明显的衰减,其还原峰电位也在变化,系统需要循环一定的次数才能趋于平衡。复合电极材料的CV 曲线在第1 周与第2 周发生较大的变化,其中一部分可能是PAF-41 作为多孔材料而产生的赝电容所导致的,这种现象使得还原峰在第1 圈与第2 圈有较大的变化,在第2 圈之后这种影响会大幅度降低。
图 7 为电流密度为 0.2 A/g 下 PAF-41 和 SnO2/PAF-41 复合材料的循环性能图。
由图 7(a)可见,SnO2/PAF-41 复合材料在第 1 次循环后容量衰减很大,首次库伦效率仅为55%。由前5次充放电曲线可以看出,复合材料的电压平台在缓缓降低,同时伴随电池容量的显著下降,而超过100 次循环后,复合电极材料的电压平台逐渐升高,放电平台增大,同时容量也有所上升。与典型SnO2电极的充放电曲线相比,典型SnO2电极的电压平台不明显,并且随着循环的进行,电池性能不断下降,电压平台降低的同时也在缩短。由图7(b)可见,与SnO2/PAF-41的循环曲线类似,热处理后的纯PAF-41 的首次库伦效率只有21%,表明SnO2/PAF-41 首圈容量损失除了SnO2转化反应的不可逆性、形成SEI 膜以外,PAF-41带来的赝电容也会导致首次库伦效率降低。容量的衰减只发生在前几次循环中,而在随后的循环中,PAF-41 电极材料的容量基本保持稳定,而SnO2/PAF-41 复合材料的容量在不断的提升。5 次循环后,PAF-41 容量稳定在125.7 mA·h/g 附近,无明显衰减。SnO2/PAF-41 的容量在初始的10 圈循环不断降低,在第10 圈达到最低值323.7 mA·h/g,随后容量缓慢上升,70 次循环后逐渐稳定,并在130 次循环达到了734.3 mA·h/g,在此期间作为参照物的PAF-41 的容量并没有发生明显的变化。容量的上升归因于PAF-41 结构以及疏水的性质,导致电解液浸润不完全,在PAF-41 内有部分SnO2没有接触到电解液,随着循环进行,这些SnO2逐渐被活化参与反应,容量因此提升。由图7(c)的长循环曲线可见,这种情况依然存在,SnO2/PAF-41 在0.2 A/g 的电流密度下进行循环测试,首次放电容量为1411.2 mA·h/g,首次库伦效率为55%,经过50 次循环后容量能稳定在400 mA·h/g 以上,超过300 次循环后,其容量依然能保持上升趋势,并逐渐升高至618.9 mA·h/g,远高于商业化的碳负极。同样在循环刚开始时因为电解液未能浸润完全,有一部分SnO2未参与反应,但SnO2/PAF-41 复合材料在长时间循环中能保持结构稳定,这些未参与反应的SnO2也在后期的循环中逐渐被活化,而能达到在较长时间内容量不减反增。
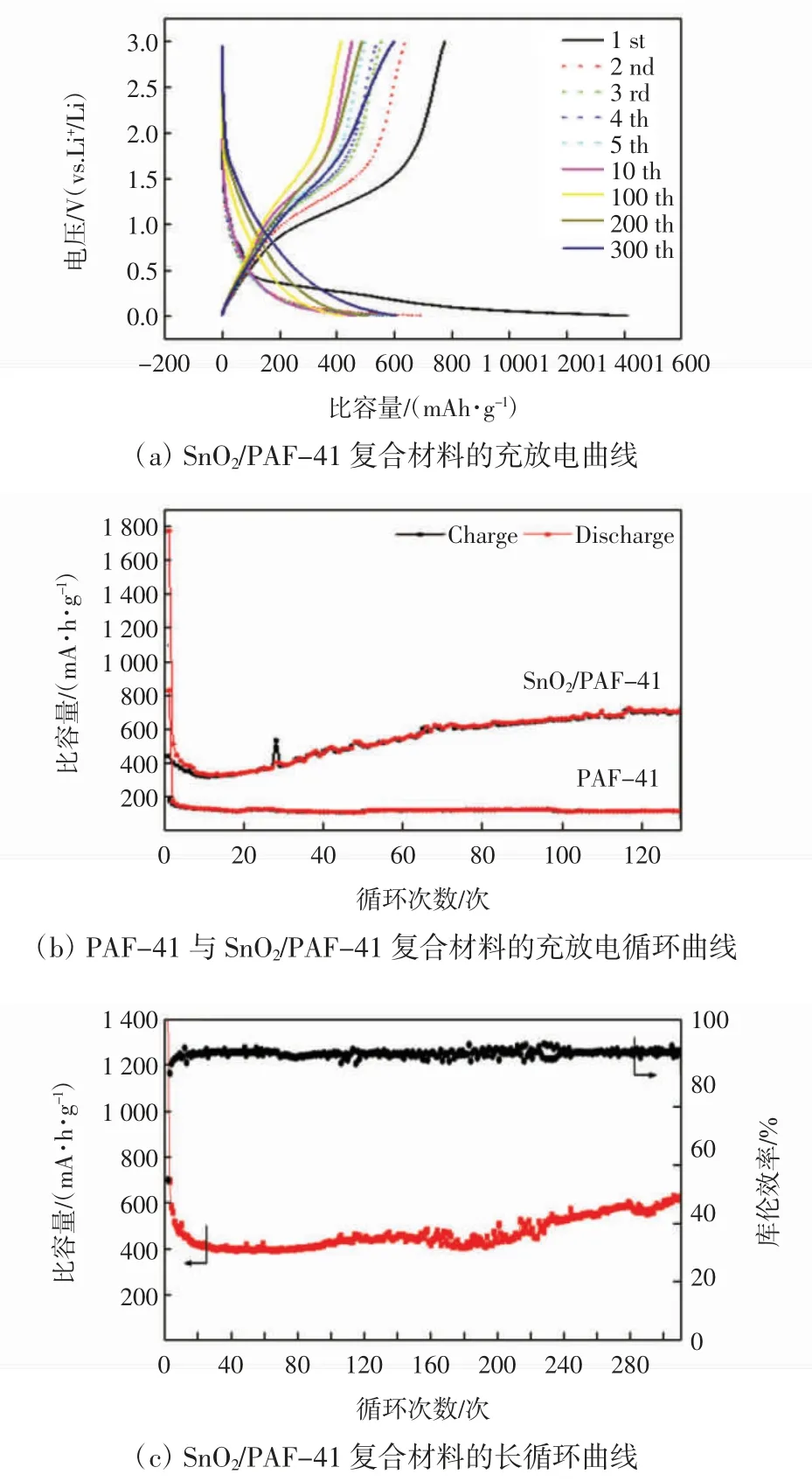
图7 PAF-41 和SnO2/PAF-41 复合材料的循环性能图Fig.7 Cycling performance of PAF-41 and SnO2/PAF-41 composites
为进一步研究SnO2/PAF-41 复合材料电极的循环稳定性,对其在不同电流密度下进行了测试,倍率性能结果如图8 所示。

图8 SnO2/PAF-41 复合材料的倍率性能Fig.8 Rate capability of SnO2/PAF-41 composites
由图8 可见,充电电流范围为0.1 A/g 到2.0 A/g之间,随着电流密度的增大,电池的比容量逐渐减小。在0.1 A/g 电流密度下的前10 圈,比容量衰减较为严重,但是在接下来的每个电流密度下的循环都比较平稳,这是由于PAF-41 作为多孔材料的赝电容的衰减与部分表面的SnO2微粒在循环过程中粉化、团聚以及形成额外的SEI 膜。电流密度在0.1 A/g 下稳定后的放电比容量为536 mA·h/g,电流密度逐渐增加到2.0 A/g 时,复合材料仍保持有352.5 mA·h/g 的比容量。经过50圈的循环,电流密度重新回到0.1 A/g,电池的比容量也能够回到493 mA·h/g,电流密度再次增大到0.2 A/g,继续循环到100 圈时,电极比容量也能稳定在485.6 mA·h/g。整个循环过程中库伦效率始终接近100%,测试结果表明SnO2/PAF-41 复合材料具有良好的倍率性能。
3 结论
以三苯胺作为结构骨架,采用简单的聚合反应制备了比表面积大和具有多级分孔的多孔芳香骨架PAF-41。负载后得到SnO2质量分数为20%的复合负极材料,由于孔道限制作用,SnO2粒径控制在10 nm以内且均匀分布均,在PAF-41 中分散良好。电化学测试结果表明,SnO2/PAF-41 复合材料具有优异的倍率性能与循环稳定性。在0.2 A/g 电流密度下循环超过300 圈后,容量依然能保持618.9 mA·h/g,库伦效率接近100%。
