ABCB1和CYP2C19基因多态性与动脉粥样硬化性脑梗死患者氯吡格雷疗效的相关性
2020-01-08李笑笑吕佳宁吴旭青
李笑笑,吕佳宁,吴旭青,范 薇
复旦大学附属中山医院神经内科,上海 200032
缺血性脑卒中严重威胁人类身心健康,并且其发病趋势逐年递增,尽早开始抗血小板治疗(包括阿司匹林和氯吡格雷)不仅能显著降低病死率和残疾率,而且可减少缺血性脑卒中复发[1-3]。有研究[4]表明,在缺血性脑血管病二级预防中,氯吡格雷疗效更佳,尤其适用于不能耐受阿司匹林及合并其他基础疾病的患者。然而,有一部分患者即使长期规律服用氯吡格雷,仍会再次出现缺血性脑卒中及其他不良缺血性事件[5],这种现象被称为“氯吡格雷抵抗(clopidogrel resistance,CR)”。基因多态性是参与氯吡格雷抵抗的重要因素,2011年美国心脏病学会/美国心脏协会/美国心血管造影与介入学会指南提出使用氯吡格雷应当进行基因型的检测[6]。
氯吡格雷是无活性的前体药物,首先经过胃肠道吸收(受到由多重耐药基因ABCB1编码的P-糖蛋白调控)[7],经肠道吸收的氯吡格雷85%被酯酶水解为无活性的羧酸衍生物排出体外,仅15%在肝脏内经过细胞色素P450(cytochrome P450,CYP450)酶系代谢为有活性的硫醇衍生物[8]。氯吡格雷在肝脏内需要经过CYP450酶系统的两步氧化代谢为活性代谢产物,其中CYP2C19在两步氧化代谢中均发挥了重要作用[9]。CYP2C19失功能等位基因携带者中氯吡格雷活性代谢产物浓度显著降低,且氯吡格雷的血小板抑制作用减弱[10]。因此,故ABCB1及CYP2C19基因突变是氯吡格雷抵抗的预测因子[11-12]。多项针对接受氯吡格雷治疗的急性冠脉综合征患者的研究显示ABCB1基因突变及CYP2C19失功能等位基因突变使不良缺血事件发生风险增加[13-15],而根据ABCB1及CYP2C19基因型制定个体化的精准抗血小板治疗方案有助于减少不良缺血事件的发生[16-17]。
既往ABCB1及CYP2C19基因型在氯吡格雷的临床应用研究大多集中在急性冠脉综合征患者,而在缺血性卒中方面的研究还相对较少。也有少量研究显示在服用氯吡格雷治疗的缺血性脑卒中患者中,ABCB1基因突变与氯吡格雷抵抗发生并无相关性[18],甚至可能减少不良血管事件的复发[19];而CYP2C19失功能等位基因携带者发生早期神经功能恶化、缺血性脑卒中及混合血管事件复发的风险更高[20-21]。但是,目前尚缺少在缺血性脑卒中尤其是针对动脉粥样硬化性脑梗死患者中同时检测ABCB1及CYP2C19基因型对氯吡格雷疗效影响的研究。因此,本研究探讨在急性动脉粥样硬化性脑梗死患者中,不同ABCB1和CYP2C19基因型对氯吡格雷疗效的影响,从而为患者的个体化用药提供试验依据。
1 资料与方法
1.1 一般资料 前瞻性收集2014年4月至2016年9月在复旦大学附属中山医院神经内科住院治疗的急性动脉粥样硬化性脑血栓形成患者,收集患者的一般临床资料,包括年龄、性别、既往史等。
纳入标准:(1)年龄≥18岁;(2)经头颅CT或MRI证实的脑梗死,诊断符合第四次全国脑血管病学术会议修订的脑梗死诊断标准[22];(3)发病1周内,既往无服用氯吡格雷史;(4)符合新TOAST分型中的动脉粥样硬化性血栓形成型[23];(5)确诊后即开始持续服用氯吡格雷75 mg/d,且≥7 d。
排除标准:(1)服用其他可能影响药物(如华法林、贝前列素钠、利伐沙班、奥扎格雷、西洛他唑、质子泵抑制剂等);(2)具有明确的抗凝治疗指征(已知的人工心脏瓣膜、房颤或其他需要抗凝的心脏疾病等);(3)围手术期出现的缺血性卒中;(4)合并肿瘤、颅内出血、颅内血管畸形、颅内脓肿以及非缺血性脑部疾病;(5)合并有严重的其他可能明显影响治疗和预后的严重急慢性疾病,如心梗、严重肾功能不全、痴呆、精神疾病等。
患者入组后开始服用氯吡格雷75 mg/d,并于服用氯吡格雷7 d后在患者知情同意的情况下,采集外周静脉血1次,按实验要求处理标本,分别行血栓弹力图及ABCB1和CYP2C19基因型检测。
1.2 基因型检测 利用聚合酶链式反应技术分析患者ABCB1、CYP2C19基因型,采用基因检测试剂盒(苏州旷远生物分子技术有限公司)通过荧光探针法直接检测突变位点,通过是否表达标记的荧光来判断基因型。本研究检测的CYP2C19基因位点包括*1/*1(636GG,681GG)、*1/*2(636GG,681GA)、*1/*3(636GA,681GG)、*2/*2(636GG,681AA)、*2/*3(636GA,681GA)和*3/*3(636AA,681GG)。根据CYP2C19的基因位点分为3组:快代谢型(*1/*1)、中代谢型(*1/*2和*1/*3)、慢代谢型(*2/*2、*2/*3和*3/*3)。本研究检测的ABCB1基因位点是C3435T,根据ABCB1基因位点分为野生型和突变型。
为了进一步分析ABCB1与CYP2C19两种基因联合突变对氯吡格雷疗效的影响,根据突变基因数量,将入组患者分为A、B、C组,分组标准如下,A组:ABCB1、CYP2C19基因均无突变;B组:ABCB1或CYP2C19基因发生突变;C组:ABCB1和CYP2C19基因均发生突。
1.3 血栓弹力图检测 利用血栓弹力图仪(TEG5000,Haemoscope,美国)采用不同的激活剂来检测其血小板纤维蛋白凝块强度,阿司匹林和氯吡格雷分别是通过花生四烯酸(AA)通道和二磷酸腺苷(ADP)通道来起作用的。血栓弹力图首先使用高岭土激活凝血酶,由于凝血酶的通道受阿司匹林和氯吡格雷的影响比较小,故可以通过这个通道近似地体现出患者所有的血小板纤维蛋白凝块的功能(MA凝血酶)。AA/ADP激活剂,可以分别激活没有被阿司匹林或氯吡格雷抑制的血小板和纤维蛋白,从而得出没有被阿司匹林或氯吡格雷抑制的血小板和纤维蛋白的功能(MAADP(AA))。A激活剂仅激活纤维蛋白,得出纤维蛋白原的功能(MA纤维蛋白原)。通过这3个值,即可按以下公式计算出患者用药后的抑制率。
1.4 神经功能评估 所有患者均在入院时及服用氯吡格雷7 d后进行神经系统功能评分,包括美国国立卫生研究院卒中量表(NIHSS)及改良Rankin量表(mRS),各量表评分的变化反映神经功能缺损症状的改善或加重。
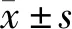
2 结 果
2.1 基线资料 共纳入115例符合入选标准的患者,基线资料包括年龄、性别、体质指数(body mass index,BMI)、吸烟、饮酒、合并高血压、糖尿病、高脂血症、卒中史、NIHSS评分(入院时及服药7 d后)、mRS评分(入院时及服药7 d后),结果详见表1。

表1 研究对象的基线资料
2.2 各组均衡性比较
2.2.1 不同CYP2C19基因型患者基线数据的比较 按照CYP2C19基因型对入组患者进行分组,快、中、慢代谢型患者分别有46例、48例(其中*1/*2 40例,*1/*3 8例)、21例(其中*2/*2 18例,*2/*3 3例)。3组患者的基线资料包括平均年龄、性别、BMI、吸烟、饮酒、合并高血压、糖尿病、高脂血症、卒中史、NIHSS评分(入院时及服药7 d后)、mRS评分(入院时及服药7 d后)及他汀类药物的使用所占比例差异均无统计学意义(P>0.05),具体数据详见表2。

表2 不同CYP2C19基因型患者基线数据的比较
2.2.2 不同ABCB1基因型患者基线数据的比较 根据ABCB1基因型对入组患者进行分组,其中野生型49例,突变型66例。结果(表3)表明:两组患者基线数据差异无统计学意义。

表3 不同ABCB1基因型患者基线数据的比较
在入组的115例患者中,ABCB1野生型49例,突变型66例(表4)。
2.3 不同组别患者抗血小板药物抑制率、血小板功能(MAADP)及神经功能的变化 不同CYP2C19基因型间的比较:不同CYP2C19基因型患者血小板药物抑制率、MAADP及神经功能变化的中位数组间差异无统计学意义(表5)。
不同ABCB1基因型间的比较:不同ABCB1基因型患者的血小板药物抑制率、MAADP及神经功能变化的中位数组间差异无统计学意义(表5)。

表4 各基因型临床分布情况 (n,%)
2.4 不同突变基因数量患者间血小板药物抑制率、MAADP及神经功能变化的比较 根据突变基因数量,将入组患者分为A、B、C组,其中A组23例(20.0%),B组50例(43.5%),C组42例(36.5%)。结果(表6)表明:不同突变基因数量患者间血小板药物抑制率、MAADP及神经功能变化,组间差异无统计学意义。

表5 不同基因型患者抗血小板药物抑制率、MAADP及神经功能变化的中位数
Δ:服药7 d后神经功能量表评分与入院时差值

表6 不同突变基因数量患者间血小板药物抑制率、MAADP及神经功能变化的中位数
Δ:服药7 d后神经功能量表评分与入院时差值
3 讨 论
氯吡格雷是一种重要的噻吩吡啶类抗血小板药物,其使用显著减少了缺血性脑血管病的发生,但对氯吡格雷反应存在显著个体差异,氯吡格雷抵抗的发生率约为5%~30%[24],因此氯吡格雷代谢相关的基因多态性引起越来越多的临床医生的重视。ABCB1及CYP2C19基因在氯吡格雷代谢中发挥重要作用,ABCB1基因突变导致氯吡格雷的肠道吸收减少[25],而CYP2C19基因突变导致其所编码的参与氯吡格雷生物转化酶的活性改变[26],CYP2C19失功能等位基因携带者的酶活性降低,从而使氯吡格雷的生物利用度降低,导致氯吡格雷治疗后血小板高反应性,从而增加不良缺血事件的发生[11,27]。
ABCB1和CYP2C19基因突变类型及发生频率在不同种族及地域间存在差异。本研究中,CYP2C19*2 和CYP2C19*3的出现频率分别为34.3%和4.8%。Scott等[28]的一项研究发现,在CYP2C19基因突变类型中,*2是最常见的失功能等位基因,其在高加索人、非裔美国人及亚洲人中出现的频率分别约为12%、15%、29%~35%,在大多数种群*3等位基因出现频率低于1%,然而,在亚洲人群中其出现频率亦相当高,约为2%~9%,与本研究结果一致。Fung等[29]发现在亚洲人中ABCB1基因突变发生率高达69.9%~83.2%,本研究结果显示ABCB1基因突变发生率为57.4%,接近上述研究结果。
本研究对115例缺血性卒中患者进行CYP2C19基因型和血小板抑制率的检测以及急性期神经功能变化的评估,各代谢型氯吡格雷血小板药物抑制率及神经功能变化均无显著差异。但既往诸多研究显示CYP2C19失功能等位基因(中、慢代谢型)携带者对氯吡格雷反应性降低,氯吡格雷抗血小板聚集作用减弱[30-33],与本研究结果并不一致。但也有一些研究与本研究结果相符。其中2010年一项随机对照试验结果显示在急性冠脉综合征或房颤患者中,不管患者是否携带CYP2C19失功能等位基因,氯吡格雷降低主要终点事件发生率是相似的[34]。2015年的一项Meta分析结果显示接受氯吡格雷治疗的冠心病患者中,携带CYP2C19失功能等位基因并未使心血管事件发生率增加[35]。在最近一项研究[36]中,对接受阿司匹林联合氯吡格雷的急性冠脉综合征患者进行1年随访发现CYP2C19基因型对患者临床预后并无影响。尹书会等[37]对251例缺血性脑卒中服用氯吡格雷的患者进行CYP2C19基因型检测,并利用血栓弹力图检测血小板药物抑制率,比较不同基因型患者的血小板抑制率及氯吡格雷敏感情况,各代谢型间血小板药物抑制率及氯吡格雷敏感情况的差异均无统计学意义。
本研究还比较了不同ABCB1基因型患者的血小板抑制率及神经功能变化,各基因型氯吡格雷血小板抑制率及神经功能变化无显著差异。关于ABCB1基因多态性对氯吡格雷抗血小板聚集作用的影响,目前国内外研究尚无统一定论。有研究[25]显示ABCB1基因突变使血液中氯吡格雷及其活性和非活性代谢产物浓度降低,从而使血小板抑制率降低。然而,多项研究所得出的结论与本研究相似,其中一项纳入500例服用氯吡格雷的急性冠脉综合征的中国患者的研究结果显示ABCB1基因型不影响氯吡格雷的抗血小板作用强度[38];Su等[18]对303例服用氯吡格雷的缺血性脑卒中患者进行血小板聚集率检测,根据血小板聚集率分为氯吡格雷抵抗组和氯吡格雷敏感组,结果显示ABCB1基因型与氯吡格雷抵抗无关;Karaz'niewicz-ada等[39]也发现ABCB1基因多态性和血小板抑制率间并无相关性;甚至一项Meta分析[40]结果显示,在服用氯吡格雷的亚洲人群中,ABCB1基因突变减弱血小板活性,从而使出血风险增加。
由于既往研究未分析ABCB1和CYP2C19两种基因联合突变对氯吡格雷疗效的影响,本研究比较了含不同突变基因数量患者间的血小板抑制率及急性期神经功能变化情况,各组间无显著差异。有研究显示在接受阿司匹林+氯吡格雷联合抗血小板的急性冠脉综合征患者中,同时携带CYP2C19失功能基因及ABCB1突变基因的患者血栓形成事件发生率更高[13],但针对缺血性脑卒中,关于ABCB1及CYP2C19基因型联合突变对氯吡格雷疗效的影响尚未见报道,还需进一步研究探讨。
综上所述,关于ABCB1及CYP2C19基因型对氯吡格雷疗效的影响尚存在争议,分析其原因如下:参与氯吡格雷代谢的因素较多,可能还有一些较关键的因素及机制尚未被发现;评估血小板功能的方法众多,且其检测原理、易受影响的因素各不相同,不同研究所采用的方法亦不同,这可能会导致不同研究结果间的差异。从本研究结果看,对于服用氯吡格雷的急性动脉粥样硬化性脑梗死患者,不同ABCB1及CYP2C19基因型间的血小板抑制率及急性期神经功能变化并无显著差异,但对于该人群长期预后的影响仍需要进一步的研究。
