胃癌组织中IFN-γ、IL-4和SOX-2蛋白表达及其与幽门螺杆菌感染的相关性分析
2020-01-08苏建荣
贾 坤,苏建荣
首都医科大学附属北京友谊医院临床检验中心,北京 100050
除了目前已经明确的遗传、环境及生物学机制外,胃癌的分子生物学发病机制成为近年来的研究热点[1]。不同的肿瘤相关因子可通过影响上皮细胞分化和增殖过程来促进肿瘤的发展。随着免疫组化技术的成熟,通过对病变组织中此类标志物的检测,可于早期对胃癌的发生和进展进行预估和判断[2]。γ-干扰素(interferon-γ,IFN-γ)和白细胞介素-4(interleukin-4,IL-4)是T淋巴细胞分泌的效应因子,能介导炎症损伤和免疫逃逸;SOX-2(SRY-related HMG box gene 2)是具有代表性的干细胞转录因子,能调控正常细胞的发育和增殖,在多种恶性肿瘤中异常表达[3-5]。本研究分析了IFN-γ、IL-4和SOX-2在胃癌组织中的表达情况及其与HP感染的关系,以期为胃癌的诊疗提供新思路。
1 资料与方法
1.1 一般资料 选取我院病理科2018年5月至2019年5月收集的胃黏膜活检样本,包括胃癌样本67例(胃癌组),胃炎样本85例(胃炎组),胃溃疡样本73例(溃疡组),均经临床及病理确诊。临床诊断符合人民卫生出版社《外科学》第八版标准;病理样本由两名病理科主治医师采用盲法得出结论。纳入标准:年龄18~80岁;首次确诊;留取样本前未接受过抗肿瘤、抗炎及抗HP治疗;患者本人签署知情同意书。排除标准:胃癌非原发癌或已明确的远处转移;近期接受免疫制剂、激素、非甾体类药物治疗;合并自身免疫病,严重的心、肺、肝、肾功能不全;妊娠或哺乳期女性;临床资料不完整者。胃炎组:男性49例、女性36例,年龄46~61岁,平均(53.7±5.6)岁。溃疡组:男性43例、女性30例,年龄46~62岁,平均(54.9±6.2)岁。胃癌组:男性38例、女性29例,年龄50~62岁,平均(57.2±4.9)岁;TNM分期:Ⅰ期19例、Ⅱ期26例、Ⅲ期15例、Ⅳ期7例;病理分型:腺癌58例,印戎细胞癌9例。各组性别及年龄差异无统计学意义。
1.2 免疫组化检测 石蜡包埋后切片,采用免疫组化链霉卵白素-生物素复合体法(SABC)染色,二氨基联苯胺(DAB)显色,对照组用PBS 代替一抗;高倍镜下观察拍照。SP及DAB试剂盒,IFN-γ、IL-4和SOX-2蛋白通用型二抗购自北京中杉金桥生物技术有限公司。相应染色步骤按说明书操作,结果由两名病理科医师采用盲法阅片,结论有分歧时请另一名病理科医师阅片。IFN-γ、IL-4于胞质表达,SOX-2于细胞核表达。染色结果评分标准见表1,阳性细胞与着色强度评分的乘积≥3分为阳性,小于3分为阴性[3]。
a×b≥3分为阳性;a×b<3分为阴性
1.3 HP感染检测 C-13呼气试验:于清晨空腹状态下口服C-13尿酸,10 min后连续呼气100~150 mL,采用红外质谱检测仪分析;检测值-基线值>2.5为阳性,反之为阴性。组织学检查:样本经过甲醛固定、脱水、石蜡包埋、切片,Giemsa染色,1 000倍显微镜下观察,样本呈紫红色为阳性,否则为阴性。C13呼气及组织学检测均为阳性,确诊为HP感染[6]。
2 结 果
2.1 各组HP染色阳性率 结果(图1)显示:HP呈紫红色,短杆状,S型,以胃小凹处最多见,常呈鱼群样排列或聚集成团。胃炎组HP阳性率(91.8%,78/85)高于胃癌组(79.1,53/67)、溃疡组(74.0%,54/73),差异有统计学意义(χ2=5.043、9.043,P<0.05);胃癌组与溃疡组HP阳性率差异无统计学意义(χ2=0.511,P=0.475)。

图1 Giemsa染色结果
Hp呈紫红色,分布于胃小凹内,成团聚集
2.2 各组IFN-γ、IL-4及SOX-2蛋白表达及阳性率 结果(图2)显示:IFN-γ于胞质及胞膜表达,在胃癌组织中,免疫组化染色以棕黄色和褐色为主,呈强阳性表达,阳性细胞占比大;在胃炎及溃疡组织中,染色以淡黄色为主,阳性细胞占比小。IL-4于胞质及胞膜表达,在胃癌组织中,呈淡黄色,阳性细胞占比小;在胃炎和溃疡组织中,染色呈褐色,阳性细胞占比大。SOX-2于细胞核表达,在胃癌组织中,呈无色或淡黄色,阳性细胞占比小;在胃炎和溃疡组织中,染色呈褐色,阳性细胞占比大。
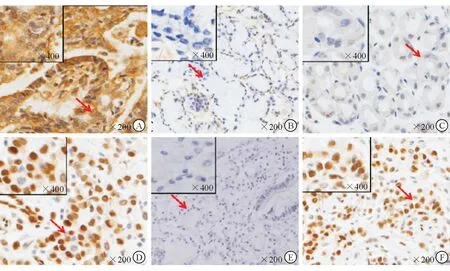
图2 免疫组化染色结果
A,B:IFN-γ在胃癌(A)及胃溃疡组织(B)中的表达;C,D:IL-4在胃癌(C)及胃炎组织(D)中的表达;E,F:SOX-2在胃癌(E)及胃炎组织(F)中的表达
结果(表2)显示:胃癌组IFN-γ蛋白阳性率高于胃炎组和溃疡组,差异有统计学意义(P<0.05);胃癌组IL-4、SOX-2蛋白阳性率低于胃炎组和溃疡组,差异有统计学意义(P<0.05)。
2.3 胃癌组织中IFN-γ、IL-4、SOX-2蛋白表达与HP感染相关性 Spearman秩相关分析(表3)显示,胃癌组织IFN-γ和IL-4蛋白表达与HP感染无显著相关性,SOX-2蛋白与HP感染明显负相关(r=-0.732,P=0.007)。
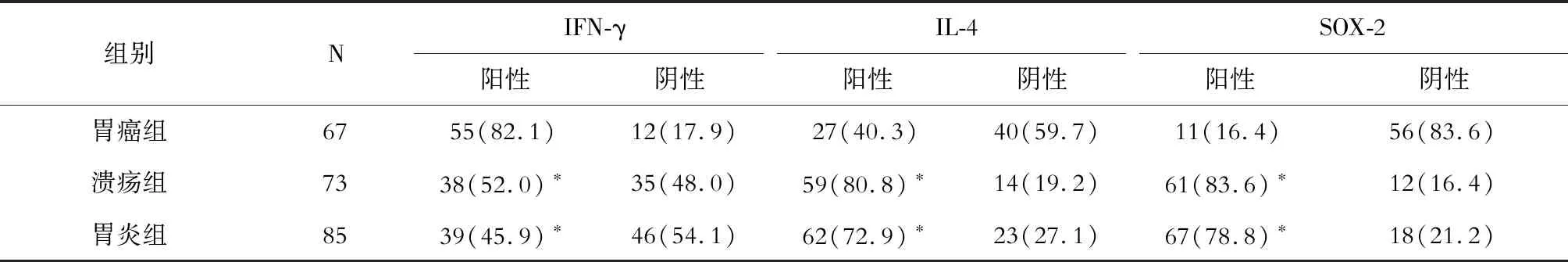
表2 各组IFN-γ、IL-4和SOX-2蛋白表达阳性率比较 n(%)
IFN-γ:γ干扰素;IL-4:白细胞介素4;SOX-2:性别决定相关基因簇-2.*P<0.05与胃癌组相比

表3 胃癌组织IFN-γ、IL-4、SOX-2蛋白表达与HP感染相关性 n(%)
3 讨 论
胃癌是世界上发病率和致死率较高的恶性肿瘤之一,其发生和发展涉及复杂的基因调控过程,且受环境因素影响。在早期无临床症状的情况下,胃癌的检出率很低,大部分患者因此错过了最佳治疗时机,这是胃癌患者生存率较低的主要原因。临床上常通过检测血清肿瘤标志物来进行胃癌的早期筛查,但灵敏度和特异度较低,应用价值有限。
HP感染是胃癌发病的主要生物学因素,感染HP的患者胃癌的发病风险是健康者的6~8倍,可能与以下机制有关[7-8]:(1)HP感染可触发胃黏膜慢性炎症损伤,导致细胞凋亡与增殖间的平衡被打破;(2)HP感染可引起周期调控蛋白异常表达,导致细胞增殖增加;(3)HP感染后在局部释放细菌毒力因子,使端粒酶活性增加,诱发胃黏膜上皮细胞线粒体基因变异。但HP感染并非胃癌所特有,在慢性浅表性胃炎和胃溃疡患者中HP的检出率极高,甚至在正常人群中亦有30%~40%的感染率[9]。本研究显示,胃炎组、溃疡组和胃癌组HP阳性率分别为91.8%、74.0%和79.1%,胃炎组HP阳性率高于胃癌组和溃疡组,差异有统计学意义(P<0.05),说明HP单独检测不能作为评价胃癌发生发展的指标。
随着免疫组化技术的成熟,对病变组织中相关标志物表达水平的检测可对肿瘤的发生、发展、治疗反应性和预后进行评估。IFN-γ是Th1淋巴细胞分泌的主要效应因子。动物试验[10]显示,IFN-γ可介导慢性炎症损伤,调控氧化应激反应,增加趋化因子对胃黏膜的浸润程度,促进癌细胞基因异常扩增,增加上皮细胞恶变风险。IL-4由抗原或丝裂原刺激的CD4+T细胞产生,主要在稳定T淋巴细胞免疫、维持树突状细胞免疫提呈功能和增强免疫系统对肿瘤细胞的监视方面发挥重要作用[11]。SOX-2是决定胃黏膜上皮分化的重要转录因子,在早期胚胎发育和分子调控中扮演着重要角色,有学者将外源性SOX-2基因导入胃永生化细胞中,发现细胞周期明显停滞、细胞凋亡增加,提示SOX-2在抑制细胞异常增殖方面发挥作用[12]。本研究采用免疫组化法对胃癌组织中的上述标志物的表达情况进行分析,发现IFN-γ蛋白在胃癌组织胃黏膜上皮细胞胞质中呈强阳性表达,阳性率高于胃炎组和溃疡组,差异有统计学意义(P<0.05),IL-4和SOX-2蛋白分别在胃黏膜上皮细胞胞质和胞核中表达,胃癌组阳性率低于胃炎组和溃疡组,差异有统计学意义(P<0.05)。提示这3种蛋白异常表达均参与了胃癌发病,其中IFN-γ蛋白表达异常升高可介导胃黏膜上皮持续的炎症损伤,提高细胞癌基因的转录速度[13],IL-4蛋白表达下降使得免疫系统对肿瘤细胞的监视作用和自然杀伤性T细胞吞噬肿瘤细胞的能力降低[14]。SOX-2蛋白主要影响癌细胞的转录过程,其表达下降造成癌细胞转录上游的启动子异常激活,加快癌细胞基因的扩增速度[12]。除此之外,本研究还分析了上述3种蛋白的表达与HP感染的相关性,证实HP感染与SOX-2蛋白表达呈显著负相关关系(r=-0.732,P<0.05),而与IFN-γ、IL-4蛋白表达无明显相关性(P<0.05),说明HP感染可能通过影响SOX-2蛋白表达促进胃癌发病。HP可使线粒体转录基因调控紊乱,影响胃黏膜上皮细胞癌基因的转录平衡,但不会对T淋巴细胞免疫的平衡产生影响[15],这可能是HP感染与干细胞标志物、转录因子SOX-2蛋白表达相关,而与th1/th2淋巴细胞效应因子IFN-γ、IL-4蛋白表达无关的原因。
综上所述,组织IFN-γ蛋白表达上调,IL-4和SOX-2蛋白表达下调可参与胃癌的发生和发展,且HP感染可能通过影响SOX-2蛋白表达促进胃癌发生。
