HT22海马神经元细胞氧糖剥夺再灌注模型的建立
2020-01-07闫向丽王利胜王圣鑫
闫向丽, 王利胜, 王圣鑫
(广州中医药大学,广东广州 510006)
缺血性脑中风(ischemic stroke,IS)是一种因血管部分或完全阻塞导致血液不能流入大脑而引起脑组织损伤的疾病,患者预后常伴有运动、语言等神经功能缺损症状,给社会和家庭带来了沉重的负担[1-2]。脑组织处于缺血缺氧的病理状态下,大脑的结构和功能将出现严重的损伤和破坏,当用溶栓、扩血管等手段重新补给血液后,会进一步加剧脑组织的损伤并伴随一系列的炎症反应,引起再灌注损伤。氧糖剥夺再灌注(OGD/R)模型通过剥夺细胞的营养及氧气供给模拟人体缺血再灌注损伤过程,是目前较为理想的体外实验模型[3]。海马对缺氧的耐受力较差,因此选择海马神经元细胞建立稳定的氧糖剥夺再灌注模型,对缺血性脑中风疾病的研究具有重要意义[4]。本研究以HT22海马神经元细胞为研究对象,采用缺氧小室(见图1)对细胞进行缺氧、不同时间的复氧建立氧糖剥夺再灌注模型,通过观察细胞形态,检测细胞存活率,同时测定不同条件下细胞培养基中乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)的活力及丙二醛(MDA)的含量,确定最佳的造模条件,以期为研究缺血性脑中风疾病的研究建立一种稳定可靠的细胞模型,现将研究结果报道如下。

图1 细胞缺氧培养装置Figure 1 Hypoxia incubator chamber
1 材料与方法
1.1 细胞 HT22海马神经元细胞由中国科学院上海药物研究所惠赠。
1.2 试剂 DMEM高糖培养基(批号:8119078)、DMEM无糖培养基(批号:2044490)均购自美国Gibco公司;胎牛血清(FBS,美国Hyclone公司,批号:42Q0682K)、青霉素—链霉素(中国Biosharp公司,批号:68080500)、CCK-8(日本同仁化学研究所,批号:FH783)、LDH试剂盒(批号:20180728)、SOD试剂盒(批号:20180728)、MDA试剂盒(批号:20180728),均购自南京建成生物工程研究所。
1.3 仪器 缺氧小室(加拿大Stem cell公司,型号:27310);流量计(加拿大Stem cell公司,型号27311);倒置相差显微镜(日本Olympus公司);恒温CO2培养箱(新加坡Esco公司);酶联免疫检测仪(美国BioTek公司)。
1.4 细胞培养 HT22细胞系是小鼠HT4细胞系的一种亚克隆,具有海马神经元的特性,是一种永生化的小鼠海马神经元细胞[5]。用含体积分数10%胎牛血清(FBS)的DMEM高糖培养基,同时加入100 U/mL青霉素和100μg/mL链霉素,在37℃,体积分数5%CO2的培养箱中培养。
1.5 实验分组及处理 细胞分为正常对照组和模型组,以9 000个/孔、5 000个/孔、3 000个/孔的密度接种至同一96孔板中,平行3份。正常对照组:细胞始终在正常气体条件下培养;模型组:吸弃原细胞培养基,PBS清洗3次后加入DMEM无糖培养基,将96孔板置于缺氧小室中,混合气体(体积分数95%N2+体积分数5%CO2)置换其中的空气,之后将装置放入37℃的培养箱中缺氧8 h。细胞缺氧结束后,将DMEM无糖培养基更换为完全培养基,并重新放入细胞培养箱中继续培养,复氧时间分别设为3、6、8 h。
1.6 细胞计数试剂盒8(CCK-8)测定细胞活力 细胞处理结束,吸弃原培养基,PBS清洗3次后加入100μL完全培养基和10μL的CCK-8溶液,37℃孵育2 h,于酶标仪450 nm处测定吸光度(OD,D)值。用每组D(450 nm)值与正常对照组D(450 nm)值的比值(p)来计算细胞存活率。每个浓度设6个复孔,实验重复3次。最后取平均值进行统计分析。
1.7 LDH、SOD活力及MDA含量测定 细胞处理结束,收集细胞上清液于新的96孔板中,微板法分别测定LDH、SOD的活力及MDA含量。每个浓度设6个复孔,实验重复3次。结果取平均值进行统计分析。
1.8 统计方法 采用SPSS 22.0统计软件,并使用Graphpad prism 5.0进行图表绘制,计量资料以均数±标准差(-x±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态的改变 倒置相差显微镜下可见,正常的HT22海马神经元细胞轮廓清晰,立体感强、贴壁良好。氧糖剥夺再灌注后细胞突起皱缩、变圆,部分细胞漂浮在培养基中,细胞在再灌注6 h时受损最为明显。结果见图2。
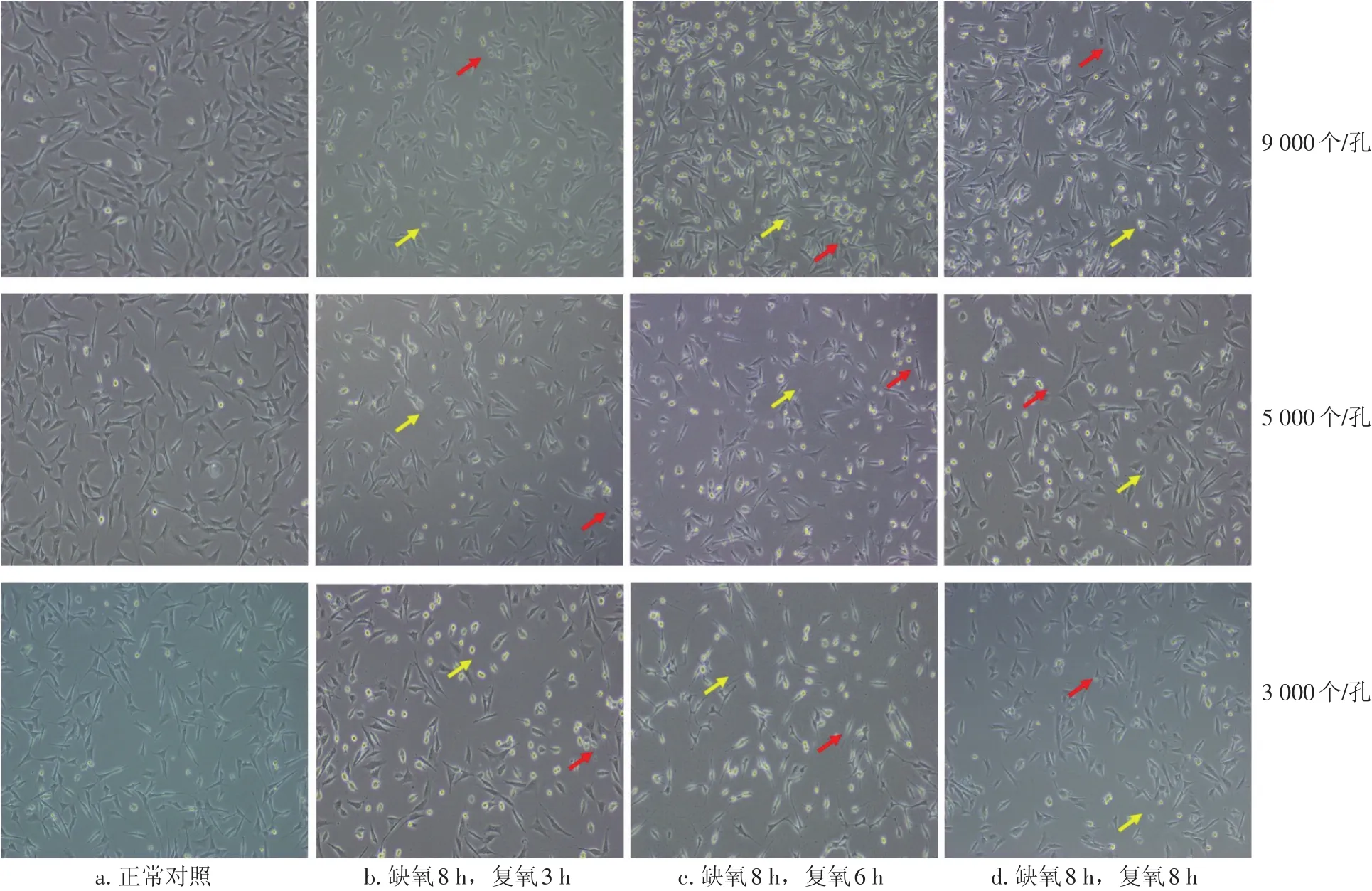
图2 不同造模条件下细胞的形态(×100)Figure 2 Cell morphology under different modeling conditions(×100)
2.2 氧糖剥夺再灌注对细胞存活率的影响 为探讨不同接种密度、不同复氧条件对细胞存活率的影响,设定了不同的细胞接种密度及复氧时间。结果显示,与正常细胞比较,不同接种密度的细胞在复氧6 h时存活率均达到最低(P<0.05)。在相同的接种密度下,随着复氧时间的延长细胞存活率均呈现出先降低后增加的趋势。结果见表1。
2.3 氧糖剥夺再灌注对细胞培养基中LDH活力的影响 氧糖剥夺再灌注后,不同接种密度、不同复氧条件下,细胞培养基中LDH的活力都有所增加,其中不同接种密度的细胞在复氧6 h时培养基中LDH的活力最高(P<0.05)。在相同的接种密度下,细胞培养基中LDH的活力均呈现先增高后下降的趋势。结果见表2。
2.4 氧糖剥夺再灌注对细胞培养基中SOD活力的影响 氧糖剥夺再灌注后,不同接种密度、不同复氧条件下,细胞培养基中SOD的活力都有所下降,其中不同接种密度的细胞在复氧6 h时培养基中SOD的活力最低(P<0.05)。在相同的接种密度下,细胞培养基中SOD的活力均呈现先下降后增高的趋势。结果见表3。
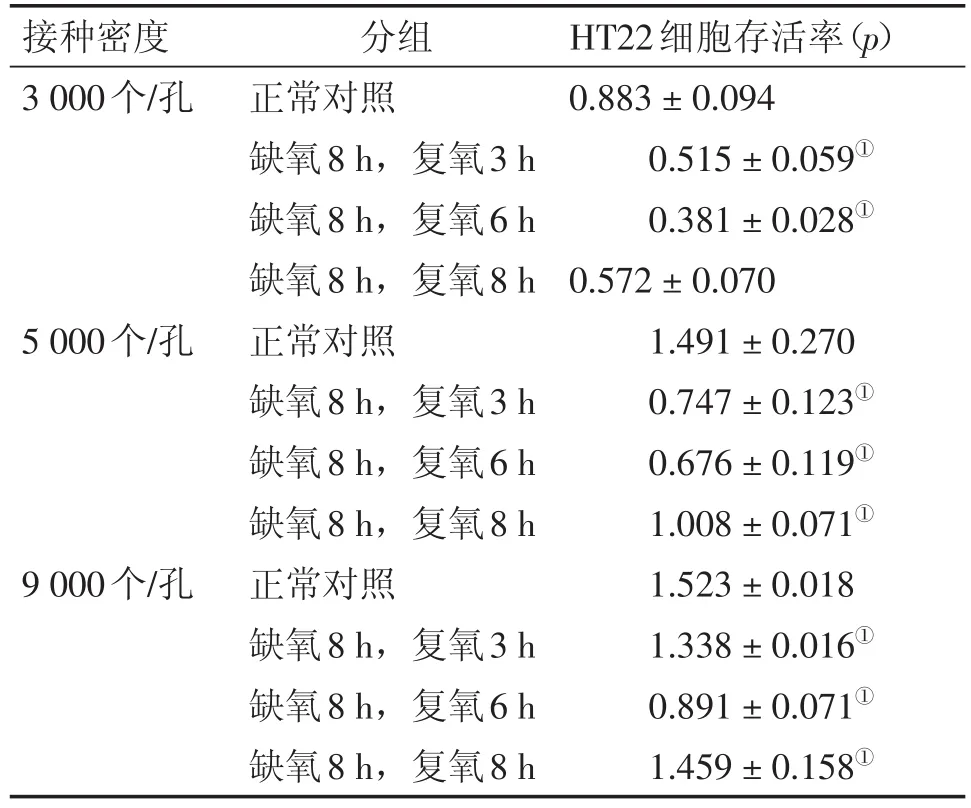
表1 不同造模条件对细胞存活率的影响Table 1 The effects of different modeling conditions on cell viability (-x±s,n=3)
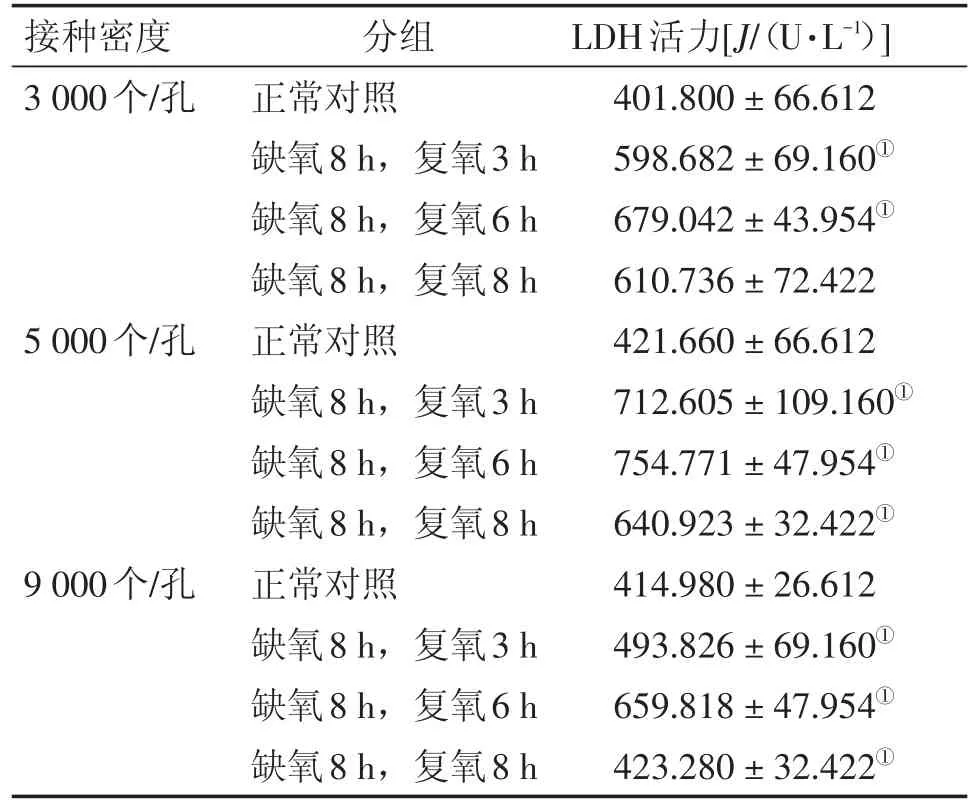
表2 不同造模条件对细胞培养基中LDH活力的影响Table 2 The effects of different modeling conditions on LDH activity in cell culture medium (-x±s,n=3)
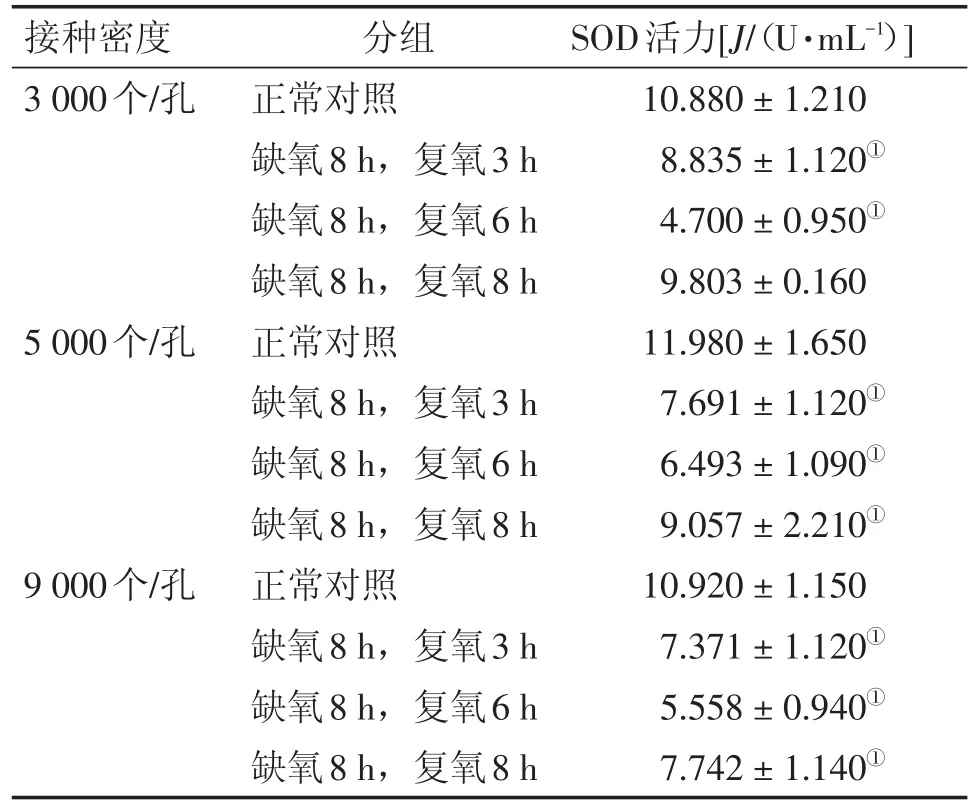
表3 不同造模条件对细胞培养基中SOD活力的影响Table 3 The effects of different modeling conditions on SOD activity in cell culture medium (-x±s,n=3)
2.5 氧糖剥夺再灌注对细胞培养基中MDA含量的影响 氧糖剥夺再灌注后,不同接种密度、不同复氧条件下,细胞培养基中MDA的含量都有所增加,其中不同接种密度的细胞在复氧6 h时培养基中MDA的含量最高(P<0.05)。在相同的接种密度下,细胞培养基中MDA的含量均呈现先增高后下降的趋势。结果见表4。
3 讨论
缺血性脑中风以其高发病率、高致残率、高复发率的特点成为神经系统疾病的研究热点。离体实验具有周期短、研究条件易于控制等优势,是研究脑梗死疾病的主要方式之一。然而,国内关于HT22海马神经元细胞氧糖剥夺再灌注模型的建立尚无统一标准。据文献报道,离体细胞模型的建立大体上分为化学方法和物理方法两类[3]。化学性缺氧模型由于化学试剂的加入可能对细胞造成损伤且存在实验操作不易控制、危害健康等问题;物理性缺氧模型比较常见,且应用广泛,混合气体培养法是目前建立细胞缺氧缺糖模型最常用的方法之一。Sun等[6]用三气培养箱制备了HT22海马神经元细胞氧糖剥夺再灌注模型,但由于价格昂贵,存在对机器的依赖性,一般实验室难以普及[7]。
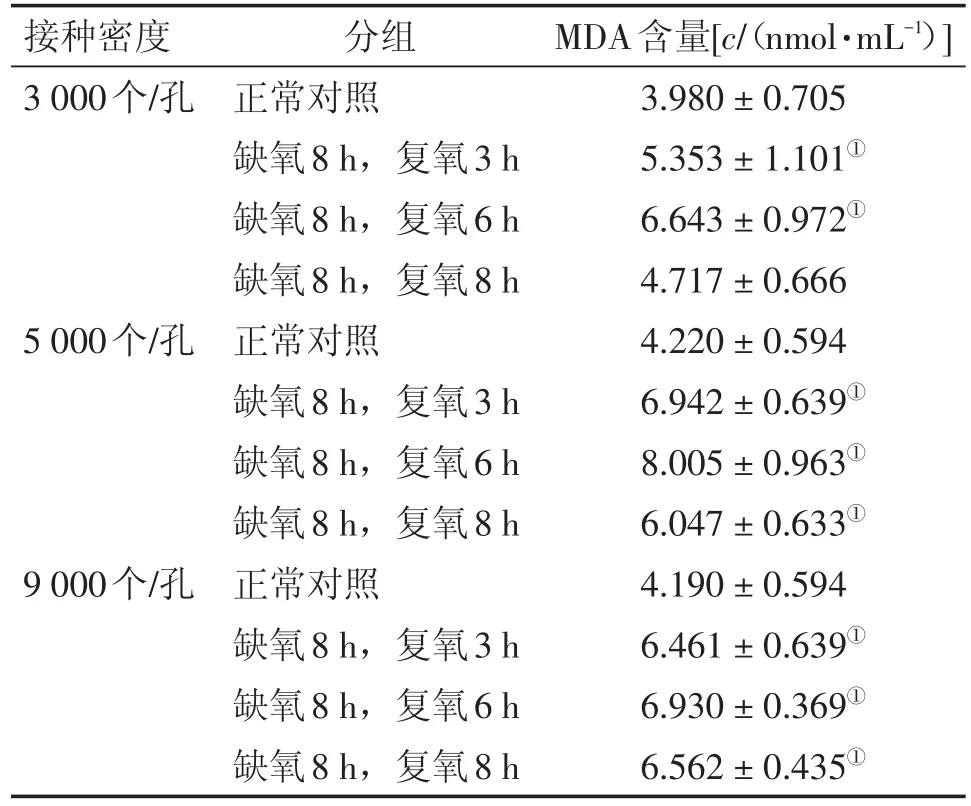
表4 不同造模条件对细胞培养基中MDA含量的影响Table 4 The effects of different modeling conditions on MDA content in cell culture medium (-x±s,n=3)
为了制备高效稳定的海马神经元细胞氧糖剥夺再灌注模型以利于后续研究,本研究用缺氧小室对细胞进行缺氧处理,再设定不同复氧时间来制备细胞模型,同时检测不同接种密度的细胞在氧糖剥夺再灌注后的存活率,旨在为缺血性脑中风疾病的机制研究提供可靠的细胞模型。CCK-8分析法具有很高的灵敏度,利用活细胞线粒体内的脱氢酶能选择性地将四唑盐还原成橙黄色甲瓒沉淀物的原理来检测细胞的存活率。本研究结果表明,在预设的造模条件下,不同接种密度细胞的形态均呈现出相似的趋势:细胞皱缩、变圆,部分细胞漂浮在培养基中,其中在复氧6 h时,细胞损伤最明显,同时细胞活力达到最低。之后,随着复氧时间的延长,细胞形态趋于正常,细胞活力逐渐恢复。
脑缺血再灌注时,机体内产生的氧自由基将加重脑损伤,SOD为氧自由基清除剂,过量的氧自由基会降低其活性[8]。再灌注过程产生的活性氧(reactive oxygen species,ROS)攻击细胞膜中的不饱和脂肪酸,生成大量的脂质过氧化产物MDA,同时细胞膜的完整性受到破坏,通透性增加,胞浆内的LDH大量外漏[9-11]。由本实验结果可知,不同的造模条件均对细胞造成了损伤,不同接种密度下的细胞在复氧6 h时,上清液中SOD的活性最低,说明此时机体内大量的氧自由基加重了脑损伤;LDH的活力及MDA的含量最高,表明细胞膜的完整性受到了严重的破坏。复氧8 h时,由于细胞的自身修复作用,各个生化指标呈现出逐渐恢复的趋势。
氧糖剥夺再灌注细胞模型是模拟人体缺血再灌注的经典离体实验模型。因此,建立稳定可靠的海马神经元细胞氧糖剥夺再灌注模型对缺血性脑中风病理机制的研究具有重要意义。通过查阅文献,我们发现研究者们在用不同的细胞建立氧糖剥夺再灌注模型时,缺氧时间有2、3、4、8、12 h 不等[6,10,12-14]。基于此,我们对缺氧时间进行了考察,发现缺氧8 h适合海马神经元细胞氧糖剥夺再灌注模型的建立。陈强等[15]考察了不同再灌注时间(6、12、24 h)对大鼠脑内脑源性神经营养因子(BDNF)表达的影响,BDNF的表达水平反应了局部神经元抵抗损伤的能力。研究发现,再灌注12 h时,BDNF的表达水平最高,提示这可能是治疗缺血性脑中风疾病的最佳时机。在预设的再灌注条件下,我们在细胞水平也发现了类似的趋势,但在再灌注6 h时细胞损伤最严重,这可能是因为离体状态下细胞的耐受力减弱所致。通过考察不同细胞接种密度对模型的影响,发现预设的3种细胞接种密度对海马神经元细胞氧糖剥夺再灌注模型的建立没有影响,可以根据实际需要选择合适的细胞接种量。本实验研究重复了3次,结果稳定。
综上所述,我们将HT22海马神经元细胞氧糖剥夺再灌注模型的建立条件初步确定为缺氧8 h复氧6 h,该方法操作简单,稳定可靠,能很好地满足缺血性脑中风疾病机制研究的实际需求。
