重组酶等温扩增试纸条快速检测阪崎克罗诺杆菌
2020-01-07陈纯阳张宸宁史爱莹杜欣军
陈纯阳,张宸宁,史爱莹,杜欣军*,王 硕*
(省部共建食品营养与发全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457)
阪崎克罗诺杆菌[1-2]属于肠杆菌科克罗诺杆菌属,是一种无芽孢有周生鞭毛、能运动、兼性厌氧的革兰氏阴性菌。该菌广泛分布于自然界中,现已从婴幼儿配方食品、肉制品、水果蔬菜、谷物等食品内分离出该菌[3-7]。阪崎克罗诺杆菌是一种成人食源性条件致病菌,但却是婴幼儿配方奶粉的A类致病菌,它会导致不同年龄段人群感染,特别是对新生儿和免疫功能不全人群,危害严重,可致感染者发生坏死性小肠结肠炎、脑膜炎、败血症等疾病[8-9]。因此,开发一种快速灵敏的阪崎克罗诺杆菌鉴定技术对于预防与控制该致病菌危害具有重要的实际意义。
目前,对于该致病菌的检测方法主要有传统生化分析和以分子生物学方法[10]为代表的许多其他方法。传统的检测分离阪崎克罗诺杆菌的方法,依赖其生理生化特性,国际上通常使用美国食品药品监督管理局(Food and Drug Administration,FDA)建立的婴幼儿配方奶粉中阪崎克罗诺杆菌的分离计数方法[11]。我国在也制定了GB 4789.40—2016《食品微生物学检验 克罗诺杆菌属(阪崎肠杆菌)检验》[12],规范了阪崎克罗诺杆菌的检测。但是传统检测方法费时费力,需要长达5 d才能获得结果。基于聚合酶链式反应(polymerase chain reaction,PCR)的分子生物学方法已经应用于微生物的检测。然而,PCR分析需要昂贵的设备与专业的操作人员,因此不适合在经济不发达地区和基层地区进行广泛的应用和推广[13-14]。鉴于PCR技术的局限性,近年来,等温核酸扩增技术快速发展,例如环介导等温扩增(loop-meditated isothermal amplification,LAMP)、滚环等温扩增(rolling circle amplification,RCA)和重组酶聚合酶等温扩增(recombinase polymerase amplification,RPA)等[15-16]。RPA是由多种酶参与,在恒定温度下实现核酸指数扩增的新技术[17]。与其他等温扩增技术相比,RPA优势在于灵敏度高、特异性强、所需温度低、扩增时间短,因此更适合于现场检测[18-19]。目前,RPA已经用于多种病原体的检测[20-22],其操作方法简便,反应20 min内就可以产生检测水平的扩增产物。扩增产物的检测通常可用电泳方法,但是电泳操作复杂、时间长、需要设备多,仅适合实验室内使用。而免疫层析试纸条(lateral fl ow strip,LF)分析只需5 min即可完成目标物的分析,且无需任何特殊设备,通过肉眼就可以观察结果,是一种高效的核酸扩增产物检测方法[23]。在试纸条检测方法中,金纳米粒子是应用最广泛的标记材料[24],与其他材料相比具有信号强、稳定性高、便于制备等优势。
本研究将RPA技术和LF技术相结合,建立了一种阪崎克罗诺杆菌快速检测方法(RPA-LF)。等温扩增与产物检测步骤可以在20 min内完成,且具有较高的灵敏度和特异性,可用于阪崎克罗诺杆菌的快速检测。本研究旨在为食源性致病菌的快速检测提供技术支持。
1 材料与方法
1.1 材料与试剂
实验采用阪崎克罗诺杆菌、大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌等常见食源性致病菌共21 株菌株见表1。

表1 实验菌株Table 1 Strains used in this study
LB肉汤培养基、PCA培养基 英国Oxoid公司;阪崎显色培养基、改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素培养基 青岛海博生物公司;缓冲蛋白胨水北京路桥技术有限公司;RPA试剂盒 英国TwistDX公司;DNA提取试剂盒 北京天根生物有限公司;氯金酸、柠檬酸三钠、牛血清白蛋白、PEG2000、吐温20、链霉亲和素 美国Sigma公司;鼠抗地高辛单克隆抗体 美国Abcam公司;塑料背衬、样品垫、吸回垫上海金标生物科技有限公司;硝酸纤维素(nitrocellulose,NC)膜 美国Millipore公司。
1.2 仪器与设备
电热恒温培养箱 美国Thermo公司;电热恒温水浴锅 天津欧诺仪器仪表有限公司;电泳仪、凝胶成像仪 美国Bio-Rad公司;磁力搅拌器 德国IKA公司;双维往复式划膜仪 上海金标生物科技有限公司;真空干燥箱 天津三水仪器有限公司。
1.3 方法
1.3.1 菌株模板的制备
将菌种于-80 ℃取出置于冰盒上,取100 μL加入10 mL LB液体培养基中,37 ℃、200 r/min过夜培养。次日取出,按照细菌基因组DNA提取试剂盒说明书提取细菌DNA,DNA于-20 ℃保存备用。
1.3.2 引物设计
从NCBI GenBank获得阪崎克罗诺杆菌ompA序列[25],应用Primer 5.0设计特异性引物。正方引物标记地高辛,反方引物标记生物素,引物由苏州金唯智公司合成,详见表2。
1.3.3 胶体金试纸条制备
1.3.3.1 胶体金标记抗体的制备
制备直径约为20 nm的胶体金颗粒[26],并用紫外-可见光度计对其进行质量鉴定。取1 mL胶体金,用K2CO3调节胶体金的pH 8.5,再加入10 μL的鼠抗地高辛单克隆抗体,4 ℃孵育1 h后,加入20 μL 20% BSA溶液和10 μL 20%的PEG20000,混合均匀后继续于4 ℃孵育30 min。金标抗体纯化后加入200 μL的金标工作液重悬,并将金标抗体平铺到结合垫上,真空干燥过夜。
1.3.3.2 胶体金试纸条的制备
胶体金LF样品垫、结合垫、NC膜、背板和吸水纸组成。样品垫和结合垫由玻璃纤维组成,金标抗体均匀涂布在结合垫上作为金标垫,37 ℃真空干燥过夜。链霉亲和素和羊抗鼠二抗分别利用划膜仪划至NC膜上作为T线和C线,37 ℃干燥过夜。按顺序将样品垫、金标垫、NC膜和吸水纸4 个部分贴在背板上,用切条机切割成试纸条,密封保存备用。RPA-LF试纸条结构及检测原理如图1所示。
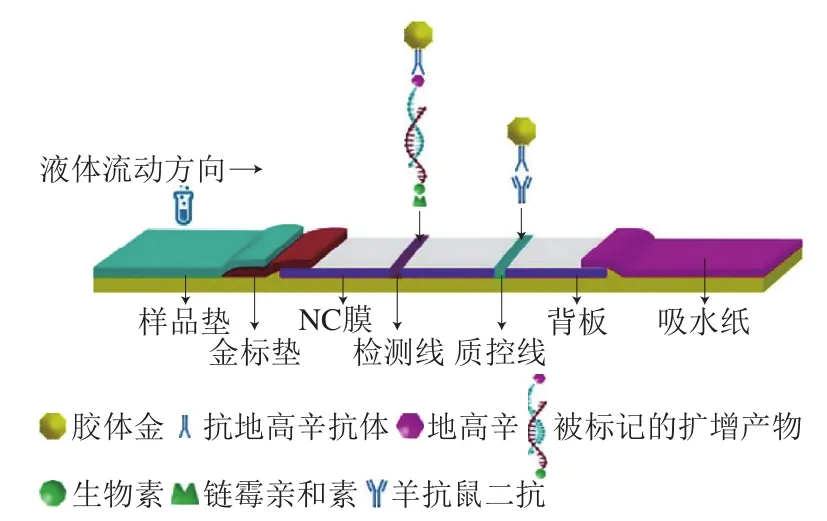
图1 RPA-LF检测原理图Fig. 1 Schematic diagram of RPA-LF
1.3.4 RPA优化
1.3.4.1 反应温度的优化
RPA反应液配制:加入2.4 μL正反方引物(10 μmol/L),反应试剂29.5 μL,2 μL DNA模板和11.2 μL去离子水,迅速振荡混匀,再方管中加入酶,振荡混匀,最后加入2.5 μL醋酸镁,充分混匀。将RPA反应液在不同温度(30、38、40、42、45 ℃)水浴锅中进行反应,用试纸条进行检测得出最适扩增温度。
1.3.4.2 反应时间的优化
将反应时间依次设定为5、10、15、20 min和30 min,根据试纸条结果得出最佳反应时间。
1.3.5 胶体金试纸条的优化
1.3.5.1 NC膜的选择
选用Milipore HF 90 s、Milipore HF 135 s和Milipore HF 180 s三种类型的NC膜制备试纸条,根据显色情况选择最佳的NC膜型号。
1.3.5.2 样品展开液的优化
分别选用0.01 mol/L磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 8.5),0.01 mol/L磷酸盐-吐温缓冲液(phosphate buffered solution-tween,PBST)(pH 8.5),0.01 mol/L PBST(pH 7.4)和蒸馏水4 种溶液作为样品展开液,取10 μLRPA产物与分别与90 μL 4 种缓冲液充分混合均匀,将100 μL上样液体滴加在试纸条加样孔上,根据显色结果,选择最适样品展开液。
1.3.6 胶体金试纸条检测
1.3.6.1 灵敏度检测
取100 µL阪崎克罗诺杆菌加入10 mL LB培养液中,37 ℃、200 r/min摇床培养4 h,使OD值达到0.7左右。菌液用PBS溶液1∶10梯度稀释,稀释后的菌液分成两部分,一部分进行平板计数,另一部分使用水煮法提取基因组DNA。提取步骤如下:取1 mL菌液置于99 ℃水浴锅中裂解15 min,立刻置于冰上冷却10 min后10 000 r/min离心5 min,取上清液即为DNA。用RPA最佳体系进行扩增,扩增后100 μL混合物滴加在试纸条样品孔中,室温静置5 min后观察结果。将RPA产物用琼脂糖凝胶电泳(agarose gel electrohoreis,AGE)检测,比较RPA-AGE和RPA-LF的灵敏度。
1.3.6.2 特异性检测
使用15 株阪崎克罗诺杆菌和6 株非克罗诺杆菌验证RPA-LF方法的特异性,使用RPA方法扩增不同菌株DNA,扩增后100 μL混合物滴加在试纸条样品孔中,室温静置5 min后观察结果。
1.3.7 模拟(增菌)样品检测
从当地超市购买婴幼儿配方奶粉、婴幼儿配方羊奶粉、婴幼儿米粉和牛肉作为实际样品进行检测,分别称取25 g方其中分别添加梯度稀释的阪崎克罗诺杆菌纯菌液。将人工污染阪崎克罗诺杆菌的样品加入到225 mL LB培养基中,37 ℃培养0、2、4、6 h后采集培养物,用水煮法提取基因组DNA作为模板,用RPA最佳体系进行扩增,扩增结束后将100 μL混合物加到试纸条样品孔中,5 min后观察结果。所有样品同时利用GB/T 4789.40—2016方法进行检测。
1.3.8 实际样品检测
利用市售及天津市检验机构提供的婴幼儿配方奶粉、全脂奶粉、脱脂奶粉等20 种实际样品,每份取25 g,加入到225 mL LB培养基中混匀,37 ℃培养4 h后提取DNA,进行RPA-LF检测。所有样品同时利用GB/T 4789.40—2016方法进行检测。
2 结果与分析
2.1 RPA条件优化
2.1.1 反应温度优化
在不同温度条件下应用RPA、以试纸条进行检测,结果表明RPA在30~45 ℃均可以扩增阪崎克罗诺杆菌,且检测线颜色深浅与温度有关,由于酶处于最佳反应温度时,扩增效率最高,试纸条检测线部位颜色最深,因此选取45 ℃为后续实验最佳反应温度,见图2。
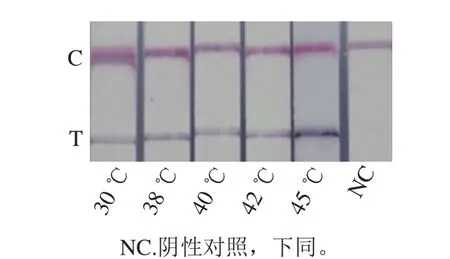
图2 RPA反应温度优化Fig. 2 Optimization of amplification temperature for detection of C. sakazakii
2.1.2 反应时间优化
在45 ℃进行不同时间的扩增,结果显示扩增5 min后即可出现检测线(图3),并且随着反应时间的延长,检测线颜色加深。但随着扩增时间的延长,引物二聚体产生的非特异性扩增的几率增加,为保证实验准确性、稳定性和快速性,选取15 min作为最佳扩增时间。
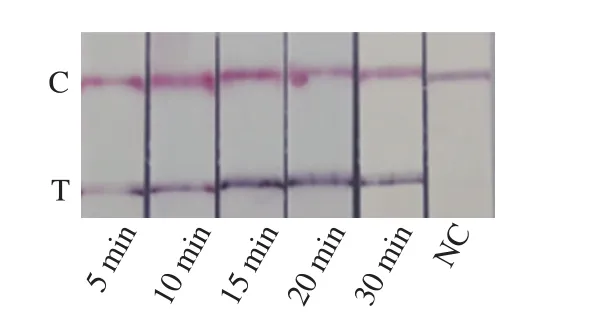
图3 RPA反应时间优化Fig. 3 Optimization of incubation time for detection of C. sakazakii
2.2 胶体金试纸条优化
2.2.1 样品展开液的优化
展开液由于成分不同,所含离子不同,会影响金标抗体的流动性和显色情况,实验中使用PBS(pH 8.5)、PBST(pH 7.4)、PBST(pH 8.5)和蒸馏水4 种溶液进行比较。结果显示PBS和蒸馏水的检测线颜色显示效果较好,pH值为7.4和8.5的PBST检测线较浅(图4),而在上样过程中蒸馏水流动速度较慢,显色时间较长,因此选择PBS(pH 8.5)作为最佳样品展开液。

图4 样品展开液优化Fig. 4 Optimization of sample buffer
2.2.2 NC膜优化
NC膜是决定结果的重要因素之一,Milipore HF 90 s、135 s和180 s三种NC膜检测结果表明:Milipore HF 90 s孔径最大,层析速度快,但是检测线条带颜色较浅;Milipore HF 180 s层析速度慢,检测时间过长;Milipore HF 135 s孔径适宜,层析速度较快,出现条带颜色清晰(图5),因此最终选择Milipore HF 135 s NC膜。

图5 NC膜优化Fig. 5 Optimization of NC membrane
2.3 灵敏度与特异性分析
2.3.1 灵敏度分析
为确定RPA-LF检测阪崎克罗诺杆菌纯菌液的检测限,将纯菌液10 倍梯度稀释,水煮法提取DNA作为RPA反应模板,同时进行RPA-AGE与RPA-LF灵敏度进行比较。RPA-LF结果显示随着阪崎克罗诺杆菌的浓度增加时,检测线亮度逐渐增加,当浓度为1.7×102CFU/mL时,检测线亮度与阴性对照仍然有明显不同。因此,1.7×102CFU/mL为RPA-LF检测阪崎克罗诺杆菌纯菌液的检测限。RPA-AGE结果显示其检测限为1.7×105CFU/mL(图6),检测限明显高于RPA-LF。Ye Yingwang等[27]建立的阪崎克罗诺杆菌PCR技术,检测纯菌液的灵敏度为102CFU/mL。Hu Shuangfang等[28]等建立的实时定量PCR检测阪崎克罗诺杆菌最低纯菌液浓度为1.1×102CFU/mL,表明PCR和实时定量PCR技术与本研究建立的RPA-LF检测限处于相同水平。但是,基于PCR和实时定量PCR技术所建立的检测方法依赖于精密的仪器设备和专业的实验人员,而RPA-LF无需复杂的实验仪器、实验操作简便,整个反应时间在20 min以内完成,因此RPA-LF适用于现场快速检测。Liu Siying等[29]建立的克罗诺杆菌RPA实时定量快速检测方法,所得检测限约为103CFU/mL,所需时间为15 min。可见,RPA-LF较实时定量RPA在相同的时间内,方法检测限更低,更适合阪崎克罗诺杆菌的快速检测。

图6 RPA-AGE和RPA-LF灵敏度比较Fig. 6 Comparison of the sensitivity of RPA-LF with that of RPA-AGE
2.3.2 特异性分析
选取15 株阪崎克罗诺杆菌和6 株非克罗诺杆菌,验证RPA-LF方法的特异性。结果显示全部的阪崎克罗诺杆菌均呈阳性,而其他菌种均只有出现质控线,未出现检测线,证明本实验建立的RPA-LF对于阪崎克罗诺杆菌的具有良好的特异性(图7)。
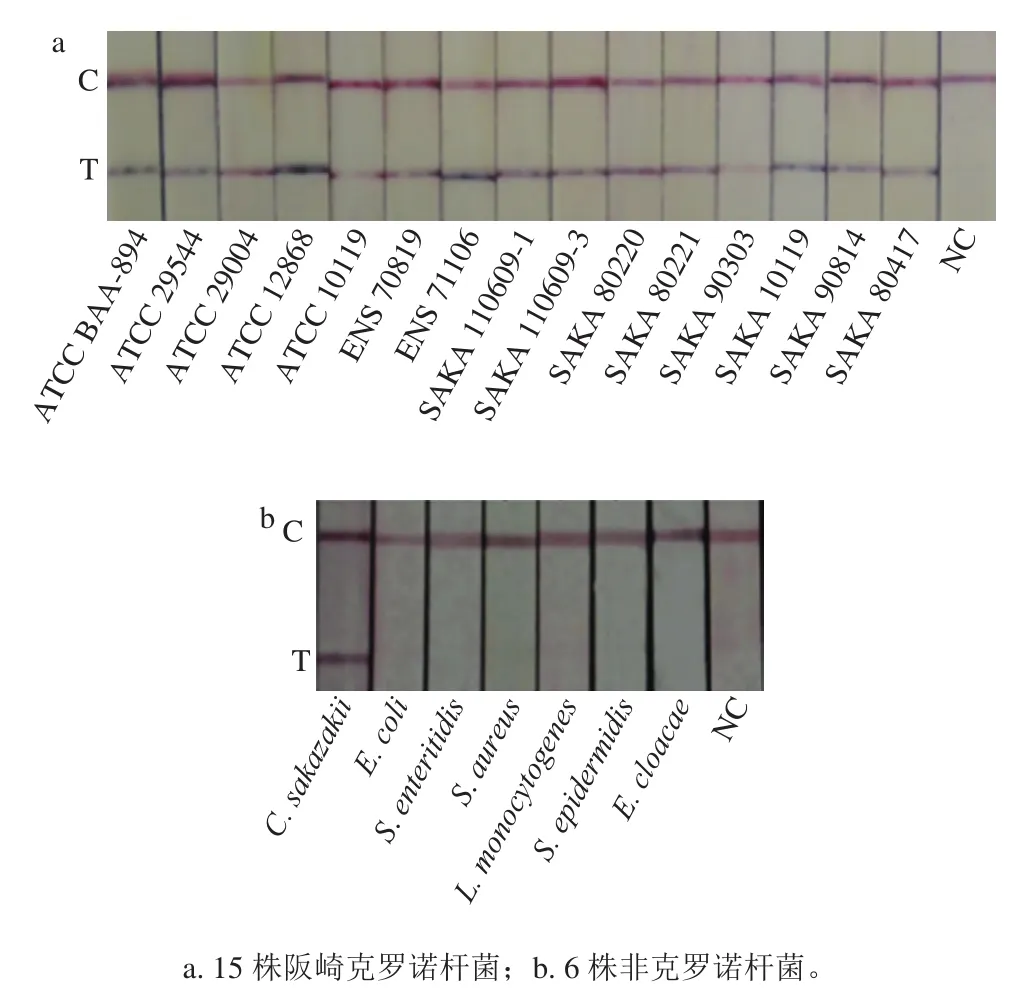
图7 RPA-LF检测阪崎克罗诺杆菌特异性Fig. 7 Specificity of the RPA-LF assay for detection of C. sakazakii
2.4 模拟(增菌)样品检测结果
为验证RPA-LF的实用性,选择婴幼儿配方奶粉、婴幼儿配方羊奶粉、婴幼儿米粉和牛肉为待测样品,添加不同浓度的阪崎克罗诺杆菌,并在37 ℃增菌不同时间。提取样品DNA后,使用RPA-LF检测。
结果表明奶粉和羊奶粉中含有1.7×102CFU/g的阪崎克罗诺杆菌时,不增菌即可以检出(图8a、d);当奶粉和羊奶粉中含有1.7×101CFU/g的阪崎克罗诺杆菌时,37 ℃增菌2 h可以检出(图8b、e);奶粉和羊奶粉中含有1.7×100CFU/g的阪崎克罗诺杆菌时,37 ℃增菌4 h可被检出(图8c、f)。Li Yuanhong等[30]建立的qPCR方法检测婴幼儿配方奶粉中含有1.06×100CFU/g阪崎克罗诺杆菌时,需要增菌12 h才可被检出,可见RPA-LF检测奶粉中的阪崎克罗诺杆菌更为灵敏。

图8 RPA-LF检测实际样品中克罗诺杆菌Fig. 8 RPA-LF detection of C. sakazakii in artificially contaminated food samples
当实际样品为婴幼儿米粉时,结果显示米粉中含有1.7×102CFU/g阪崎克罗诺杆菌纯菌液时,37 ℃培养1 h可以检出(图8g);米粉中含有1.7×101CFU/g的阪崎克罗诺杆菌时,37 ℃培养2 h可检出(图8h);当米粉中含有1.7×100CFU/g的目标菌时,37 ℃培养4 h可检出(图8i)。
当牛肉中含有1.7×102CFU/g的阪崎克罗诺杆菌时,37 ℃培养2 h可以检出(图8j);当方牛肉中含有1.7×101CFU/g的阪崎克罗诺杆菌菌液时,37 ℃培养4 h可以检出(图8k);牛肉中含有1.7×100CFU/g的菌液后,37 ℃培养6 h可被检出(图8l)。
此结果表明RPA-LF在婴幼儿配方奶粉和米粉中检测1.7×100CFU/g的阪崎克罗诺杆菌,包括增菌、提取DNA和检测,最多需要5 h可以得出结果;检测牛肉等肉制品所需时间稍长,需7 h得出结果。而Liu Siying等[29]所建立的实时定量RPA检测婴儿配方奶粉中的100CFU/g克罗诺杆菌,获得检测结果需要约8 h,证明RPA-LF检测阪崎克罗诺杆菌更加灵敏快速,适合用于食品的快速检测。
所有样品同时利用GB/T 4789.40—2016方法进行阪崎克罗诺杆菌检测,结果均为阳性,但是检测所需时长为5 d。将RPA-LF与传统检测方法进行比较可知,二者可获得相同的检测结果,但RPA-LF检测时间远小于传统检测方法。
2.5 实际样品检测结果
利用婴幼儿配方奶粉、全脂奶粉等20 种实际样品作为检测对象,同时利用RPA-LF检测和国标法检测。结果(表3)显示:1 种全脂奶粉和1 种婴幼儿配方奶粉检测结果为阳性,其余样品均为阴性。两种检测方法结果一致,表明RPA-LF具有较高的检测准确性。
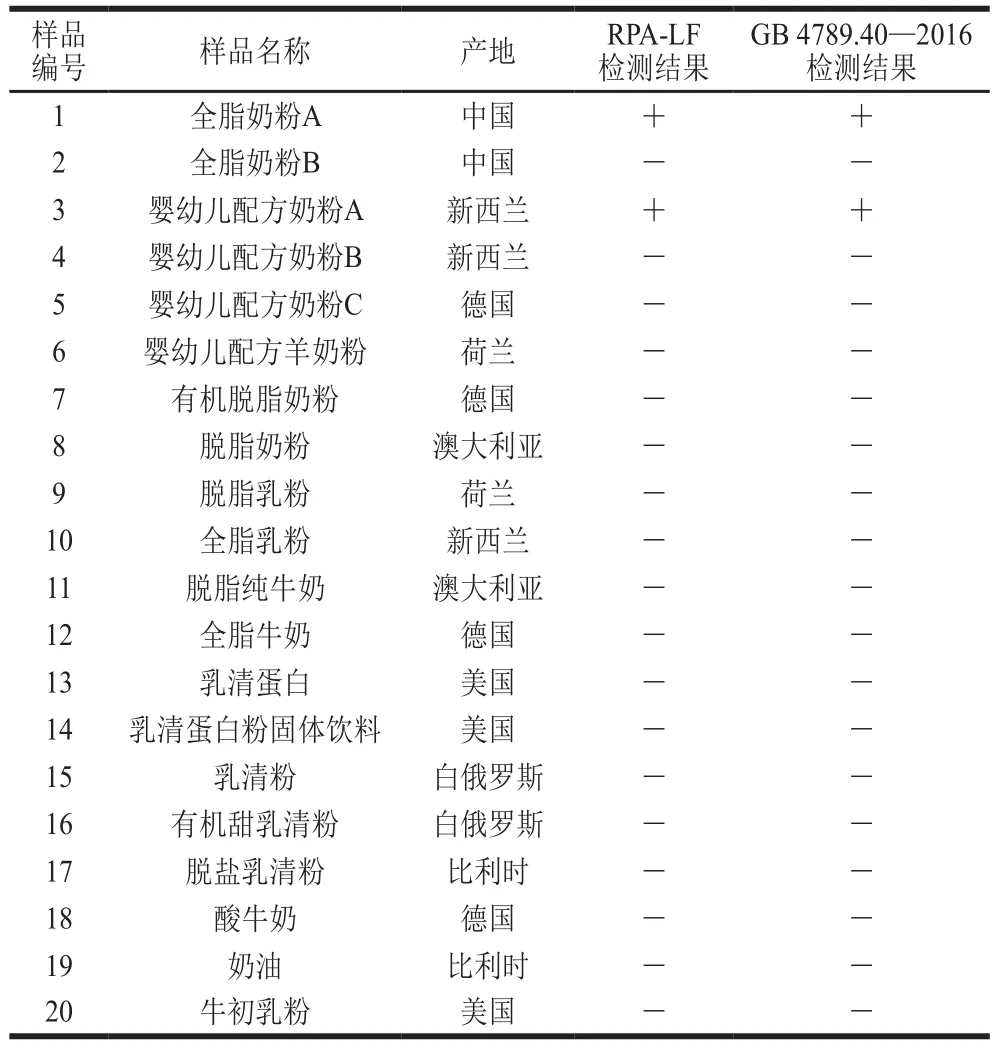
表3 实际样品检测结果Table 3 Comparative detection of C. sakazakii in real food samples using RPA-LF and the national standard method
3 结 论
阪崎克罗诺杆菌作为一种食源性条件致病菌,会导致不同年龄组的人感染疾病,因此,食品中阪崎克罗诺杆菌的检测也逐渐受到重视,尤其是婴幼儿配方奶粉的污染严重威胁婴幼儿的健康。本研究将RPA与LF相结合用于阪崎克罗诺杆菌检测。在纯培养的条件下,RPA-LF检测阪崎克罗诺杆菌纯菌液的检测限为1.7×102CFU/mL,比传统检测方法、PCR和实时定量RPA检测方法更为快速灵敏。当实际样品污染量为1.7×100CFU/g阪崎克罗诺杆菌时,此方法可以在5 h内对婴幼儿配方奶粉和米粉、在7 h内对牛肉完成检测。利用20 种实际样品评价RPA-LF的准确性,结果显示RPA-LF与国家标准方法获得一致的检测结果。因此,本研究所建立的RPA-LF是一种简便、快速、适合现场使用的阪崎克罗诺杆菌检测方法。
