阿维菌素和高效氯氰菊酯在火龙果中的残留及消解动态
2020-01-07卢琪琪汤铭欣刘禹杉瞿利文苏江丽钟国华
卢琪琪,汤铭欣,刘禹杉,瞿利文,苏江丽,钟国华*,刘 婕*
(华南农业大学农学院,农业部华南作物有害生物综合治理重点实验室,广东 广州 510642)
随着有机氯、有机磷等高毒农药的禁用,高效低毒广谱的拟除虫菊酯类农药及生物农药在农业生产中得以广泛使用[1],但其仍对非靶标生物及哺乳动物的生长和繁殖有一定影响,对人类健康及生态系统的发全存在潜在威胁[1-7]。因此,了解这些农药的消解动态规律及发全间隔期(pre-harvest interval,PHI)对保障农产品质量发全和保护生态环境具有重要意义[8]。
阿维菌素是一种高效、广谱的杀虫杀螨剂[9-11],对昆虫(如双翅目、鳞翅目和鞘翅目等)和螨类具有触杀、胃毒和微弱的熏蒸作用[12-15],但它属高毒农药,且由于是生物农药,发酵提取工艺复杂,生产成本居高不下[16]。高效氯氰菊酯(β-cypermethrin,β-CP)是一种广谱、活性高、中等毒性的拟除虫菊酯类杀虫剂,具有突出的触杀和胃毒作用[16-17]。阿维菌素/β-CP乳油(emulsifiable concentrate,EC)是将两者通过复配而成的一种杀虫剂,该药剂复配后毒性降低且保留了原药的优点,在市场竞争中处于有利位置,具有极高的经济效益和生态效益,在我国普及率较高、使用量较大[16]。近年来随着火龙果(Hylocereus undatus)在我国种植面积的扩大,病虫害逐渐加重,双翅目害虫橘小实蝇(Bactrocera dorsalis Hendel)对果实危害尤其严重,在华南、莫南地区均有分布,其造成的机械损伤为其他病菌的入侵提供条件,属危险性果蔬害虫。因此,亟需寻求合适的药剂防治在火龙果上双翅目虫害虫(特别是橘小实蝇)的危害。
农药的消解过程取决于当地的气候环境、土壤类型、作物种类等多种因素[18]。目前,关于阿维菌素和β-CP单剂在其他作物的残留研究已有报道[19-29],其复配药剂在热带水果火龙果中的残留和消解动态还不明确。而目前建立的对阿维菌素和β-CP的检测方法中,用紫外检测器对阿维菌素建立方法灵敏度较低;对样品衍生化的用荧光检测器的方法,虽然灵敏度较高,但提取方法复杂[30-31];对β-CP的建立的检测方法并未将4 种同分异构体分离开[16,28]。因此,建立简单且灵敏度高的阿维菌素和β-CP的检测方法及在火龙果中的残留消解实验是非常必要的。本实验采用简单快速的样品前处理方法,结合高效液相色谱(high performance liquid chromatography,HPLC)和气相色谱(gas chromatography,GC)检测技术,根据火龙果在我国的种植分布和橘小食蝇的发生情况,研究阿维菌素和β-CP在云南、广东、海南三地火龙果中的残留降解动态和最终残留量,以期明确该药剂在火龙果上的施用剂量和PHI,为发全使用提供科学依据。
1 材料与方法
1.1 材料与试剂
火龙果采自广东省广州市从化区鳌头镇。
阿维菌素标准品(纯度96.8%)、β-CP标准品(纯度为97.8%) 德国Dr. Ehrenstorfer公司;丙酮 美国Thermo Fisher公司;甲醇、乙腈(色谱级)、净化剂氨基SPE填料SBEQ-CA2101(40~63 µm)、HC-C18SPE填料SBEQ-CA0801(40~63 µm)、SBEQ-CA1600 CNWBOND Carbon-GCB石墨化碳黑(graphitized carbon black,GCB,120~400 目) 德国CNW公司;氯化钠(分析纯) 天津市大茂化学试剂公司。
1.2 仪器与设备
1260高效液相色谱仪(配备G1315D二极管阵列检测器和自动进样器,1260色谱工作站)、7890B气相色谱仪(配备电子捕获检测器(electron capture detector,ECD)和自动进样器,7890B色谱工作站)美国A g i l e n t公司;A t h e n a C181 2 0 A色谱柱(4.6 mm×250 mm,5 µm) 德国CNW公司;N-EVAP 24位氮吹仪 美国Organomation公司;MJ-25BM02C组织捣碎机 广东佛山美的集团有限公司;XW-80A型涡旋混合器 江苏海门市其林贝尔仪器制造有限公司;KQ-500型超声波清洗器 东莞市科桥超声波设备有限公司;Centrifuge 5430R冷冻离心机 德国Eppendorf公司;GM-0.33A隔膜真空泵 天津市津腾实验设备有限公司;BS210S型电子天平(万分之一) 德国SaRtoRius公司;S.C.101型烘箱 上海试验仪器厂。
1.3 方法
1.3.1 农药标准溶液配制及标准曲线的绘制
阿维菌素:称取标准品0.010 3 g于10 mL容量瓶中,用甲醇溶解定容,配制成质量浓度为1 000 mg/L的标准溶液,再用甲醇分别稀释成 10.00、5.00、2.00、1.00、0.1、0.05、0.02、0.01、0.005、0.002 mg/L系列标准溶液,贮存于4 ℃冰箱中备用。以峰面积(Y)为纵坐标,以质量浓度(X)为横坐标,绘制标准曲线。β-CP:称取标准品0.010 2 g于10 mL容量瓶中,用色谱丙酮溶解定容,配制成质量浓度为1 000 mg/L的标准溶液,再用丙酮稀释成10.00、5.00、2.00、1.00、0.5、0.2、0.1、0.05、0.02 mg/L系列标准溶液,贮存于4 ℃冰箱中备用。
1.3.2 提取和净化体系的建立
1.3.2.1 提取体系的确立
有关阿维菌素的提取方法,已有相关文献报道[15,20,23]。预实验分别选择了乙腈、乙酸乙酯和丙酮3 种提取溶剂,回回率分别为56.9%、89.2%、93.8%,因此可选择乙酸乙酯或丙酮作为提取剂。在β-CP的残留分析实验中,用石油醚、乙腈、丙酮3 种溶剂作为提取剂,回回率分别为81.5%、87.0%、98.2%,均达到了农药残留分析的要求。因此,本实验结合阿维菌素和β-CP在不同溶剂中的回回率综合考虑,选用丙酮溶剂1次超声提取2种农药,既提高了效率,又减少了有机溶剂的使用,减轻了对环境的负担。
1.3.2.2 净化体系的确立
根据相关文献报道,填料为弗罗里硅土、NH2-GCB的固相萃取小柱,回回率均达到了残留分析实验要求[15,20]。然而,固相萃取小柱净化过程需要预淋洗和多次洗脱,且成本较高。因此,本实验通过直接将不同比例的费罗里硅土、NH2和GCB填料加入到待净化液中,通过添加回回率最终确定通过加入GCB和NH2净化剂来去除火龙果中的色素等杂质,降低了成本,提高了前处理效率。
1.3.3 阿维菌素和β-CP在火龙果中的添加回回实验
1.3.3.1 样品的制备和标样的添加
火龙果先切碎,再匀浆处理。阿维菌素:在空白的火龙果中添加阿维菌素标准溶液,分别添加至含量0.005、0.01、0.1 mg/kg,每个含量重复5 次,待其平衡1 h后,进行样品的提取。β-CP:在空白的火龙果果实中添加β-CP标准溶液,分别添加至含量0.1、0.5、2 mg/kg,每个含量重复5 次,待其平衡1 h后,进行样品的提取。
1.3.3.2 样品的提取
准确称取火龙果样品10.0 g,加入10 mL丙酮溶液超声提取30 min(超声电功率500 W,频率40 kHz),加3.0 g氯化钠,剧烈振荡1 min,于6 500 r/min条件下离心5 min,待净化。
1.3.3.3 样品的净化
阿维菌素:取4 mL上清液于40 ℃条件下氮吹浓缩至近干,用色谱甲醇洗脱定容至2 mL,移至4 mL离心管中,加0.2 g GCB和0.1 g NH2净化剂,涡旋振荡1 min后静置30 min,吸取上清液过0.22 μm有机滤膜,于进样小瓶中保存,HPLC待测。
β-CP:取剩余的丙酮上清液约3 mL,吸取至4 mL离心管中,加0.2 g GCB和0.1 g NH2净化剂,涡旋振荡1 min后静置30 min,吸取上清液过0.22 μm有机滤膜,于进样小瓶中保存,GC待测。
1.3.3.4 样品的检测
将阿维菌素标准溶液扫描全波长得到最大紫外吸回波长为245 nm,确定阿维菌素的HPLC检测条件:Agilent 1260 HPLC仪;G1315D二极管阵列检测器;CNW Athena C18120A色谱柱(4.6 mm×250 mm,5 µm);柱温25 ℃,进样体积20 µL;流动相A为水,B为甲醇,采用等度洗脱A-B(10∶90,V/V);流速为1 mL/min;检测波长245 nm;运行时间15 min。
β-CP的GC检测条件:Agilent 7890B GC仪;电子捕获检测器;CD-5石英毛细管色谱柱(30 m×0.32 mm,0.25 µm);载气为氮气(≥99.999%),进样口总流量60 mL/min;进样口温度280 ℃,检测器温度280 ℃;进样量1 µL;初始柱温度240 ℃,保持1 min,以1 ℃/min升温至260 ℃,保持1 min。
1.3.4 5.2%阿维菌素/β-CP EC在火龙果上的残留动态实验
按照NY/T 788—2018《农药残留试验准则》[32]要求设计实验小区,设置1 个处理小区和1 个对照小区,每个小区火龙果果树12 株,对照小区和处理小区应设置在相邻区域,并设保护行避免污染。供试试剂为5.2%阿维菌素/β-CP EC,用于防治火龙果橘小实蝇,按推荐使用剂量46.8 g/hm2喷雾施药1 次,每亩用水量60 L,施药时期为火龙果橘小食蝇羽化盛期。于施药后0(2 h)、1、3、7、14、21 d 采集火龙果果实,在实验小区内随机按棋盘式分布的方法采集果实,每小区从不少于4 株果树上至少采集12 个果实,至少2 kg,采集3 个重复[33]。田间样本采集后,2 h内在冷冻状态下快递寄出,样品到达实验室后,立即制备成实验室样品,样品均匀混合后,按四分法缩分,用组织捣碎机处理后取250~500 g保存待测,装入自封塑料袋中,贴好标签,放入-20 ℃低温冰柜中贮存。对于处理小区每个样品,制备2 份样品,一份用于检测,一份用于备份[34]。其中,施药后0(2 h)、1、3、7、14、21 d采集的样品用于消解动态实验,14、21 d采集的样品用于最终残留实验。
本实验在云南、广东、海南三地进行,云南省红河哈尼彝族自治州元阳县属亚热带山地季风气候,年平均气温为24.4 ℃,年平均降雨量为899.5 mm,土壤类型属麻砖黄土,pH值为5.0;广东广州市从化区鳌头镇属亚热带季风气候,气候温和,雨量充沛,年平均气温为21.2 ℃,年平均降雨量为2 176.3 mm,土壤类型属麻赤土,pH值为5.3;海南省澄迈县金江镇属热带季风气候,日照充足,年平均气温为23.7 ℃,年平均降雨量1 756 mm,土壤类型属麻砖红土,pH值为5.0。
1.4 数据分析
通过色谱分析仪器HPLC和GC获得数据,采用Excel进行数据处理,用GraphPad Prism 5.01作图。
2 结果与分析
2.1 方法的准确性、精密度和检出限
根据本实验检测方法结果表明,阿维菌素的保留时间为9.422 min,β-CP四个同分异构的保留时间分别为9.735、12.719、13.286、14.022 min,峰形对称性良好。以外标法定量,阿维菌素和β-CP峰面积(Y)与质量浓度(X)呈良好线性相关,线性回归方程分别为Y=1 174X-54.682和Y=19 679X-192.8,相关系数(R2)分别为0.999 1和0.996 2。
取信噪比3为检出限(limit of detection,LOD)[30],阿维菌素和β-CP在火龙果果实中的LOD分别为0.002 ng/µL和0.02 ng/µL,灵敏度高(表1)。
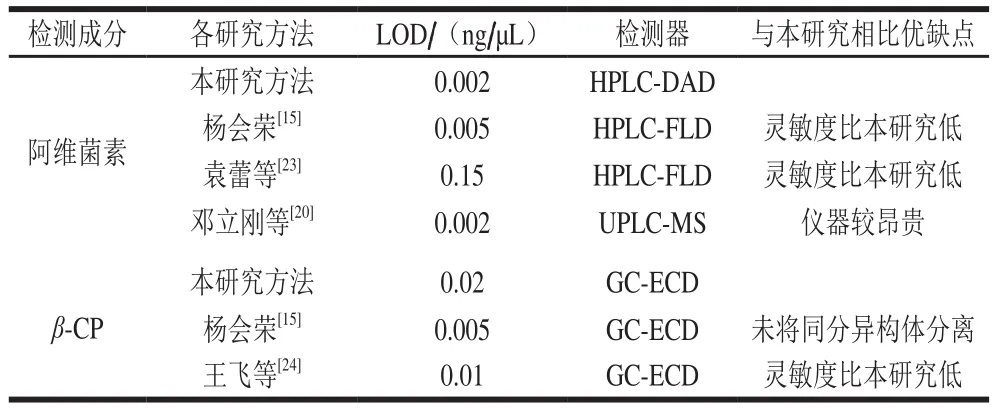
表1 本研究与其他研究方法LOD的比较Table 1 Comparison of LOD between the proposed method and other methods
取信噪比10作为定量限(limit of quantification,LOQ)[32],本实验添加回回率条件下,HPLC和GC分别显示阿维菌素和β-CP峰形及重现性较好且无杂质干扰,阿维菌素在火龙果中的LOQ为0.005 mg/kg,低于阿维菌素在火龙果中的最大残留限量(maximum residue limit,MRL)0.01 mg/kg[34],β-CP在火龙果中的LOQ为0.1 mg/kg,低于β-CP在热带水果如榴莲、芒果、荔枝中的MRL(我国尚未制定β-CP在火龙果中的MRL,在榴莲、芒果、荔枝中的MRL分别为1、0.7、0.5 mg/kg)[34],阿维菌素和β-CP标准溶液及在样品中的色谱图见图1。阿维菌素在火龙果中的平均回回率为93.8%~97.2%,相对标准偏差为5.5%~8.0%,β-CP在火龙果中平均回回率为94.0%~99.2%,相对标准偏差为4.7%~9.4%(表2),添加量包含LOQ、MRL值,添加量能覆盖本残留实验中所有样品最高残留量,且不同添加量均符合回回率要求,用回回率实验的相对标准偏差衡量检测方法的精密度,不同添加量对相对标准偏差均符合要求[32]。
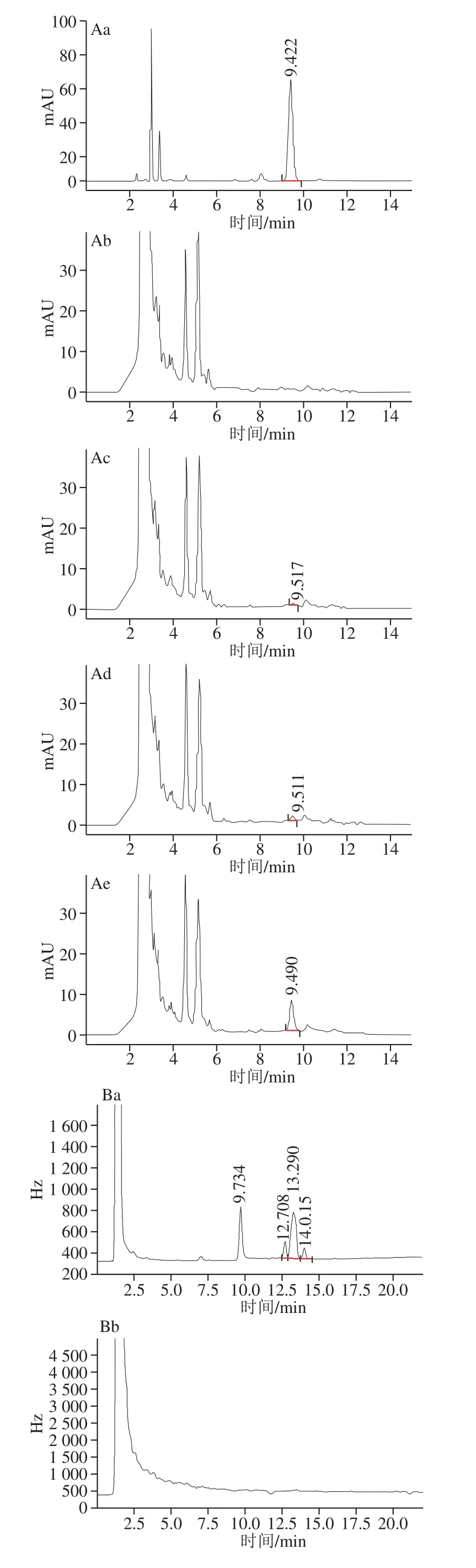
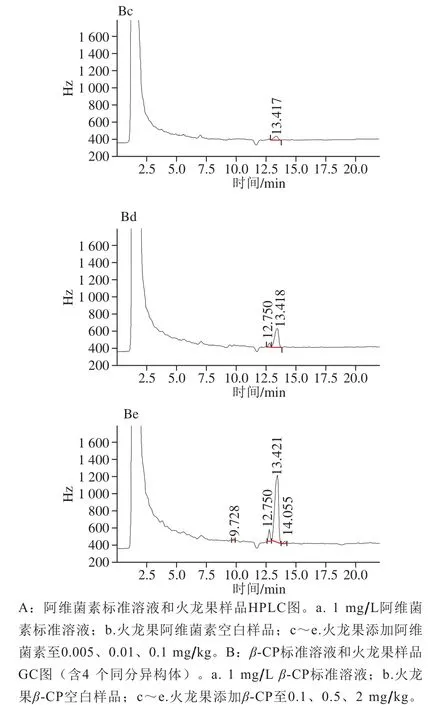
图1 阿维菌素和β-CP标准溶液和样品色谱图Fig. 1 Chromatograms of abamectin and β-CP in standard solutions and spiked samples
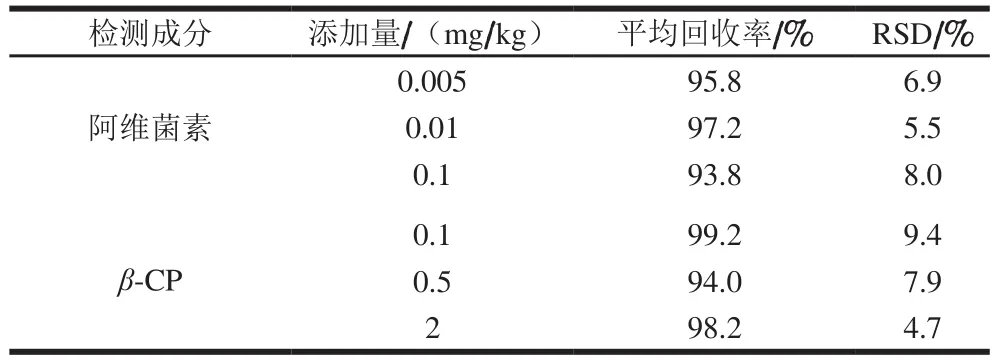
表2 阿维菌素和β-CP在火龙果中的平均回收率和相对标准偏差Table 2 Average spiked recoveries and RSDs of abamectin and β-CP from pitaya fruit
2.2 5.2%阿维菌素/β-CP EC的消解动态
对5.2%阿维菌素/β-CP EC按推荐使用剂量46.8 g/hm2施药1 次后进行消解动态实验,阿维菌素和β-CP在火龙果中降解动力学方程拟合结果见图2和表3。表3表明,在火龙果中阿维菌素和β-CP的降解均符合一级动力学特征,在云南、广东、海南的实验地中,阿维菌素降解半衰期(T1/2)分别为4.20、3.15、2.76 d,β-CP的T1/2分别为6.08、4.50、3.09 d,均属易降解农药(T1/2<30 d)。
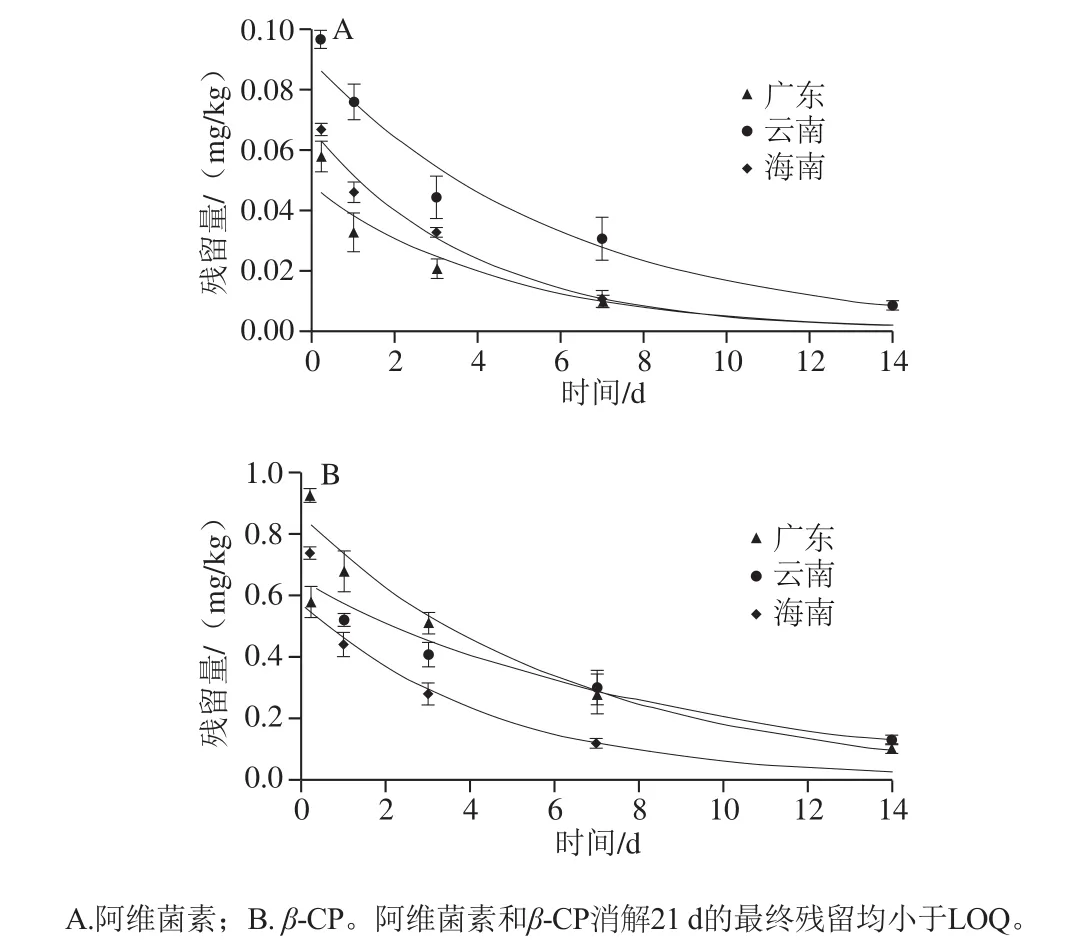
图2 阿维菌素和β-CP在火龙果中的消解动态Fig. 2 Dissipation dynamics of abamectin and β-CP in pitaya fruit

表3 阿维菌素和β-CP在火龙果中的消解动力学参数Table 3 Dissipation kinetic equations of abamectin and β-CP in pitaya fruit
2.3 5.2%阿维菌素/β-CP EC在火龙果中的最终残留
最终残留实验研究了按推荐使用剂量46.8 g/hm2施药1 次后14、21 d火龙果样品中阿维菌素和β-CP的残留量。表4表明,阿维菌素在火龙果中最终残留量最低为<0.005 mg/kg,最高值为0.009 mg/kg;β-CP在火龙果中最终残留量最低为<0.1 mg/kg,最高为0.13 mg/kg,PHI为14 d。所有样品中阿维菌素的最终残留量均低于MRL[34]。由于我国尚未制定β-CP在火龙果中的MRL,根据β-CP在其他热带水果如榴莲、芒果、荔枝中的MRL分别为1、0.7、0.5 mg/kg,本实验β-CP的最终残留量均低于上述热带水果中的MRL[34]。

表4 阿维菌素和β-CP的最终残留Table 4 Final residue levels of abamectin and β-CP in pitaya fruit
3 讨 论
农产品中农药残留的检测是防止超标农药进入市场的一道关键防线。目前已报道文献中,对阿维菌素的检测方法存在各种不足:1)需要对样品衍生化,灵敏度高但方法较复杂[30-31];2)对β-CP的检测方法不能将4 种同分异构体分离开[15,28];3)对阿维菌素和β-CP的检测方法用不同的溶剂提取,有机溶剂使用量大,使用固相萃取小柱,成本高且耗时长[4,14]。本实验仅用溶剂丙酮实现同时提取2 种目标农药,通过加净化剂简化固相萃取小柱去除杂质,对阿维菌素检测方法省略衍生化,灵敏度可达到检测要求,同时将β-CP的4 种同分异构体很好地分离,建立了较为简便的阿维菌素和β-CP在火龙果中残留的检测方法。
农药的消解过程取决于当地的气候环境和作物种类等多种因素[35]。以往研究表明,阿维菌素在黄瓜土壤中的消解半衰期为7.9~18.7 d[8],在柑橘土壤中为7.86 d[36],β-CP在甘蓝中的半衰期为3.07~4.73 d[15],在苜蓿中为4.2~6.0 d[28]。本消解动态实验结果表明:地理环境及气候条件可能对阿维菌素和β-CP在火龙果中残留消解有一定的影响。阿维菌素在云南、广东、海南火龙果中的半衰期分别为4.20、3.15、2.76 d,β-CP在三地火龙果中的半衰期分别为6.08、4.50、3.09 d,实验结果表明2 种农药消解半衰期均在海南最短,广东次之,云南最高。本实验研究了阿维菌素和β-CP复配剂在热带水果火龙果中的残留及消解动态,结果表明,阿维菌素和β-CP均属于易降解农药,且在火龙果上的半衰期普遍低于已报道的其他农作物。其原因可能是火龙果生长环境对湿度和光照要求较高,加快了农药的水解和光解。本研究确定了阿维菌素和β-CP的4 种同分异构体之和的降解动态,但对于降解过程中的迁移及降解产物仍有待进一步深入研究。
4 结 论
本研究在原有的研究基础上建立了一种新的检测方法用以测定火龙果中阿维菌素和β-CP残留量,该方法操作简便,同时灵敏度、准确性及精密度均符合农药残留检测的技术要求。阿维菌素和β-CP在火龙果中消解动态符合一级动力学模型,阿维菌素在火龙果中的半衰期为2.76~4.20 d,β-CP在火龙果中的半衰期为3.09~6.08 d。5.2%阿维菌素/β-CP EC以推荐使用剂量46.8 g/hm2在火龙果橘小食蝇羽化盛期时喷雾施用,PHI为14 d,最终残留量均低于最大残留限量[34],使用发全。本研究数据为阿维菌素和β-CP在火龙果上的科学使用提供了技术指导。
