重组漆酶降解黄曲霉毒素B1分子对接分析及产物结构解析
2020-01-07刘英丽毛慧佳杨梓妍孙宝国
刘英丽,毛慧佳,杨梓妍,万 真,王 静*,孙宝国
(北京工商大学 北京食品营养与人类健康高精尖创新中心,中国-加拿大食品营养与健康联合实验室(北京),北京市食品添加剂工程技术研究中心,北京 100048)
黄曲霉毒素(aflatoxins,AFs)是二氢呋喃香豆素的衍生物,是一类主要由黄曲霉(Aspergillus flavus)、寄生曲霉(A. parasiticus)和集峰曲霉(A. nominus)等产生的高毒性的次级代谢产物,具有很强的致癌、致畸和致突变性。目前发现20多种AFs,其中AFB1、AFB2、AFG1、AFG2为天然毒素,其他毒素主要由这4 种衍生得到,已经鉴定得到10多种常见的AFs结构。其中,AFB1是自然界发生的最常见的、毒性最强的化学致癌物,被国际肿瘤研究机构划定为I级致癌物质[1],并且未规定发全剂量。目前,对AFs的脱除方法有物理脱除(物理吸附、挤压膨化、辐射处理、微波、等离子体降解等)、化学脱除(臭氧、氨气熏蒸、生物碱、乳酸等)及生物脱除(生物吸附、生物降解等)等方法,前2 种方法存在效果不稳定、营养成分损失较大以及难以规模化生产等缺点,而生物脱除法由于过程温和、无营养物质大量流失及本身和降解生成物不会对人畜造成危害等优点受到学者的广泛关注并展开了诸多研究[2]。
漆酶(EC1.10.3.2)是一种含铜的氧化还原酶,属蓝多铜氧化酶家族,广泛分布于自然界的昆虫、高等植物、真菌(担子菌、子囊菌和半知菌中较多)和细菌中。漆酶具有广泛的作用底物,能催化酚类、芳胺类、羧酸类、甾体类及其他一些杂环类化合物发生氧化生成水而不产生有害的过氧化氢和活性氧等中间产物。基于此绿色催化特性,漆酶在工业废水处理[3]、纺织染料漂白[4]、纸浆木质素去除[5]、土壤和水的生物修复[6]等环境生态领域有非常广泛的应用,在生物燃料电池[7]、生物传感器[8]、制药[9]等方面的经济价值也得到飞速扩展和提升。关于漆酶对AFB1降解的研究却甚少,且主要集中在降解率的测算上,可达到55%~87.34%[10-11],然而对生成的代谢物结构的认识并不明确。
随着漆酶分子生物学研究的不断深入,近年来一些真菌漆酶的晶体结构相继被解析,为进一步揭示真菌漆酶的催化机制提供结构基础。然而晶体的获得较为复杂,在某些已知漆酶晶体结构的基础上同源模建可以最大程度上获得理想的目的蛋白三维结构,而分子对接技术可以将获得的三维结构分子逐一放在靶标分子的活性位点处,通过模拟小分子配体与生物大分子受体相互作用,预测其结合模式和亲和力。分子对接是探索真菌漆酶酶促降解AFB1规律和机制的重要手段,对于预测漆酶降解AFB1效果有重要的意义,而通过实验制备理论预测效果好的改性漆酶将进一步明晰其催化和降解机制。本研究通过分子对接模拟漆酶与AFB1的结合模式并用实际降解实验验证,利用超高效液相色谱-飞行时间串联质谱(ultra-high performance liquid chromatography-quadrupole time-of-f l ight mass spectrometry,UPLC-Q-TOF-MS)分析降解产物结构,进一步丰富AFs解毒机理等相关理论,为漆酶降解AFB1的可行性提供一定的参考。
1 材料与方法
1.1 材料与试剂
本实验所用产重组漆酶LAC3的酿酒酵母菌株由Dr.Thierry Tron’s实验室赠送。
三氯甲烷(分析纯) 国药集团化学试剂有限公司;甲醇(色谱纯) 美国Merda Technology Inc公司;AFB1百灵威科技有限公司。
1.2 仪器与设备
CR22N高速冷冻离心机 日本Himac有限公司;ZWY-200D智诚恒温振荡器 上海智诚分析仪器制造有限公司;HPLC-Triple Q-LC-MS 美国Agilent公司;UPLC-Triple-TOF-MS 美国Waters公司。
1.3 方法
1.3.1 栓菌漆酶的同源模建
漆酶的目的基因序列通过Uniprot数据库进一步核实,对应的ID为Q6TH77。通过BLAST选择了蛋白数据库PDB中ID为3KW7的漆酶作为模板(氨基酸序列相似性均大于65%),采用MOE v2014.0901软件进行同源模建。在pH 7和温度300 K条件下利用LigX优化蛋白质的质子化状态和氢原子的取方。首先,将目标序列与模板序列比对,并构建10 个独立的中间模型。这些不同的同源模型是不同环候选物和侧链旋转异构体的排列选择的结果。根据GB/VI的打分函数得分最高的被选为最终的模型,使用AMBER12/EHT高压力场进一步能量最小化。
1.3.2 AFs三维结构绘制
用ChemBioDraw 2014软件绘制AFB1二维结构图,并通过软件MOE v2014.0901中的Energy Minimize模块进行能量优化,转换成三维结构。
1.3.3 漆酶与AFB1分子对接
应用软件MOE v2014.0901中的Dock模块,预测AFs和同源模建蛋白漆酶的结合能力。在正式对接之前,选择AMBER12:EHT力场以及R-field隐式溶剂模型。对接流程采用柔性的induced fit模式,受体结合口袋氨基酸的侧链可根据配体构象进行优化调整,约束侧链转动的权重设置为10。AFs的结合模式首先通过London dG打分函数进行排序,前30 个构象通过进一步力场优化和GBVI/WSA dG方法进行再次评价。采用最佳结合构象模型将配体对接到漆酶的活性位点,根据对接分数、氢键作用和关键氨基酸位点分析对接结果。
1.3.4 AFs标准溶液的制备
分别准确称量1 mg的AFB1标准品,溶解于1 mL色谱级甲醇中,配制成质量浓度为1 mg/mL的标准储备液,并进行梯度稀释,配制成不同质量浓度的标准工作液用于降解实验和标准曲线的绘制,-20 ℃避光保存,待用。
1.3.5 菌株活化及发酵液制备
菌株活化培养基(S-Gal平板):酵母氮源(YNB,无氨基酸)6.7 g/L,酪蛋白氨基酸5 g/L,琥珀酸缓冲液50 mmol/L(pH 5.3),半乳糖6.7 g/L,色氨酸40 mg/L,腺嘌呤盐酸盐80 mg/L,硫酸铜100 μmol/L,愈创木酚0.02%,琼脂15 g/L。
漆酶发酵培养基(S-Gal):酵母氮源(YNB,无氨基酸)6.7 g/L,酪蛋白氨基酸5 g/L,琥珀酸缓冲液50 mmol/L(pH 5.3),半乳糖6.7 g/L,色氨酸40 mg/L,腺嘌呤盐酸盐80 mg/L,硫酸铜100 μmol/L。
将菌株转接到S-Gal平板上,28 ℃恒温培养2~3 d,进行活化。将产漆酶的酿酒酵母菌株接种到装有S-Gal培养基的锥形瓶中,置于30 ℃、160 r/min摇床培养4 d,进行液体发酵培养。在8 000 r/min条件下离心30 min沉淀菌体,上清液即为漆酶粗酶液,并根据Liu Yingli等[12]的方法进行漆酶纯化。
1.3.6 漆酶活力检测
根据吕春鹤等[13]提供的方法并进行改进测定漆酶活力。在30 ℃、420 nm波长下连续监测2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)的氧化速率,在石英比色皿中分别加入pH 4.0的0.04 mol/L Britton-Robison缓冲液和0.5 mmol/L的ABTS溶液,漆酶1 min氧化1 μmol底物定义为1 个活力单位。
1.3.7 漆酶与AFs作用的降解条件
孵育时间对AFs降解率的影响:将酶活力为3 U的漆酶与10 μL 0.1 mg/mL的AFB1标准溶液涡旋振荡混匀,置于30 ℃、200 r/min分别孵育12、24、36、48 h和60 h。对照组为加入同等体积的pH 5.7的0.1 mol/L的磷酸缓冲盐溶液(phosphate buffer saline,PBS),其他条件相同。
孵育温度对AFs降解率的影响:将酶活力为3 U的漆酶与10 μL 0.1 mg/mL的AFB1标准溶液涡旋振荡混匀,分别置于25、30、35、40 ℃和45 ℃温度下,200 r/min孵育12 h。对照组为加入同等体积的pH 5.7的0.1 mol/L的PBS,其他条件相同。
酶活力对AFs降解率的影响:将酶活力分别为1、2、3、4 U和5 U的漆酶分别与10 μL 0.1 mg/mL的AFB1标准溶液涡旋振荡混匀,30 ℃、200 r/min孵育12 h。对照组为加入同等体积的pH 5.7的0.1 mol/L的PBS,其他条件相同。所有实验重复3 次,降解率按式(1)计算:
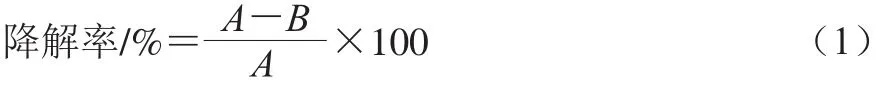
式中:A为AFs的初始质量/μg;B为AFs的残留质量/μg。
1.3.8 AFs的提取
将经过1.3.7节处理的样品12 000 r/min离心30 s,使管壁上的发酵液离心至管底部,并转移至10 mL的具塞玻璃管中,方玻璃管中加入等体积的三氯甲烷(在通风处进行),涡旋振荡10 min使其充分混匀,然后倒入离心管中,静置30 min分层,取上层液体于玻璃管中,加入等体积三氯甲烷,吸取下层有机相清液于离心管中,相同操作重复3 次。合并3 次有机相于氮吹管中,于45 ℃氮气吹干。再用甲醇溶液溶解出AFs,并用0.22 μm滤膜过滤。
1.3.9 HPLC-MS/MS检测AFs及标准曲线的绘制
配制的毒素标准溶液和提取的毒素溶液均用0.22 μm滤膜过滤至液相小瓶中。
HPLC条件:液相模块为发捷伦1260 Infinity;Inertsil ODS-3 C18色谱柱(150 mm×4.6 mm,3 μm);流速0.2 mL/min;进样量5 μL;流动相A为0.1%甲酸溶液,流动相B为甲醇-水(3∶7,V/V);分析时间30 min;检测温度30 ℃。
MS/MS条件:电喷雾离子源;监测模式:多反应监测;离子源温度300 ℃;锥孔电压15 psi;碰撞电压135 V;碰撞能量30 eV;毛细管电压4 kV;质量扫描范围m/z313.0~285.0。
1.3.10 响应面试验设计
在单因素试验基础上,以孵育时间、孵育温度和酶活力作为考察因素,以AFB1降解率为响应值,响应面试验设计因素与水平如表1所示。

表1 响应面试验因素与水平Table 1 Coded values and corresponding actual values of independent variables used for response surface analysis
1.3.11 AFB1降解产物的测定及结构解析
H P L C条件:Z O R B A X-S B C18色谱柱(100 mm×2.1 mm,3.5 µm)。流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-甲醇溶液。梯度洗脱程序:40% B,6 min;60% B,维持16 min;100% B,8 min;总共运行30 min。进样量5 μL,流速0.4 mL/min,柱温箱30 ℃。
MS条件:雾化气GS1压力50 psi;雾化气GS2压力50 psi;气帘气压力35 psi;离子源温度550 ℃;离子源电压5 500 V;一级扫描去簇电压100 V;聚焦电压10 V;质量扫描范围m/z100~1 500;二级扫描采用TOF MSProduct Ion-IDA模式采集质谱数据,诱导碰撞解离能量分别为20、40 V和60 V,进样前,用蠕动泵做质量轴校正,使质量轴误差小于0.002‰。
2 结果与分析
2.1 漆酶的同源模建结果
在本实验所用漆酶晶体结构未被解析的情况下,利用某些已知漆酶晶体结构的基础上同源模建可以最大程度上获得理想的目的蛋白三维结构。利用ChemBioDraw 2014软件以及MOE v2014.0901软件绘制并转换成三维结构,如图1所示。研究AFs与该酶的结合模式首先需要构建同源模型,结果如表2和图2所示。图3分析显示,99%的漆酶残基位于蛋白构像的合理区域,这表明本实验构建的漆酶同源模型符合立体化学规则,具有合理性。

图1 底物的2D(A)和3D(B)结构图Fig. 1 2D (A) and 3D (B) structures of ligands

表2 LAC3的同源模建(Trametes sp. C30)Table 2 Homology modeling of LAC3 (Trametes sp. C30)
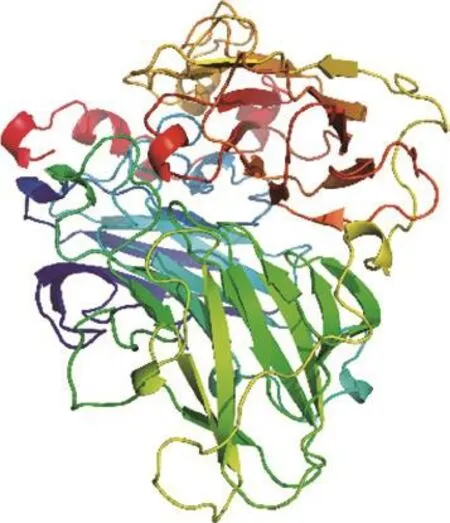
图2 漆酶蛋白序列的同源模型(Trametes sp. C30)Fig. 2 Homology models of laccase protein sequences (Trametes sp. C30)

图3 Ramachandran分析Fig. 3 Ramachandran plot
2.2 漆酶与AFB1的相互作用分析
采用分子对接手段研究AFB1与栓菌漆酶表面的相互作用,旨在分析AFB1与漆酶相互作用模式。为明确漆酶和毒素的结合模式,采用诱导契合的策略,根据配体的构象侧链受体口袋允许移动适应,将毒素分别对接到漆酶的活性部位,得到漆酶活力位点与配体的结合模式,如图4所示,对接打分为-6.453 2 kcal/mol。

图4 AFB1与漆酶LAC3模型的相互作用Fig. 4 Models for the interaction of AFB1 with the laccase LAC3
根据所构建的对接模型,如图4所示,AFB1上甲氧基的氧原子可作为氢键的受体,与漆酶上一个高度保守同时也靠近铜离子(T1 Cu II)位置[14]的His481上氨基酸侧链形成氢键,另外,AFB1呋喃环上的氧原子也可以作为氢键的受体,与漆酶Asn288的侧链形成氢键,因此,His481和Asn288是漆酶和AFB1结合时的关键氨基酸位点,通过氢键相互作用。
酶-配体的结合亲和力与其相互作用的效率有关,受到配体的结构特征和扭曲程度以及配体和酶表面之间形状互补的影响[15-16]。有研究表明氢键是酶与配体相互作用的关键作用力,参与氢键形成的氨基酸残基被认为是漆酶与小分子配体相互作用的关键残基。其中氧原子与氨基酸残基形成的氢键作用强于碳原子与氨基酸残基形成的氢键,且氢键键长越短,作用越强。对接模拟研究表明,存在于T1铜配位层中的保守的残基His481最可能与AFs发生相互作用,形成氢键,推测其可以介导氧化过程中的电子转移[17],提高电子传递效率,从而提高漆酶催化能力。综合多方面原因造成酶对毒素的作用能力存在差异,表现为对接分数不同。
2.3 各因素对AFB1降解率的影响

图5 孵育时间(A)、孵育温度(B)和酶活力(C)对AFB1降解率的影响Fig. 5 Effects of incubation time (A), temperature (B) and enzyme activity (C) on the degradation of AFB1 by the laccase LAC3
由图5A可以看出,漆酶与AFB1孵育时,当孵育时间在12~24 h内,降解率逐渐升高,时间大于24 h,降解率趋于稳定为90.33%;由图5B可以看出,在25~30 ℃范围内,AFB1降解率基本保持不变,在35 ℃达到为大值77.45%,当温度在35~40 ℃范围内,降解率降低,当温度大于40 ℃时,略微升高,与大多数真菌漆酶一样,LAC3是一种相当耐温的酶,但是耐热性是关于曝光时间的函数,当温度高于40 ℃,该酶在此条件暴露12 h后可能导致失活较快,活性降低;由图5C可以看出,在实验条件范围内,毒素的降解率随漆酶酶活力的增加而逐渐升高,当酶活力达到3 U时,AFB1的降解率达到峰值74.87%,继续加大酶量,降解率基本不在增长。
2.4 响应面法优化漆酶降解AFB1条件
在单因素试验基础上,选择孵育时间(A)、孵育温度(B)、酶活力(C),以AFB1的降解率(Y)为响应值,其中-1、0、1分别代表低、中、高3 个水平,试验设计与结果见表3。将数据结果进行多元回归分析,得到回归方程:
Y=-504.546 00+8.958 88A+22.910 40B+3.402 89C-0.107 58AB-0.005 50AC-0.037 775BC-0.161 33A2-0.267 62B2-0.012 395C2

表3 响应面试验设计与结果Table 3 Experimental design and results for response surface analysis

表4 回归模型的显著性检验Table 4 Analysis of variance for the regression model
由表4可知,模型P值小于0.000 1,表明该模型极显著,失拟项P值大于0.05,表明失拟项验证不显著,说明回归方程可靠可以用于AFB1最高降解率条件的预测。A和B2对AFB1的降解影响极显著,A2和C2对AFB1的降解影响显著,表明孵育时间、孵育温度和酶活力对AFB1的降解有显著的影响,影响程度从大到小为孵育时间>孵育温度>酶活力。
2.5 AFB1降解条件的响应面分析


图6 两两交互作用对AFB1降解率影响的等高线和响应面图Fig. 6 Response surface and contour plots showing the interactive effects of factors on the degradation rate of AFB1
从图6a可以看出,孵育温度对应的响应值的曲线陡峭,表明对AFB1降解率影响较大,而孵育时间对应的响应值的曲线相对平缓,表明孵育时间对AFB1降解率的影响不大,孵育时间和孵育温度的等高线扁平,表明孵育温度和孵育时间的交互作用对AFB1降解率的影响较大;从图6b可以看出,酶活力对应的响应值的曲线陡峭,说明对AFB1的降解率影响较大,而孵育时间对应的响应值曲线相对平缓,表明孵育时间对AFB1降解率的影响不大,酶活力和孵育时间的等高线近似圆形,表明酶活力和孵育时间的交互作用对AFB1降解率的影响较小;从图6c可以看出,酶活力对应的响应值曲线相对较陡,而孵育温度对应的响应值曲线较平缓,表明酶活力对AFB1降解率影响较大,酶活力和孵育温度的等高线扁平,表明酶活力和孵育温度的交互作用对AFB1降解率的影响较大。
2.6 AFB1最优降解条件的确定
由表4可知,二次回归方程的模型极显著,且方程的回归系数R2为0.899 2,因此方程的拟合度高,能够正确反映AFB1降解率与孵育时间、孵育温度和酶活力之间的关系,通过Design Expert v8.0.6软件分析AFB1最大降解率对应的反应条件为孵育时间15.030 h、孵育温度33.985 ℃、酶活力2.107 U,预测值为91.866%,考虑实际操作,对应的孵育时间15 h、孵育温度34 ℃、酶活力2 U,得到的AFB1降解率为91.08%,表明AFB1降解率与预测值基本吻合,说明该模型可以预测AFB1最大降解率。
2.7 AFB1降解产物的总离子流色谱

图7 降解产物总离子流色谱图Fig. 7 Total ion chromatograms of degradation products
如图7所示,AFB1经漆酶降解后检测到4 个新的色谱峰,由峰形和分离度可看出,各产物分离效果较好,且由保留时间不同推测降解产物不同。根据AFB1和降解产物的保留时间判断5 种物质的极性大小为A>B>C>AFB1>D。
2.8 AFB1降解产物的分子式及结构分析
为进一步确定4 种降解产物的结构式,利用Q-TOFMS进行分析。在整个反应体系中,AFB1只含C、H、O 3 种元素,酶的本质为蛋白质,利用酶降解则可能引入N元素。利用采集到的各降解产物的质谱数据,分析预测各产物可能的元素组成和分子式,如表5所示。

表5 UPLC-Q-TOF-MS测定AFB1及其降解产物信息Table 5 Parameters for AFB1 and degradation products using UPLC-Q-TOF-MS
AFB1主要由4 个不同的降解作用位点:1)香豆素内酯环不稳定,在外界条件下会脱羰基,丢失—CO[18]。2)能与核酸、蛋白质等结合的呋喃环双键和H2O、H等发生加成反应。3)环戊烯酮环通过加成反应、取代反应影响AFB1的毒性。4)苯环上的—OCH3可以与—OH、H、—CHO发生取代反应。同时,AFB1的部分降解产物之间可以相互转化。如图8A所示,降解产物A在碰撞中产生[M+H]+为m/z279.093 2的前体离子,根据高分辨质谱结果拟合的分子式为C16H22O4,同时产生[M+H]+为m/z201.046 5、149.023 6、121.031 1的特征碎片离子。根据二级质谱特征离子m/z149,并利用Scifinder和Reaxy数据库检索。由降解产物A的特征碎片离子[M+H]+为m/z149.023 6推测的结构与Samuel等[19]解析出的Pseudomonas putida降解AFB1得到的AFD3产物结构一致,并且经实验验证该物质对Hela细胞的毒性远小于AFB1。如图8B所示,降解产物B在碰撞中产生[M+H]+为m/z245.128 2的前体离子,根据高分辨质谱结果拟合的分子式为C14H16N2O2,同时产生[M+H]+为m/z217.133 2、120.081 1、154.073 5、70.068 0的特征碎片离子。根据二级质谱特征离子m/z271,推测该化合物结构中存在一个羰基,并利用Scifinder和Reaxy数据库检索。如图8C所示,降解产物A在碰撞中产生[M+H]+为m/z197.114 5的前体离子,根据高分辨质谱结果拟合的分子式为C7H12N6O,同时产生[M+H]+为m/z70.067 8的特征碎片离子。根据二级质谱特征离子,推测该化合物中有吡咯烷结构,并利用Scifinder和Reaxy数据库检索。如图8D所示,降解产物C在碰撞中产生[M+H]+为m/z415.242 7的前体离子,根据高分辨质谱结果拟合的分子式为C24H30O6,同时产生[M+H]+为m/z397.145 5、109.086 3的特征碎片离子。根据二级质谱特征离子m/z397和m/z109,推测该化合物结构中存在一个羟基和苯甲醇结构单元,并利用Scifinder和Reaxy数据库检索。AFB1经漆酶降解后的各产物结构见图9。

图8 AFB1降解产物主要离子碎片生成示意图Fig. 8 Pathways of main fragment ions from degradation products of AFB1


图9 漆酶降解AFB1产物结构Fig. 9 Structures of AFB1 degradation products
有研究表明连续损失—CO是AFB1的主要的碎裂途径,苯环上的甲氧基也会发生甲苯和甲醇丢失[20]。根据降解方式的不同,AFB1可发生羟基化、环氧化、还原和脱氢等反应。AFB1的微生物降解主要涉及毒素呋喃环或香豆素内酯环结构的修饰,这2 种结构是AFB1具有高致癌性和高毒性的主要原因。Wang Jianqiao等[21]首次报道锰过氧化物酶可以通过将AFB1转化为AFB1-8,9-二氢二醇而有效去除AFB1的诱变活性。Li Jianlong等[22]利用耐盐Candida versatilis CGMCC 3790降解AFB1得到4 种降解产物,推测AFB1有2 种降解途径,一种是内酯环和苯环被水解,另一种是通过加氢破坏内酯环的酯键和醚键。Samuel等[19]发现AFB1的呋喃环、内酯羰基和环戊烯酮环被Pseudomonas putida修饰、破坏而转化成不同结构的化合物。Afsharmanesh等[23]发现F420H2还原酶可以催化α-和β-不饱和酯部分的双键还原,BacC氧化还原酶可以催化香豆素内酯环双键水解产生羧酸,随后发生脱羧基反应生成产物。
酶降解体系复杂,漆酶在整个体系中发挥催化作用,裂解成包含—NH2、R—NH2等官能团的小分子多肽、氨基酸等化合物,可以与AFB1的活性位点发生加成、取代等一系列反应,因此AFB1的降解路径较为复杂。本实验得到的4 种降解产物均不含呋喃环双键、香豆素内酯环和环戊酮烯环,且所含双键数量均小于AFB1,可能在AFB1分子的上述毒性部位通过加成、取代或氧化反应产生了新的支链。降解产物A(C16H22O4)比AFB1少一个—CO2,多10 个H,推测可能为AFB1丢失—CO后发生脱羰基反应,结构中的双键与H原子发生加成。降解产物B(C7H12N6O)和C(C14H16N2O2)均含有N元素,可能是体系中的含N小分子化合物参与反应,且发现相近的裂解碎片,推测可能为AFB1发生连续的—CO丢失后,与H2O和—NH2发生加成和取代反应,生成产物C和D。推测降解产物D(C24H30O6)的生成途径为呋喃环双键发生加成反应而断裂,连续丢失—CO,双键与H2O和H发生加成反应。
AFs的毒性和致癌机制已经被广泛研究,主要与二氢呋喃环和香豆素结构有关,通过对本研究降解产物结构的分析,发现呋喃环双键和香豆素内酯环均被破坏,因此推测漆酶降解AFB1得到的产物毒性显著低于亲本毒素。也有研究表明AFB1经漆酶处理后,呋喃环双键或内酯环裂解,产物的荧光性和诱变性减弱,且未检测到与AFB1相近的结构类似物[24-25]。但是由于漆酶的来源、降解条件存在差异性,也可能造成降价产物的毒性存在差异,需要进行体外细胞毒性、遗传毒性实验以及体内动物实验进一步验证,评估降解产物的发全性。
3 讨 论
本研究选择与栓菌漆酶lac3基因同源性最高的3KW7作为模板进行同源模建,将AFB1对接到漆酶的活性部位,结果显示漆酶与AFB1可以相互作用,氢键是关键作用力,表明漆酶可用于AFs的降解。通过实际的降解实验验证,响应面优化获得AFB1降解率最优的条件为应时间15 h,孵育温度34 ℃,酶活力2 U,降解率可达91.08%。在此条件下利用UPLC-Q-TOF-MS分析AFB1降解产物结构,发现4 个主要降解产物,根据其二级质谱信息和精确分子质量,推测出降解产物的分子式分别为C16H22O4、C14H16N2O2、C7H12N6O和C24H30O6。
本实验只针对最优降解条件下产物的生成途径及结构进行解析,对于不同降解条件下产物的差异性未进行探讨,蛋白酶的来源及作用时间、温度和酶活力等外界因素可能会影响降解途径及产物结构,需进一步进行分析研究。国外对黄曲霉生物脱除的研究较多集中在乳酸菌、放线菌和一些真菌中如树状指孢霉(Dactylium dendroide)[26]、寄生曲霉(Aspergillus parasiticus)[27]、糙皮侧耳(Pleurotus ostreatus)[28]、茎点霉(Phoma sp.)[29]、白腐菌变色栓菌(Trametes versicolor)[30]等。对乳酸菌的研究多数认为乳酸菌降解AFB1是通过生物吸附作用,Eshelli等[31]研究了放线菌对AFB1降解推断其降解途径可能和脂肪酸及糖酵解中间产物的累积有关,而对真菌的研究表明其对AFB1的降解多数为生物降解,主要通过微生物分泌蛋白酶的酶促反应;如左振宇[32]、丁炜[33]、Guan Shu[34]、杨文华[35]等分别从真菌假蜜环菌(Armillariella tabescens)、黏细菌(Myxococcus fulvus)、施氏假单胞菌(Pseudomonas stutzeri)F4中得到了能降解AFs的蛋白酶,前两者还尝试了其在大肠杆菌和毕赤酵母中进行表达,并进行一些酶学基本性质的分析。总的来说,目前已经发现能使AFs含量降低包括细菌、真菌和酵母菌在内的大约有上千种微生物,但是多数的研究主要侧重在AFs降解菌株的筛选和粗提液降解能力的分析上,对于不同微生物来源的蛋白酶的性质、结构和底物作用模式、降解机理、产物结构及降解产物毒性的认识仍缺乏深入的研究与探讨。这可能与微生物产酶量低,分离纯化困难,酶性质不稳定及作用条件苛刻等原因有关。但随着生物化学、分子生物学、基因工程及酶工程等技术的发展成熟,人们对酶的认识越来越清晰,重组载体构建、异源表达、电子自旋共振、同源模建、分子模拟、晶体结构解析等手段的建立使上述研究过程中的瓶颈可能得以突破,有更多的手段和方法解析问题背后的本质。
