中国经导管左心耳封堵术临床路径专家共识
2020-01-07中国医师协会心血管内科医师分会结构性心脏病专业委员会
中国医师协会心血管内科医师分会结构性心脏病专业委员会
心房颤动(atrial fibrillation,AF)是临床最常见的心律失常之一,AF可致左心耳(left atrial appendage,LAA)内血栓形成,而血栓脱落可致血栓栓塞性疾病。Framingham研究[1]表明,AF与卒中事件有显著相关性。长期口服抗凝药物是预防栓塞的主要方法,但因其存在一定的出血风险,受药物、食物等因素影响较多,患者长期服药依从性较差,临床应用受限。外科切除LAA可以降低卒中风险[2]。Madden手术切除了2例患者的LAA,以预防卒中复发,引起了临床医师对干预LAA的关注[3]。1969年,Aberg[4]在对642例死亡患者的回顾性分析中发现,约90%的血栓起源于LAA。这一观点也在1996年得到了Blackshear等[5]研究的证实。这些研究明确了LAA对AF患者罹患卒中的意义。
随着众多大型权威LAA封堵相关临床试验结果的问世,《心房颤动:目前的认识和建议2015》[6]已将LAA封堵术(left artial appendage closure,LAAC)作为AF患者适应证(推荐等级Ⅱa)。《2016年欧洲心脏病学会(European Society of Cardiology,ESC) AF管理指南》[7]明确指出LAAC尤其适用于有高危卒中风险且有长期抗凝禁忌证的非瓣膜性AF患者(推荐等级Ⅱb)。基于PROTECT AF[8-11]及PREVAIL试验[12]的长期随访结果及相关荟萃分析,2019 美国心脏协会(American Heart Association,AHA)/美国心脏病学会(American College of Cardiology,ACC)/美国心律学会(Heart Rhythm Society,HRS)更新版AF患者管理指南[13]已正式将经导管LAAC作为有长期抗凝禁忌、卒中风险较高的AF患者的干预手段(推荐等级Ⅱb类)。为提高我国LAAC实战能力,介绍针对不同封堵器的治疗经验,并推进LAAC规范、安全、健康地开展,遂从以下几个方面介绍LAAC,以指导临床医师进行术前评估、术中操作及术后康复随访的整个流程(图1)。
1 LAAC的发展史
Pilot研究[14]评估了LAAC对于卒中预防的可行性,初步表明LAA置入装置是安全的。为比较LAAC与华法林抗凝治疗的有效性及安全性设计了PROTECT AF研究[8]。
2009年,PROTECT AF研究[8]公布结果。该研究是涉及59家欧美中心的大型随机对照研究,随机入组707例华法林耐受患者,4年随访结果表明:WATCHMAN主要有效性终点皆优于华法林,尤其能减少心血管全因死亡率、出血性卒中事件及致残性卒中事件发生率,但其围术期并发症发生率为8.7%。为证明LAAC的安全性,设计了CAP研究[9]。2011年,CAP研究进一步证明了LAAC的安全性,其使围术期并发症发生率下降至4.1%。
2013年发布的ASAP研究[15]入选了华法林禁忌证患者,旨在证明不使用短期华法林抗凝而进行LAAC的安全性及有效性。该研究结果表明,在华法林禁忌证非瓣膜性AF患者中置入WATCHMAN LAA封堵器可使卒中风险降低77%。进一步前瞻性随机对照研究ASAP TOO正在进行中。
2015年,PREVAIL研究[12](一项随机对照研究)涉及41家美国中心,入选461例患者,其中有18家中心没有置入封堵器经验,新术者比例为50%,置入封堵器成功率为95%,围术期并发症为4.2%。随访5年结果显示,致残或致命性卒中发生率降低55%,出血性卒中发生率降低80%;与长期华法林治疗相比,非手术相关大出血降低52%,全因死亡率降低27%。
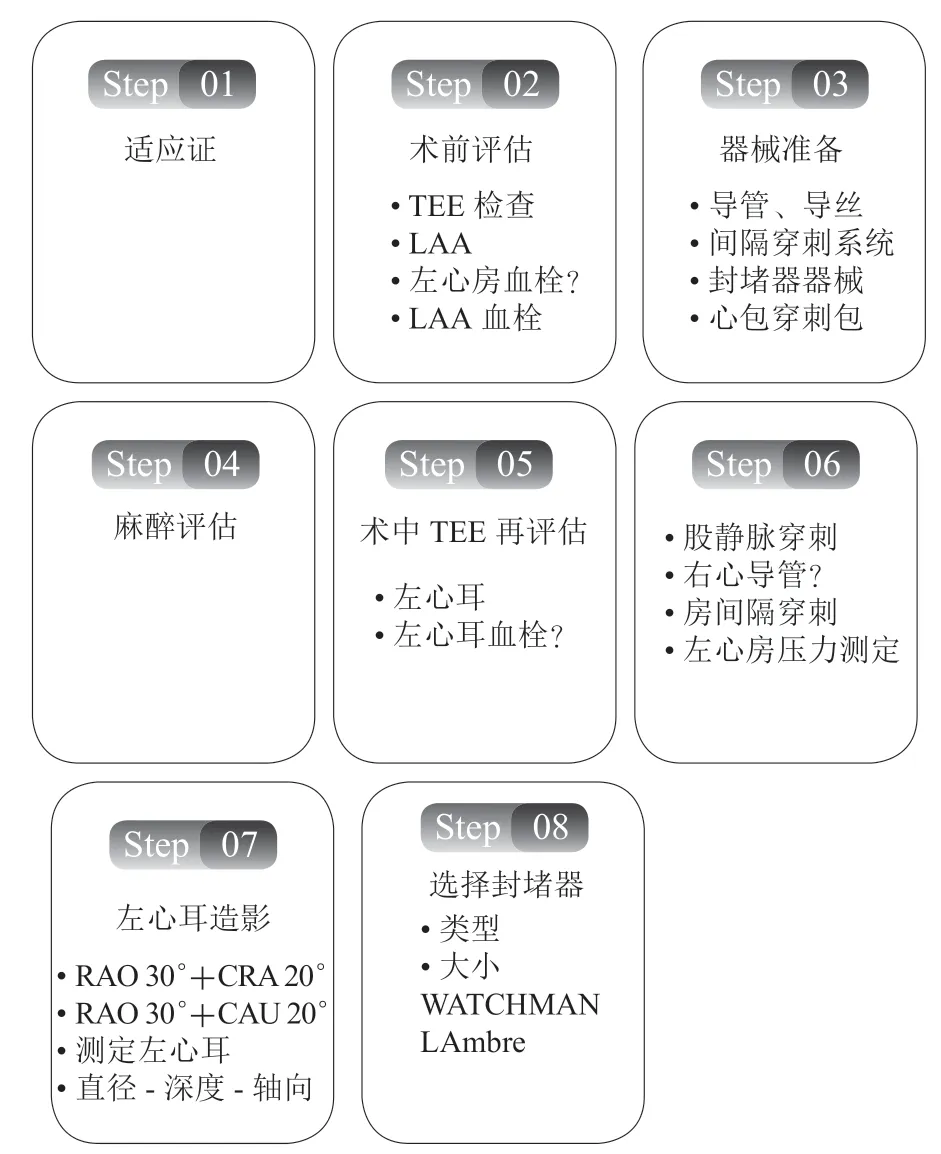
图 1 左心耳封堵术常规路径图
2013年,EWOLUTION研究[16-17]入选1020例患者,涉及包括俄罗斯及中东国家47家中心,结果显示置入装置成功率为98.5%,围术期不良事件发生率仅2.8%,其中绝大多数患者(60%)术后接受双联抗血小板治疗。该研究基于EWOLUTION注册研究观察可靠临床结果,更新了WATCHAMAN用药策略:(1)对于能够接受短期抗凝治疗的患者,可进行45 d抗凝治疗,3个月双联抗血小板治疗,1年阿司匹林治疗;(2)对于能够接受短期抗凝治疗的患者,亦可选择直接3个月抗凝治疗,1年阿司匹林治疗后可停药;(3)对于抗凝禁忌患者,可进行3个月双联抗血小板治疗,1年阿司匹林治疗。
2 LAAC团队的建立
LAAC团队应包括具备独立介入能力的心内科医师、具备独立心脏外科手术能力的心血管外科医师、神经科医师、超声科及影像学医师、麻醉科医师、康复医师及围术期护理团队。该团队需要具备随时对心包积液或心脏压塞等各项围术期心血管并发症进行干预处理,对脑血管不良事件及器械相关并发症的处置能力。团队需要完成:(1)充分了解患者的全部临床特征及LAA大小、形态和位置的解剖学特点,进行适应证、禁忌证评估,并综合患者意愿及家庭经济条件等社会因素,考虑是否可行LAAC;(2)决定治疗方案并评估患者手术策略的可行性,完善术中及围术期急、慢性并发症的紧急应对方案;(3)实施LAAC并保障围术期管理质量;(4)LAAC术后长期随访和康复指导,对抗凝方案进行个体化调整并定期完善经食管超声心动图(transesophageal echocardiography,TEE) 检查[18]。
3 LAAC围术期的影像学评估手段
目前常用的LAAC影像学评估手段包括经胸超声心动图(transthoracic echocardiography,TTE)、TEE、多层螺旋CT(multi-detector CT,MDCT)、心腔内超声(intracardiac echocardiography,ICE)、数字减影血管造影(digital subtraction angiography,DSA)[19]。
3.1 TTE
二维及三维TTE在术前可提供左心房、左心室大小及功能参数,排除瓣膜相关AF、左心室血栓、合并需要手术干预或长期抗凝治疗的瓣膜病史;TTE大动脉短轴、四腔切面图像在术中可用于指导房间隔穿刺的定位,评估术中、术后有无急性或亚急性心包积液等并发症的发生。
3.2 TEE
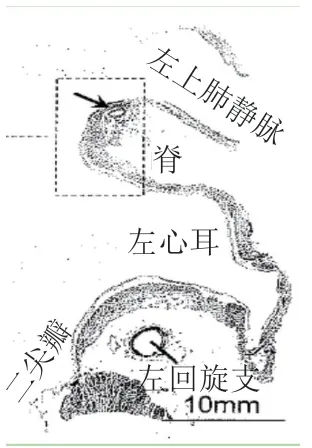
(1)术前评估:应在术前24 h内完成,多角度(0°、45°、90°、135°)探查LAA形态、结构,精确定量测量LAA的深度、开口(表1),排除LAA内血栓形成。(2)术中、术后检查:术中TEE引导房间隔穿刺;监测封堵器释放过程;观测封堵位置(position),检查封堵器的锚定(anchor)、封堵器稳定性,测量封堵器的大小及压缩比,检查封堵器周围是否存在残余分流,测定残余分流的直径,检查封堵器对周围结构(如二尖瓣)的影响、是否存在心包积液、心脏压塞等并发症。(3)术后复查:术后45 d、6个月、12个月随访复查TEE,观察封堵器械是否稳定、有无器械相关血栓、封堵器边缘残余分流及左心功能变化。TTE和TEE对LAAC有效性和安全性的保障具有非常重要的作用。
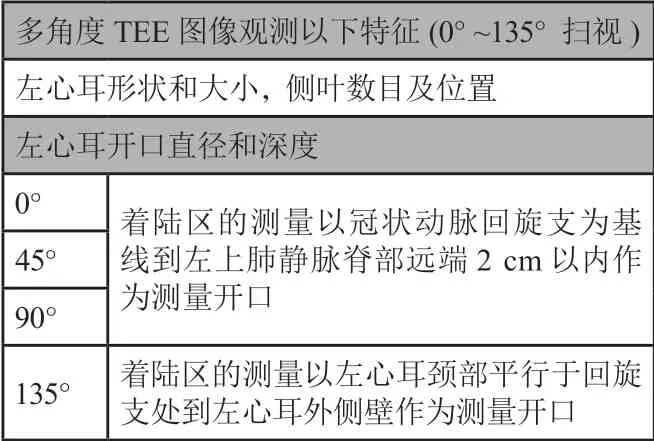
表1 经食管超声心动图测量左心耳方法
3.3 MDCT
(1)术前评估:三维重建后的MDCT图像可清晰显示不同心动周期LAA及周围结构的解剖形态、结构。术前MDCT可对房间隔穿刺位点、封堵器释放最佳轴向进行预测。该影像学检查下,LAA开口周长可作为预测实际选择封堵器种类和型号的参考指标。MDCT是需要对比剂的无创式检测,但部分AF患者发生LAA功能不全后,对比剂无法在舒张期完全充盈至LAA远端,进而可能引起LAA参数测量误差;同时MDCT对血栓的检测特异性稍劣于TEE,对区别LAA内肥大梳状肌与血栓的能力较差。目前,MDCT尚无法在手术中实时监测。对于不能耐受TEE的患者,可考虑该检查方法。(2)术后随访:对于不能耐受TEE的患者,可用MDCT进行术后随访,但是MDCT对于内皮化程度的识别仍无法代替TEE。
3.4 ICE
ICE可以在右心房、冠状窦口、心大静脉远端、右心室流出道评估LAA结构,排除LAA内血栓。在术中通过房间隔进入左心房,可在局部麻醉下全程指导LAAC。由于ICE对细微结构的高分辨率,其对血栓、LAA内梳状肌的鉴别更优于TEE。ICE在术中指引并监测LAA封堵器输送、释放的作用与TEE相似,低辐射下可在术中评估器械位置是否合适(与左上肺静脉、二尖瓣等周围组织结构的关系)、封堵器压缩比、残余漏大小以及有无心包积液等并发症。在左心房的常规位置左侧肺静脉、右侧肺静脉口外进行至少两个垂直轴向的扫描。ICE可以作为TEE无法耐受患者的术中替代监测和评估技术。但由于其价格比较昂贵,且操作比较繁琐,目前仅有少数中心在应用。
3.5 DSA
目前仍建议在全身麻醉下由TEE实时监测结合X线透视引导下进行标准的经导管LAAC。由于常用的TEE切面方位为30°~45°及120°~135°(显示LAA及封堵器的最佳切面),其右前斜(right anterior oblique,RAO)30°+头(cranial,CRA)20°及RAO 30°+足(caudal,CAU)20°,LAA造影也常用于观察封堵器边缘是否存在残余漏及有无露肩。目前国内多家中心在术前TEE明确左心房内无血栓的前提下,已成功尝试仅X线透视指导下完成经导管LAAC。然而,该术式尚无大规模的临床随机对照研究。
4 LAAC适应证及禁忌证
LAAC适用于CHA2DS2-VASc评分≥2分的非瓣膜性AF患者,同时具有以下情况之一:(1)不适合长期规范抗凝治疗;(2)长期规范抗凝治疗的基础上仍发生卒中或栓塞;(3)HAS-BLED评分≥3分;(4)需要合并应用抗血小板药物治疗;(5)不愿意长期抗凝治疗。
禁忌证:(1)左心房内径>65 mm;(2)TEE发现LAA内血栓或重度自发显影;(3)严重的二尖瓣瓣膜疾病或中大量心包积液;(4)低危卒中风险(CHA2DS2-VASc评分≤1分);(5)凝血功能障碍;(6)近期活动性出血患者;(7)除AF外同时合并其他需要继续华法林抗凝的疾病的患者;(8)需要接受外科开胸手术者。
5 规范化LAAC流程
5.1 塞式封堵
以WATCHMAN封堵器为例,介绍规范化的LAAC流程(图2)。
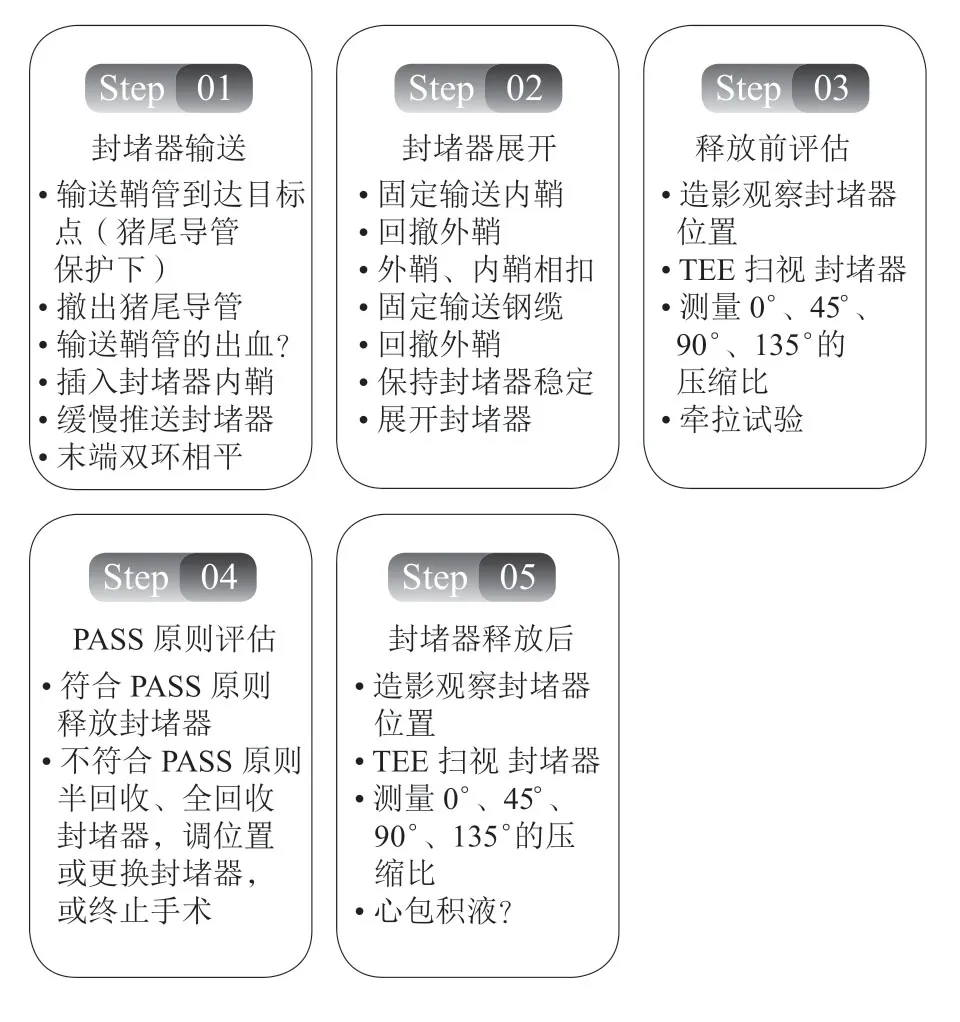
图 2 以WATCHMAN封堵器为例的左心耳封堵术规范流程
5.1.1 手术器械 穿刺针、动脉鞘管(6 F、8 F),房间隔穿刺鞘管、房间隔穿刺针,0.035 in(1 in=2.45 cm)“J”型加硬导丝,5 F或6 F猪尾造影导管,密封生理盐水袋-滴注器/无菌线(用来排气、导流等),三联三通导管,环柄注射器,心电监护装置,压力记录器,压力延长管,50 ml螺口注射器(封堵器冲洗排气),心包穿刺包,WATCHMAN输送系统(单弯、双弯、前弯,图3A),WATCHMAN封堵器(型号有21 mm、24 mm、27 mm、30 mm、33 mm 5种封堵器,适合绝大多数的LAAC治疗,图3 B)。
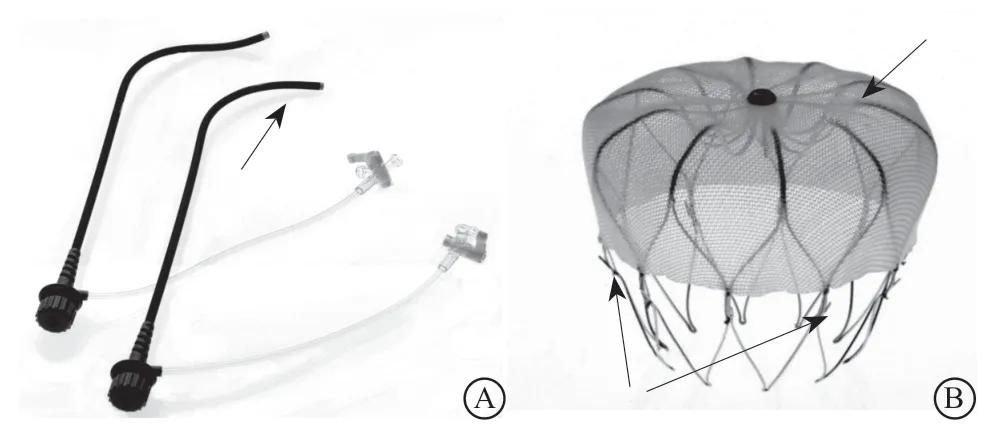
图 3 WATCHMAN左心耳封堵器械 A.WATCHMAN输送系统的外导引鞘管为14 F(4.7 mm),内径12 F,依据其前端形态分为单弯、双弯、前弯,大多数患者可使用双弯完成,其工作长度为75 cm;B.WATCHMAN封堵器,依据其底部直径有21 mm、24 mm、27 mm、30 mm、33 mm五种型号,其轮廓形状适合大多数的左心耳封堵术治疗
5.1.2 术前LAA评估 查看患者心包的基线情况,以备和术后对照。LAAC术前,除无法实施TEE的患者外都应该接受TEE检查,了解LAA的大小、形态、内部是否有血栓形成。至少应从0°、45°、90°、135°4个角度来评估LAA开口直径、深度、形态(图4)。根据LAA的大小预估合适的封堵器。合适的封堵器应是LAAC后封堵器稳定,不会产生封堵器移位,封堵器周围的残余分流小于5 mm或无残余分流。通常封堵器应大于LAA直径2~6 mm,LAAC后压缩比应在8%~20%(表2)。
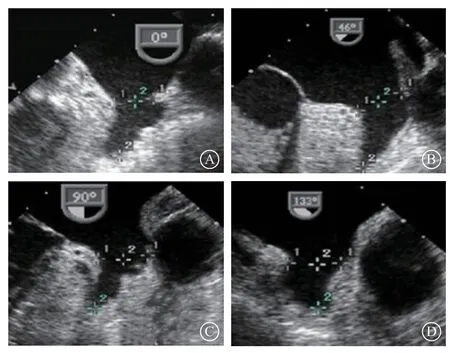
图 4 应用塞式封堵器经食管超声心动图测量的方法 A.0°,B.45°,C.90°,均以左回旋支为基线到左上肺静脉脊部远端2 cm以内作为测量开口(标记为1的测量线),深度为着陆区中点至左心耳的远端(标记为2的测量线);D.135°以左心耳颈部平行于回旋支处到左心耳外侧壁作为测量开口(标记为1的测量线),深度为着陆区中点至左心耳的远端(标记为2的测量线)

表2 封堵器型号推荐尺寸
5.1.3 手术过程 患者入院后建议确保抗凝桥接,如果术前已接受规范化抗凝(包括新型口服抗凝药、低分子肝素等),建议规范抗凝至术前1天,手术当日早上停服[20]。若有抗凝禁忌等原因,可考虑入院后采用双联抗血小板治疗(若无禁忌则建议阿司匹林、氯吡格雷,若不能服用阿司匹林者,可改为吲哚布芬或西洛他唑)至术前1天,手术当日早上停服。LAAC在全身麻醉或深度镇静下进行。
5.1.3.1 房间隔穿刺 房间隔穿刺点的选择对于LAAC至关重要。合适的穿刺点使得输送鞘管在房间隔到LAA之间有足够的操作空间,能够轻松地调整输送鞘管封堵轴向。穿刺位点通常选择房间隔靠中下或中后部。穿刺鞘管、输送鞘管在左心房、LAA的移动及调整应在猪尾导管或“J”型导丝的保护下进行(图5)。
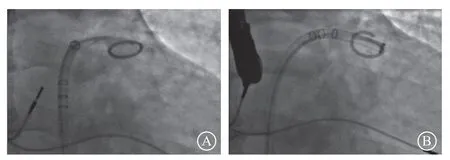
图 5 在经食管超声心动图和造影指引下缓慢推进输送导管 A.稳定猪尾导管;B.转动输送鞘顺着猪尾导管缓慢推送鞘管,到达左心耳末端前可静推对比剂明确鞘管位置
5.1.3.2 导引鞘管定位 WATCHMAN输送系统的导引鞘管外径为14 F、内径12 F,依据其前端形态分为单弯、双弯、前弯,大多数患者可使用双弯完成;导引鞘管的工作长度为75 cm,鞘管远端依次有4个标记环,距离顶端标记环长度依次为21 mm、27 mm、33 mm,顶端标记环外侧的鞘管有5 mm柔软的部位(图6)。标记环可作为标尺,用来测量LAA的大小,也可以指引外导引鞘管放置的深度。

图 6 WATCHMAN输送系统的外导引鞘管外径
5.1.3.3 术中LAA的观察及测量 在LAAC前必须对LAA的形态、开口直径、LAA深度等有全面了解,通常采用造影、TEE或ICE进行检测。造影一般取RAO 30°+CAU 20°进行检测;少数患者LAA位置变异,必要时可加RAO 30°+ CRA 20°、RAO 45°+CAU 20°、RAO 15°+CAU 20°或RAO 60°+CAU 20°。LAA显示清楚后,对X线和手术台进行锁定。
TEE检查时,应从0°~135°对LAA进行扫视、测量,同时观察是否有血栓形成;在TEE和X线透视引导下,将输送鞘管送至LAA内。逆时针旋转鞘时,外导引鞘管的弯头会向上、向前移动;顺时针旋转鞘时,外导引弯头会向后、向下移动。

图 7 WATCHMAN封堵器预装时封堵器与内鞘管的远端标记环对齐(箭头所示)
5.1.3.4 封堵器的装载 WATCHMAN封堵器预装在一透明的输送内鞘管内,在LAAC前,应对封堵器排气,检查输送钢缆与输送器是否连接紧密。在体外检查、排气时,不能将封堵器推送到输送管外,将封堵器与内鞘管的远端标记环对齐(图7)。标记环外有5 mm安全空间,即封堵器在LAA内展开后,封堵器的远端与LAA壁有一定的安全空间。将检查好、排气后、预装好封堵器的输送系统的内鞘管缓慢送入输送系统的外鞘管内,在推送过程中,应持续推注肝素生理盐水,防止气体进入输送系统内;将封堵器内鞘管远端标记环与系统外鞘管的远端标记环对齐,固定内鞘管,回撤外鞘管与内鞘管咬合,然后完全固定输送系统,使整个输送系统不能往前推进;固定封堵器的输送钢缆,缓慢回撤输送系统的鞘管,使封堵器在LAA内由远端至近端缓慢逐渐展开,至完全打开封堵器(图8)。在展开封堵器过程中,要确保封堵器远端未发生前移,禁止向前推送封堵器(图9)。

图 8 WATCHMAN封堵器预装过程
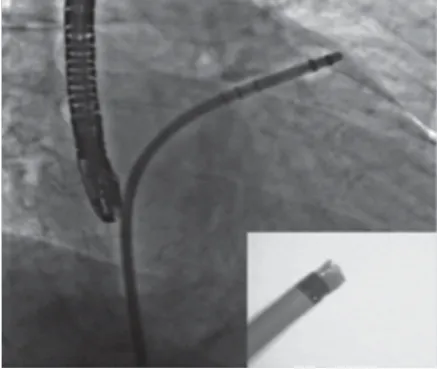
图 9 封堵器展开时确保封堵器远端无前移
5.1.3.5 封堵器释放 封堵器释放前必须满足所有释放条件,即“PASS”原则。 Position(位置):封堵器最大直径平面刚好在或稍远于LAA开口平面(图10);Anchor(锚定):倒刺组织,使器械位置稳定;Size(大小):封堵器相对于原直径压缩8%~20%(表3);Seal(封堵):器械覆盖开口平面,LAA所有分叶都被封堵。PASS原则的核心是:封堵器稳定,不会发生移位,完全封堵LAA,没有残余分流或残余分流小于5 mm。如果器械释放满足以上4个条件,将封堵器输送外鞘轻轻前送至封堵器底部,逆时针旋转近端手柄3~5圈,释放封堵器。如果达不到释放条件,应分析原因,调整封堵器的位置或封堵器的型号。(1)封堵器的位置:过深(图11 A),靠近LAA开口部位的分叶未能完全封堵,此时仍然存在血栓形成的风险;过浅(图11 B),封堵器突出在左心房内,封堵器的压缩比过低,导致封堵器不稳定而易移位。(2)封堵器是否锚定:封堵器稳定性测试,轻轻牵拉释放把手,然后松开,观察封堵器位置是否移位、改变,如果封堵器回复到原来位置,提示封堵器位置稳定,反之,提示封堵器锚定不牢固,封堵器可能移位,器械需要被回收。(3)封堵器的压缩比:用TEE从不同角度测量封堵器底部直径,计算其压缩比(图12),确定封堵器保持一定的压缩(压缩比应为8%~20%),即封堵器对LAA有一定的径向张力。(4)封堵器是否封堵完全:观察封堵器周围有无残余分流,如果有残余分流,应对其进行分析,确保残余分流小于5 mm;如果残余分流大于5 mm,应通过封堵器位置调整或更换封堵器来确保残余分流小于5 mm(图13)。在调整LAAC过程中不能够推送封堵器,避免无意地拉扯封堵器,预防心耳破裂、心脏压塞。调整后仍然达不到释放条件时,应放弃封堵。可以通过部分、全部回收封堵器来重置封堵器。
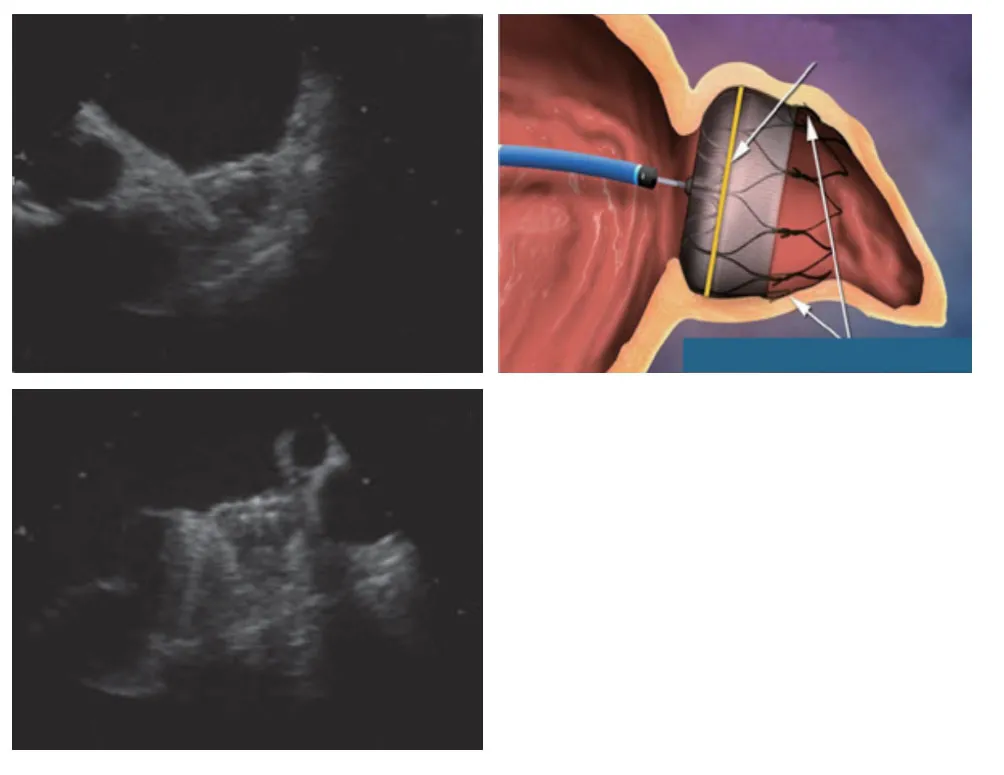
图 10 封堵器释放前,最大直径平面刚好在或稍远于左心耳开口平面

表3 封堵器释放条件:封堵器相对于原直径压缩8%~20%
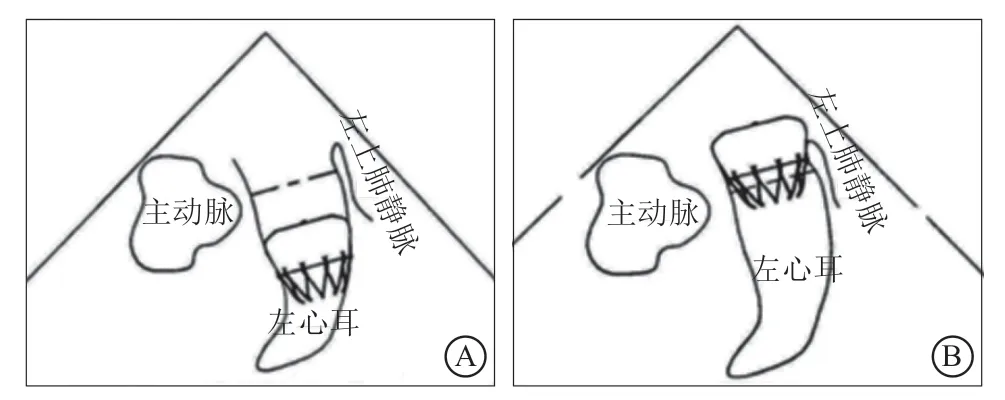
图 11 封堵器释放的不良位置 A.封堵器放置位置过深;B.封堵器放置位置过浅
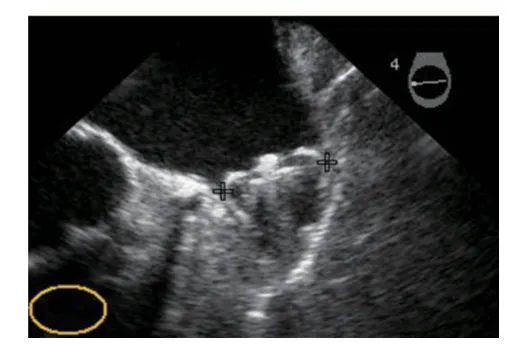
图 12 经食管超声心动图测量WATCHMAN左心耳封堵器的压缩比
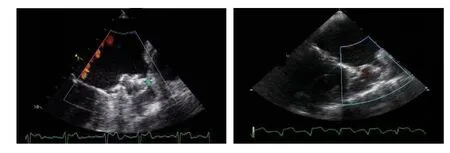
图 13 经食管超声心动图发现左心耳封堵器周围残余分流及封堵器评估
5.2 盖式封堵
以LAmbre封堵器为例,介绍规范化LAAC流程(图14)。
5.2.1 手术器械 6 F动脉鞘,穿刺针、动脉鞘管(6 F、8 F),房间隔穿刺鞘管、房间隔穿刺针,0.035 in “J”型加硬导丝,5 F或6 F猪尾导管,密封生理盐水袋-滴注器/无菌线(用来排气、导流等),三联三通导管,环柄注射器,心电监护装置,压力记录器,压力延长管,50 ml螺口注射器(封堵器冲洗排气),心包穿刺包,LAmbre封堵器,LAmbre输送系统,肝素化盐水托盘,10号缝合线,14 F可调弯鞘,异物钳,带食管探头超声设备,DSA设备。

图 14 以LAmbre封堵器介绍左心耳封堵器规范流程
5.2.2 术前LAA评估 查看患者心包的基线情况,以备和术后对照。通过TEE或者CT扫描来排除LAA内有血栓的情况;TEE测量LAA大小:从0°、45°、90°、135°测量LAA开口大小、锚定区大小(心耳开口往深1 cm处),检查观察LAA与左心房、房间隔位置关系(图15),预估LAA形态、封堵位置、封堵器尺寸。
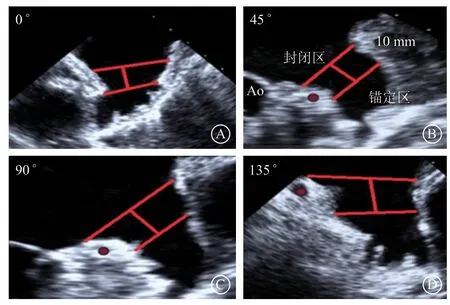
图 15 应用盖式封堵器经食管超声心动图测量的方法 A.0°,B.45°,C.90°以华法林嵴顶端至房室沟的连线为封闭区,封闭线往左心耳深处平移10~14 mm所测量为锚定区,锚定区的位置要求必须在左回旋支外侧;D.135°以华法林嵴顶端至左心耳口部外侧3~4 mm处为封闭线,往左心耳深处平移10~14 mm所测量径线为锚定区
5.2.3 手术过程 患者入院后建议确保抗凝桥接,如果术前已接受规范化抗凝(包括新型口服抗凝药、低分子肝素等),建议规范抗凝至术前1 d,手术当日早上停服。若有抗凝禁忌等原因,可考虑入院后采用双联抗血小板治疗(若无禁忌则建议阿司匹林、氯吡格雷,若不能服用阿司匹林者,可改为吲哚布芬或西洛他唑)至术前1 d,手术当日早上停服[20]。LAAC在全身麻醉或深度镇静下进行。
5.2.3.1 术中LAA测量及封堵器的选择 (1)房间隔穿刺成功后,在加硬导丝的导引下,将输送鞘管送入左心房,将猪尾导管沿导丝经输送鞘送至左心房内,旋转前送猪尾导管,进入LAA。猪尾导管放入LAA深处,输送鞘沿猪尾导管到达LAA口部位置。(2)分别选择RAO 30°+CRA 20°、RAO 30°+CAU 20°角度,同时向鞘管和猪尾导管注射对比剂进行LAA造影(图16),并测量LAA口部及锚定区最大径。(3)根据测量结果选择封堵器大小,采用造影下最大测量直径。一般情况下,选择比锚定区大2~6 mm的封堵器;若开口部直径比锚定区大10 mm及以上,则考虑选择异型封堵器(固定盘小,封堵盘大)。
指导老师需从事学生工作,拥有直接组织或参与学生寝室文化建设的经验。项目组成员在校参加各社团,有较强的人脉资源与社交能力。寝室文化一直是高校较为重视的一个方面,但在校学生没有充足的时间和精力以及太多创意来装扮寝室,而本工作室则可帮它们完成从设计到布置的整个实施过程。
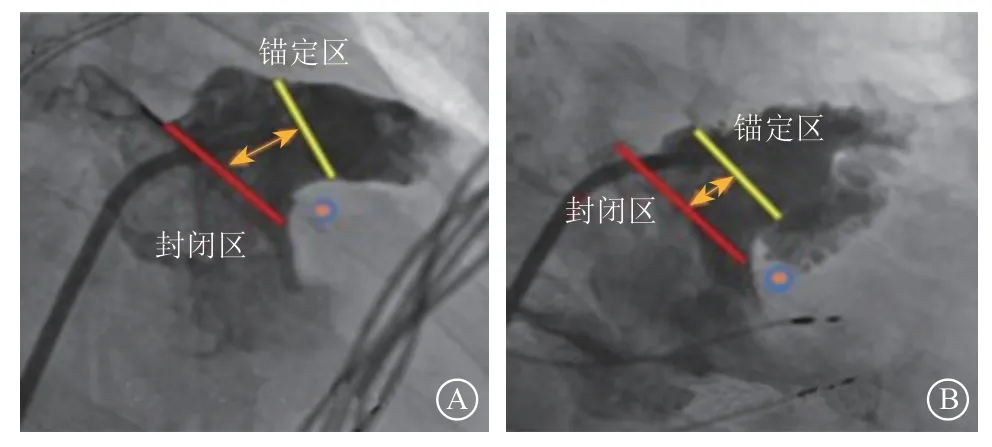
图 16 左心耳封堵术中造影测量左心耳大小,以华法林嵴顶端至左心耳解剖开口和二尖瓣环连线的中点为封闭区,往左心耳深处平移10~14 mm为锚定区,锚定区必须位于心耳侧 A.右前斜30°+头20°;B.右前斜30°+足20°
5.2.3.2 封堵器的装载 将封堵器连接至输送钢缆并收入装载器中,使用50 ml注射器冲洗2~3次并充分排气,然后通过三联三通连接高压盐水袋并保持高压盐水冲洗;然后连接输送鞘,连接过程中应确保无气泡进入输送鞘内、体内;推动输送钢缆,将封堵器送至鞘管末端(图17)。LAAC中推送钢缆,在开口部参考线远端、锚定区的近端打开固定盘,缓慢推送固定盘至锚定远端、左回旋支的外侧;回撤输送鞘同时推送输送钢缆,打开密封盘,初步完成LAA的封堵。
图 17 LAmbre封堵器的装载
5.2.3.3 封堵器的释放 在封堵器释放之前必须对封堵器的稳定性、封堵效果、对周围组织(二尖瓣功能、左上肺静脉、心包)的影响进行评估。一般通过X线、造影、超声心动图进行综合评估,可在X线下进行牵拉试验;造影评估残余分流情况;TEE检测器械周围漏(peri-device leakage,PDL),封堵器对二尖瓣、左上肺静脉影响,是否有心包积液。封堵器在释放前应符合COST原则(图18)。C(Circumfl ex artery):固定盘展开在左回旋支外侧;O(Open):固定盘充分展开,使盘脚的末端与连接在密封盘和固定盘之间的显影标志在一条线上;S(Sealing):密封盘达到最佳密封(残余漏≤3 mm);T(Tug test):固定盘稳固,通过牵拉测试确认。通过验证,确认封堵器稳定、封堵效果好、对周围组织无影响后,将输送鞘管送至密闭盘下方,逆时针旋转输送钢缆,释放封堵器。
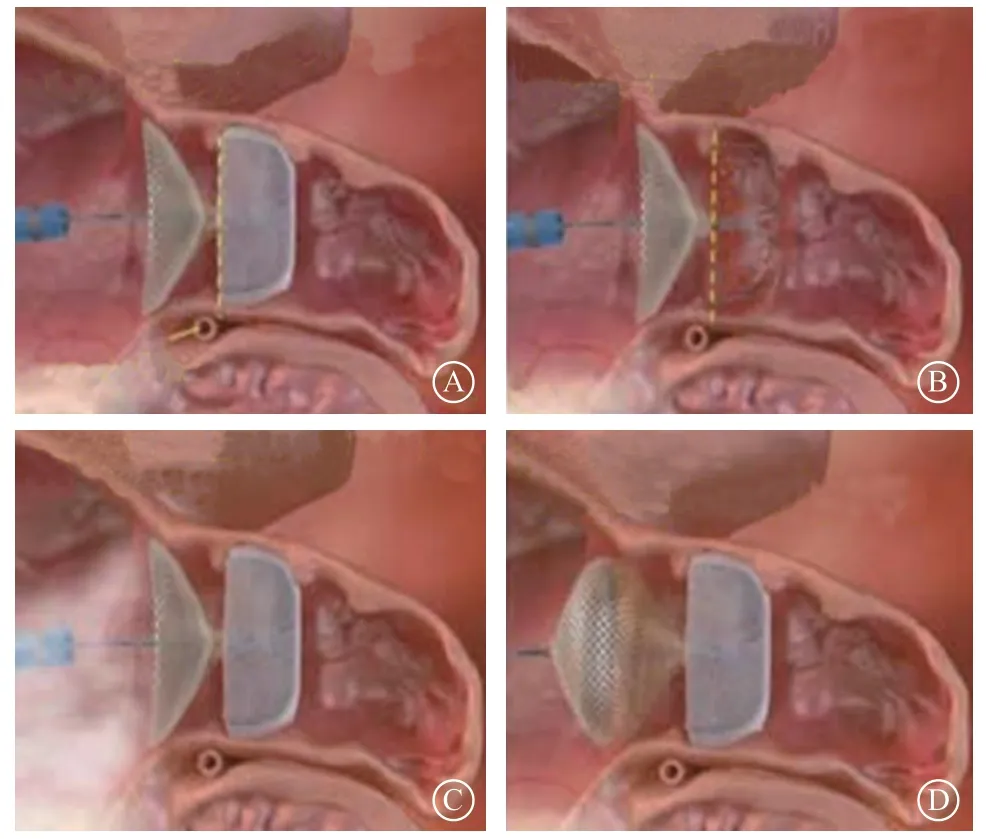
图 18 LAmbre封堵器释放的COST原则 A.固定盘在左回旋支(Circumflex artery)后面展开;B.固定盘充分展开(Open),固定盘脚的末端与连接在密封盘和固定盘之间的显影标志在一条线上;C.密封盘达到最佳的密封(Sealing,残余漏≤3 mm);D.封堵器稳固,通过牵拉测试(Tug test)确认
6 LAAC围术期管理
6.1 术后综合评估
对LAAC患者应行围术期管理、术后并发症管理、术后中长期随访及采取远期康复措施。在术后应根据麻醉方式及入路情况酌情于重症加强护理病房中转,条件允许者进入普通病房进行循环容量、神经系统、感染、呼吸系统、消化系统等综合管理,并给予相应治疗。完成患者综合评估,包括运动功能评估、关节活动度评估、肌张力评估、感知功能评估、言语及吞咽评估、日常生活能力评估、认知评估,个体化制定院内早期运动康复计划及出院时间规划。结果良好平稳的患者可于术后1~2 d出院,出院前应进行心电图和TTE检查。术后6~12周、6个月及1年完成门诊随访,包括相应的生化及影像学检查。及时纠治并发症,合理用药,依据病情和门诊康复治疗情况制定长期家庭康复计划。
6.2 抗栓方案
LAAC术前,须行TEE检查排除左心房及LAA血栓。对于长期口服华法林的患者,术前应调整华法林剂量,使国际标准化比值(international normalized ratio,INR)<2.0。
目前推荐LAAC术中抗凝使用普通肝素,维持术中(房间隔穿刺后至整个置入过程结束)活化凝血时间(activated coagulation time,ACT)大于250 s。存在普通肝素使用禁忌时,可选择使用比伐芦定[21]。
LAAC术后最佳抗栓方案尚不明确,建议根据患者意愿、评估出血风险及卒中风险选择抗凝方案。建议术后予华法林抗凝,同时给予低分子肝素协同抗凝,直至INR达2.0。服用华法林至少45 d,维持INR值2~3。术后45 d经TEE评估封堵成功(完全封堵或残余分流<5 mm) 时,停用华法林,改用双联抗血小板治疗(阿司匹林+氯吡格雷)至6个月后停用氯吡格雷,长期服用阿司匹林治疗;如果术后45 d随访时,封堵不成功,则继续服用华法林[10]。
新型口服抗凝药在LAAC后血栓栓塞预防的疗效与华法林相仿,且可减少术后出血事件发生,使用前应综合考虑患者年龄、肾功能、既往出血史等[22-23]。
6.3 常见并发症及处理
LAAC相关主要手术并发症在实践中相对较少(1%~2%),但一旦发生会造成一定的伤残率和死亡率,所以LAAC术者必须对以下潜在的并发症有充分的了解,并对其做好相应的预防及处理措施。
6.3.1 心包积液及心脏压塞 心包积液是LAAC中常见的并发症,积液量大时可致心脏压塞,需心包穿刺减压,严重时需外科开胸止血。2009年PROTECT AF研究[8]表明,需要干涉的心包积液患者约占所研究患者的4.3%。CAP2研究[25]结果表明,心包积液及心脏压塞的概率分别约1.9%及1.3%。封堵器输送过程中,输送鞘必须沿着猪尾导管慢慢推进,过程需要非常谨慎小心。对于心包积液的早期识别很重要,心包穿刺设备需要提前准备好且做好外科开胸手术的准备。
6.3.2 封堵器移位 封堵器释放后可从LAA封堵处移位至左心房、左心室、主动脉,可能与封堵器选择不当、LAA过大有关。已有研究报道,器械脱落栓塞的概率约0.25%[25]。封堵器移位于左心室、主动脉、左心房的概率分别为43%、43%和14%。详细评估LAA大小和轴向有助于选择合适封堵器,降低封堵器移位的风险。封堵器移位后能否经导管取出,取决于移位的位置及术者的手术经验。移位至左心房、主动脉内的封堵器,大多可经导管取出;移位至左心室,并固定在左心室的封堵器,建议外科开胸取出。通过严格遵守封堵器的释放原则,如PASS原则、COST原则等,可最大限度降低封堵器移位的发生率。
6.3.3 手术相关卒中 大多数与空气栓塞有关,发病率通常低于0.5%,多可逆。在PROTECT AF研究[8]中,因空气栓塞导致的卒中事件约1%(463例中有5例)。LAAC过程中严格的冲管排气可以降低卒中的发生率;全身麻醉、插管正压通气也可以减少空气栓塞的发生;通过注射生理盐水维持平均左心房压大于10 mmHg(1 mmHg=0.133 kPa)是防止空气栓塞的另一种有效的方法;成功穿刺房间隔后,撤离穿刺针及扩张鞘时需动作缓慢且稳定。万一出现了空气栓塞,需要患者保持仰卧,给予100%的氧气吸入,可以给予高压氧治疗。
6.3.4 血栓形成 术中在器械表面、左心房内出现血栓,可能与肝素化不完全、操作时间长、缺乏肝素冲洗导管有关。一般认为,在将器械送入左心房之前,ACT必须达到250 s以上,且每20 min需要监测1次。TEE有助于早期识别血栓形成,若术中发现LAA或心腔内血栓形成,立即停止手术,随访ACT,必要时增加肝素。封堵器械相关血栓(device-related thrombus,DRT)通常无症状,随访时经TEE发现。在PROTECT AF 研究[9]中,对DRT发生率为4.2%,其中0.3%患者发生卒中。对DRT患者须加强抗凝药物的使用至少6周。
6.3.5 PDL 由于LAA形态不规则,部分患者可发生PDL。至于多大的PDL是可接受的,目前没有达成共识。在PROTECT AF[9]和PREVAIL研究[12]中,小于5 mm的PDL不影响封堵的效果。但也有些学者认为小于3 mm才是可接受的[26]。PDL处理办法包括继续抗凝治疗以及第2次封堵,封堵器可选择房间隔缺损封堵器、卵圆孔未闭封堵器等。
6.3.6 其他的并发症 (1)穿刺点出血、血肿、假性动脉瘤形成、感染以及深静脉血栓形成;(2)食管损伤;(3)气道损伤、呼吸机相关肺炎;(4)心包炎;(5)心律失常。
7 “一站式”介入治疗
AF治疗的核心是预防动脉栓塞疾病。射频消融可改善部分AF患者症状,但术后存在一定的复发率,部分患者仍需要长期口服抗凝药物预防卒中。具备射频消融适应证、CHA2DS2-VASc评分≥2分的AF患者,如果存在长期口服抗凝治疗禁忌证,或不愿接受口服抗凝治疗,或正规抗凝治疗期间仍有缺血性卒中发生,或抗凝治疗出血风险高(HAS-BLED评分≥3分),建议行“一站式”治疗。
“一站式”介入治疗是一次同时行射频消融和LAAC两个手术。射频消融可改善AF患者症状,LAAC可降低卒中和出血等不良事件的发生率。“一站式”手术可减少股静脉和房间隔穿刺次数,减少相应并发症,减少患者住院次数,节省医疗费用。
多项研究显示,“一站式”介入治疗是可行且安全的[27-30]。一项大规模国际多中心前瞻性研究显示,“一站式”手术LAA完全封堵率为98.9%,术后30 d并发症包括心包积液(1.5%)、轻微卒中(0.3%),无死亡事件发生。术后35个月随访患者卒中年发生率为0.9%[31]。
“一站式”介入治疗有先射频消融后LAAC和先LAAC后射频消融两种策略。先射频消融会造成左上肺静脉和LAA之间嵴部水肿,影响封堵器的贴靠,或致新发残余分流。先LAAC操作不当有LAA封堵器移位甚至脱落的风险,其中某些“盖子型”的封堵器可能会遮挡嵴部而影响嵴部的消融。目前尚无随机对照试验比较这两种策略的优劣。
8 极简式LAAC
目前国际上倡导在静脉麻醉下行经导管LAAC,国内部分中心在累积实战经验后已逐步开始进行局部麻醉下的经皮LAAC。建议各中心早期开展时,选择全身麻醉,经验累积后可根据LAA形态、大小、轴向等尝试局部麻醉/镇静麻醉。
9 LAAC护理
9.1 术前护理
术前根据医嘱完善三大常规、肝肾功能等生化检查、TEE、冠状动脉CT等相关检查。向患者介绍手术目的、方法及注意事项,减轻紧张心理,取得配合。术前按医嘱停用口服抗凝药改用皮下注射低分子肝素。术前8~10 h禁食禁水。手术当日做好皮肤准备,建立静脉通路。需静脉麻醉者按麻醉医师医嘱给予术前用药,并严密观察患者有无不良反应,遵医嘱导尿。导管室护士于术前应完善LAAC器械准备。
9.2 术中协作
手术前1天清点器械,完善器械准备。手术当日备好手术台,协助消毒、铺巾,贴好电极及除颤贴片,连接血流动力学及心电监测设备,准备相关手术器械。术中协助观察患者生命体征。
9.3 术后护理
全面了解患者手术情况,术中出现异常者,配合医师做好相应处理。密切监测生命体征、意识状况,有变化时及时记录。静脉麻醉患者遵医嘱禁食禁水2~4 h后开始予少量流质,无呛咳则给予半流质饮食,卧床期间少食甜食、牛奶、豆浆等胀气食物,少量多餐,不易过饱。观察患者伤口情况、术肢皮色、皮温及动脉搏动情况。按医嘱进行术肢制动,制动期间嘱趾端活动,预防血栓形成。落实导管护理,保证各导管妥善固定、通畅、有效。密切观察患者有无疼痛主诉,选择合理工具进行疼痛评分,采取有效措施缓解疼痛。加强病情观察,早期发现各类并发症,如:心脏压塞、心包积液、穿刺部位出血或血肿、封堵器移位、手术相关卒中、血栓形成、PDL、感染、食管损伤等。做好水化护理,术后鼓励患者适量饮水,促进对比剂排出,关注肾功能及肌酐的变化,预防对比剂肾病。遵医嘱抗凝治疗,防止围术期血栓。
9.4 康复运动
卧床制动期间,护士需鼓励和指导患者进行小范围的主动和被动运动,如:活动脚趾、足背屈伸运动等预防深静脉血栓,并鼓励患者咳嗽和进行呼吸训练;制动解除后,逐渐抬高床头直至坐位,并进行上、下肢肌力训练、抗阻力运动等,再逐步过渡至床边坐位训练、床边站位训练、病房内步行。护士应保障患者院内康复运动期间的安全。患者出院后的康复运动应在咨询心脏康复科医师后进行。
9.5 出院指导
护士应指导患者出院后的安全用药,并定期门诊随访。尤其要告知患者在出现胸闷气促症状加重、静息状态下心率/心律异常、血压低于或高于正常值、全身皮肤大片瘀斑、牙龈持续出血、大小便颜色加深、头痛、头晕、恶心呕吐、肢体偏瘫或感知觉障碍等情况应立即就诊。
10 结语
随着LAAC在世界范围内的不断实践,在优化患者选择、评估手段、器械研发、操作技巧以及并发症的防治方面将有更大突破。希望本临床路径可以在现阶段帮助中国的LAAC技术得以健康、规范开展,并建立一批合格优秀的医学中心以确保LAAC“量”与“质”齐增,同时累积中国自己的数据和经验,开拓中国特色的创新之路。
感谢 值此新年来临之际,由衷得感谢今年一年来多次参加中国左心耳封堵临床路径专家共识讨论的各位领导、各位专家。自2019年6月东方心血管病会议第一次讨论以来,多位专家多次通过邮件、短信等方式提出了宝贵意见,对临床路径进行了完善,为在中国规范有效地推广这项新技术做出了富有成效的推动作用。
特别感谢葛均波院士在建国70周年的大喜日子里主持并发布了临床路径专家共识的讨论稿终版,给全国有志于这项新技术的同道们极大的鼓舞和激励。
写作组成员:周达新(复旦大学附属中山医院),张晓春(复旦大学附属中山医院),付华(四川大学华西医院),储慧民(宁波市第一人民医院),樊友启(浙江大学附属第二医院),潘翠珍(复旦大学附属中山医院),曾杰(四川省人民医院),江立生(上海交通大学附属交通医院),黄鹤(武汉大学人民医院),宁忠平(上海市浦东新区周浦医院,白元(海军军医大学第一附属医院),陈发东(上海市东方医院),林颖(复旦大学附属中山医院),葛均波(复旦大学附属中山医院)
核心专家组成员:葛均波(复旦大学附属中山医院),霍勇(北京大学第一医院),黄从新(武汉大学人民医院),王建安(浙江大学医学院附属第二医院),于波(哈尔滨医科大学附属第二医院),周达新(复旦大学附属中山医院),吴永健(北京阜外医院),陈茂(四川大学华西医院),苏 (武汉亚洲心脏病医院),秦永文(海军军医大学第一附属医院),朱鲜阳(解放军北部战区总医院),宋治远(陆军军医大学第一附属医院),徐亚伟(同济大学附属第十人民医院),李毅刚(上海交通大学附属新华医院),何奔(上海交通大学附属胸科医院),张玉顺(西安交通大学第一附属医院),黄伟剑(温州医科大学附属第一医院),赵仙先(海军军医大学第一附属医院),伍伟峰(广西医科大学第一附属医院),孔祥清(南京医科大学第一附属医院),王广义(解放军总医院第一医学中心),张伟华(昆明市延安医院),曾智(四川大学华西医院)
专家组成员(按姓氏汉语拼音排序):陈关良(海南省人民医院),陈韬(解放军总医院第一医学中心),陈维(上海市第十人民医院),陈晓彬(中南大学湘雅医院),丁风华(上海交通大学附属瑞金医院),方军(福建医科大学附属协和医院),方咸宏(广东省人民医院),甘继宏(兰州军区乌鲁木齐总医院),高伟(上海儿童医学中心),顾虹(首都医科大学附属北京安贞医院),郭军(解放军总医院第一医学中心),洪浪(江西省人民医院),华益民(四川大学华西第二医院),黄连军(首都医科大学附属北京安贞医院),蒋晨阳(浙江大学附属邵逸夫医院),蒋世良(北京阜外医院),姜小飞(珠海市人民医院),金梅(首都医科大学附属北京安贞医院),金元哲(中国医科大学附属第四医院),李奋(上海儿童医学中心),李贵双(山东大学齐鲁医院),李世军(大连市中心医院),李新明(同济大学附属东方医院),李元十(哈尔滨医科大学附属第一医院),刘惠亮(解放军总医院第三医学中心),刘晓桥(贵州省人民医院),刘煜昊(河南省人民医院),马为(北京大学第一医院),满荣海(赤峰市医院),潘欣(上海交通大学附属胸科医院),蒲晓群(中南大学湘雅医院),钱明阳(广东省人民医院),覃军(陆军军医大学第二附属医院),屈百鸣(浙江省人民医院),阮中宝(泰州市人民医院),沈向前(中南大学湘雅二医院),盛国太(江西省人民医院),孙健(上海交通大学附属新华医院),孙勇(浙江大学医学院附属第二医院),陶四明(云南省第二人民医院),万继业(中国医科大学附属盛京医院),王诚(徐州医科大学附属医院),王广义(解放军总医院第一医学中心),王慧琛(中山大学附属第一医院),王琦光(解放军北部战区总医院),王群山(上海交通大学附属新华医院),王玮(广州医科大学附属第一医院),王玉林(山东省立医院),王震(滨州医学院附属医院),吴炳祥(哈尔滨医科大学附属第二医院),吴淳(北京大学深圳医院),伍广伟(广西壮族自治区人民医院),吴书林(广东省人民医院),肖方毅(温州医科大学附属第一医院),谢瑞芹(河北医科大学第二医院),徐岩(安徽医科大学附属第一医院),徐仲英(北京阜外医院),杨兵(同济大学附属东方医院),杨瑞丰(昆明医科大学第二附属医院),袁义强(郑州市第七人民医院),曾秋棠(华中科技大学附属协和医院),张刚成(武汉亚洲心脏病医院),张毅刚(徐州市中心医院),张勇华(武汉亚洲心脏病医院),张玉顺(西安交通大学第一附属医院),钟敬泉(山东省齐鲁医院),周陵(南京市第一人民医院),朱丽(复旦大学附属中山医院),朱政斌(上海交通大学附属瑞金医院)
