经导管主动脉瓣置换术治疗单纯性主动脉瓣关闭不全新进展
2020-01-07丁鹏徐臣年杨剑
丁鹏 徐臣年 杨剑
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)是一项用于治疗主动脉瓣疾病的新型介入技术。经过十几年的迅速发展,TAVR治疗中、重度主动脉瓣狭窄(aortic stenosis,AS)的可行性和安全性已经在全球范围内得到认可。《2017年美国心脏协会(American Heart Association,AHA)/美国心脏病学会(American College of Cardiology,ACC)心脏瓣膜疾病患者管理指南》[1]已经将其列为不能耐受外科手术的严重AS患者Ⅰa的推荐类治疗方式。同时,对于TAVR治疗外科手术低危患者的研究也在进行中[2]。
鉴于TAVR具有创伤小、术后恢复快等优势,临床医师一直在尝试将这项技术应用到单纯性主动脉瓣关闭不全(aortic regurgitation,AR)的治疗中。但由于TAVR本身存在各种并发症的风险以及单纯性AR患者本身的结构特点,其应用一直面临重重挑战[3]。主要原因包括:(1)TAVR主要是通过置入包含支架的人工瓣膜,将严重钙化的自体瓣叶压靠在主动脉壁上,以此获得径向支撑力,使置入的瓣膜得以牢固锚定。自体瓣膜钙化是完成TAVR的一个重要条件。与AS患者不同,单纯性AR患者往往自体瓣膜钙化程度较轻,甚至不伴有钙化,缺乏稳固的锚定区,限制了TAVR对于单纯性AR患者的应用[4]。(2)单纯性AR患者的主动脉瓣往往存在着更为复杂的病理改变,手术难度较大[5]。主动脉根部及升主动脉的病理性扩张是这类患者常有的解剖改变,一旦这种异常扩张使主动脉瓣环面积超过了目前临床上最大型号人工瓣膜的面积,就会使得TAVR无法进行[6]。(3)单纯性AR患者的病情常常较为复杂,心功能储备差,其预后较AS患者更差,进一步限制了TAVR的普及应用。
目前,单纯性AR患者仍主要靠外科手术治疗。但是,Iung等[7]一项研究显示,由于年龄及严重合并症等原因,大约有10%的AR患者无法接受手术,在左心室射血分数为30%~50%的单纯性AR患者中,只有1/5接受了手术治疗;当左心室射血分数低于30%时,接受手术的患者比例低至3%。而据统计,保守治疗的患者年死亡率高达10%~20%,其10年并发症发生率和死亡率也不容乐观[7-8]。因此,虽然面临种种困难,但是巨大的临床需求促使研究人员在这一方向上不断进行探索,近年来也取得了一定的突破和不少的收获。本文旨在回顾近年在TAVR治疗单纯性AR上所取得的进展,分析目前存在的问题与挑战,并简单展望其发展前景。
1 临床应用进展
TAVR的发展与人工瓣膜的改进和更新密不可分。下面通过总结近年几款应用于TAVR治疗单纯性AR的人工瓣膜的特点,简要介绍这一领域的研究新进展。
1.1 CoreValve瓣膜
美敦力公司的CoreValve人工支架瓣膜较早在临床上被应用于单纯性AR患者的TAVR治疗(图1 A)。这是一款自展瓣膜,首选经股动脉入径置入,股动脉条件不好时,可次选锁骨下动脉、颈动脉等。其优势在于超过50 mm的长支架以及特殊的三级固定机制,其下部通过较高的径向扩张力挤压原生瓣叶,中部被压缩以避免冠状动脉堵塞,上部则扩大以将支架框架固定在升主动脉中心,并提供纵向同轴稳定性[9]。因此,即使在没有钙化的情况下,该瓣膜也可以完成锚定。但是,这款瓣膜的使用也存在一些问题:(1)锚定不充分导致瓣膜移位,使得瓣膜二次置入及术后中重度瓣周漏的发生率较高。Roy等[10]对14家中心43例使用CoreValve瓣膜行TAVR的患者的研究结果显示,其瓣中瓣置入率及术后中重度瓣周漏的发生率分别为19%和21%。(2)由于CoreValve瓣膜主要依靠瓣膜径向扩张固定在瓣环上,在选择瓣膜型号时,通常需要使人工瓣膜直径稍大于原生瓣环,以获得足够的径向支撑力来使锚定更加稳固,这种做法同时也导致了瓣环撕裂的高风险[11-12]。
1.2 Edwards SAPIEN系列瓣膜
Edwards SAPIEN系列瓣膜是球囊扩张瓣膜的代表,共包括SAPIEN、SAPIEN XT和SAPIEN 3三代产品,是目前为数不多的可同时经股动脉和经心尖置入的人工瓣膜。SAPIEN与CoreValve类似,主要依赖瓣膜钙化完成锚定,同样存在着瓣膜二次置入、瓣周漏及瓣环撕裂的高风险[11-12]。同时由于其支架高度只有14.3~19.1 mm,人工瓣膜锚定的难度更大[4]。因此,虽然有文献报道了其使用成功的病例,这款瓣膜仍被认为对于钙化程度很低的单纯性AR患者来说,并不十分适合[4,13]。爱德华公司设计的一款用于帮助锚定SAPIEN XT瓣膜的Helio-Dock装置,在一定程度上解决了瓣膜锚定的问题。该装置由股动脉入径进入,捕获三个原生瓣叶后被置入到主动脉窦底部,并与随后经心尖进入的SAPIEN XT瓣膜一起将原生瓣膜夹在中间。与自展瓣不同,Helio-Dock装置提供了内向支撑力,减轻了主动脉瓣环承受的来自Edwards SAPIEN瓣膜的外向扩张力,因此可以防止瓣环进一步扩张,减少迟发性瓣周漏和瓣膜移位的发生[14]。该系列瓣膜的第三代SAPIEN 3与前两代瓣膜相比,增加了一个自适应裙边(图1 B),从而可以进一步降低瓣周漏的发生率[15]。
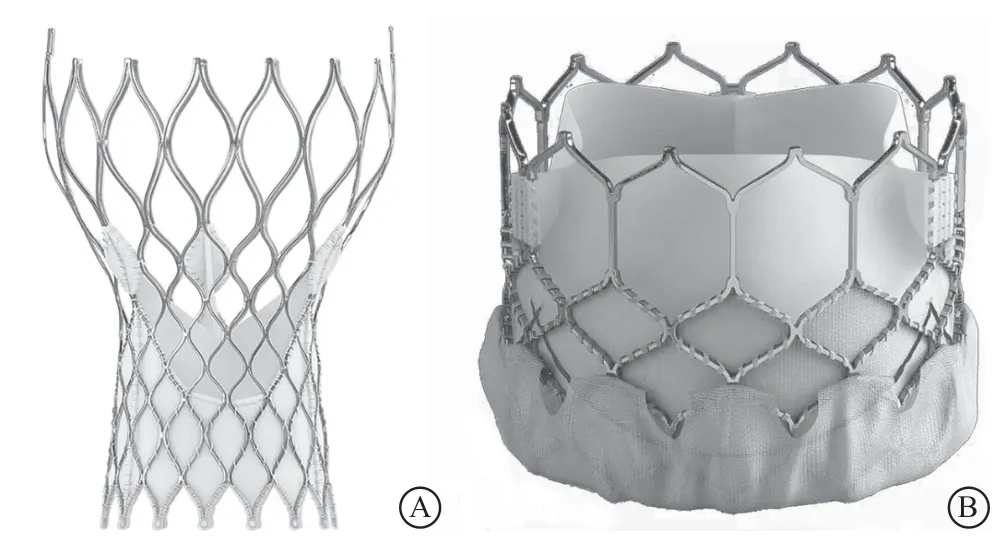
图 1 应用于经导管主动脉瓣置换术治疗单纯性主动脉瓣关闭不全的常见瓣膜 A.美国美敦力公司研发的CoreValve瓣膜;B.美国爱德华生命科学公司研发的SAPIEN 3瓣膜
1.3 JenaValve和Engager valve瓣膜
JenaValve瓣膜是一款经欧盟CE认证的用于经心尖TAVR治疗单纯性AR的人工瓣膜(图2 A~B),目前在临床上的应用较为广泛[12,16]。该瓣膜的主体是一个内置三叶猪心包瓣膜的镍钛合金支架,其三个定位键有助于瓣膜的解剖学定位,而特殊的夹持装置能提供额外轴向力,在将支架牢固地固定在原生瓣膜上的同时,还能降低瓣膜径向过度扩张带来的主动脉瓣环撕裂的风险[17-18]。该款瓣膜的不足之处在于定位键和支架之间连接的不可移动性,一旦定位键定位不佳有可能会引起瓣膜对位及锚定的不准确,导致瓣周漏以及瓣膜移位发生[11]。另外,在使用JenaValve瓣膜进行手术时,对比剂的使用量相比于其他二代瓣膜更大,可能导致更高的急性肾功能不全发生率[15]。Seiffert等[12]使用JenaValve瓣膜进行TAVR的成功率为96.5%,无或微量瓣周漏的发生率为90%(28/31),术后30 d及6个月的全因死亡率分别为12.9%和19.3%。Sawaya等[15]报道的手术成功率则为83%(19/23)。
美敦力公司生产的Engager valve瓣膜设计与JenaValve瓣膜相似(图2 C),也是一款经心尖入径置入的瓣膜,通过将具有解剖学定位功能的操纵臂置于主动脉窦根部,实现瓣膜支架的准确定位,并降低并发症的发生风险[18-19]。

图 2 应用于经导管主动脉瓣置换术治疗单纯性主动脉瓣关闭不全的常见瓣膜 A~B.德国科技公司研发的enaValve瓣膜;C.美国美敦力公司研发的Engager valve瓣膜
1.4 J-Valve瓣膜
J-Valve瓣膜是由中国苏州杰成公司设计的一款猪心包自展瓣膜(图3 A),主要经心尖入径置入。瓣膜支架通过缝线与三个定位键相连。定位键与支架之间独特的可移动连接是它与JenaValve瓣膜最大的不同之处。这样的设计使瓣膜的置入可以分两个阶段完成:第一阶段是将定位键放入主动脉窦底部,第二阶段是瓣膜的定位和释放。当定位键被放置在主动脉窦部以后,人工瓣膜的位置可以根据冠状动脉开口的高低沿着垂直于瓣环平面的方向进行调整。一方面可以避免冠状动脉梗阻的出现;另一方面当瓣膜位置受到瓣环钙化等异常结构的影响时,术者仍然可以将瓣膜置于与左心室流出道同轴的最佳位置[11,20]。同时,天然主动脉瓣环与人工瓣膜假体之间良好的密封性可以在一定程度上降低瓣周漏的发生风险。除此之外,J-Valve瓣膜还具备与JenaValve瓣膜类似的两点优势:(1)医师在手术时并不完全依赖图像引导,而是可以通过牵拉获得直接的触觉反馈来判断人工瓣膜的位置,在很大程度上简化了手术,并最大限度地减少了术中并发症的风险[21];(2)依靠夹持固定提供的轴向力,减轻瓣环的径向扩张力,减少了三度房室传导阻滞或瓣环撕裂的风险[11,22]。Zhu等[20]对33例使用J-Valve瓣膜接受TAVR的单纯性AR患者的随访结果显示,瓣膜学术研究联盟标准化定义的手术成功率为94%(31/33),1例患者因透视成像不足导致的瓣膜栓塞而中转开胸手术,1例患者术后并发中度瓣周漏。其他主要并发症如三度房室传导阻滞、心肌梗死、脑血管及大血管事件的发生率为0。术后30 d随访,全因死亡率为3%,1例术后中度瓣周漏的患者在术后20 d由于充血性心力衰竭死亡,1例患者由于急性肾损伤需血液透析支持。无中度以上瓣周漏发生,72%(23/31)无或仅有微量瓣周漏发生。2例患者由于三度房室传导阻滞接受永久起搏器植入。术后6个月,无或微量瓣周漏的发生率为87%(27/31),31例成功接受TAVR的患者运动耐力和生活质量均较术前得到明显提升。J-Valve瓣膜自2017年6月批准于中国上市以来,目前已临床应用超过400例,其中半数以上为单纯AR患者,进一步大样本数据正在汇总中。
1.5 ACURATE系列瓣膜
ACURATE系列瓣膜由瑞士的Symetis公司研发,目前主要包括用于经心尖入径的ACURATE TA瓣膜和用于经股动脉入径的ACURATE neo瓣膜(图3 B)。与其他自展瓣膜相比,该系列瓣膜主要有三个特点:(1)独特的从上到下的释放过程,保证了人工瓣膜对左心室流出道堵塞的程度最小。(2)沙漏样设计,瓣膜的定位和固定主要依靠“窄腰”实现。(3)使用有机材料覆盖支架主体和下部的内外表面以稳定瓣膜,并且避免生物组织和金属支架之间的直接接触。稳定装置和支架上部保证了释放期间准确的同轴性和良好的稳定性,而沙漏设计和防瓣周漏的裙边则有助于帮助获得牢固的置入和良好的密封[6,17,23]。
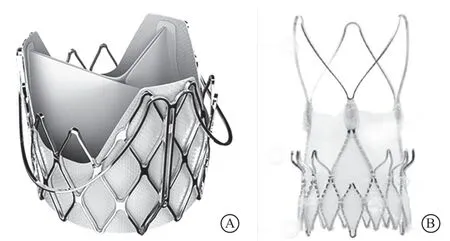
图 3 应用于经导管主动脉瓣置换术治疗单纯性主动脉瓣关闭不全的常见瓣膜 A.中国苏州杰成医疗科技有限公司研发的J-Valve瓣膜;B.瑞士Symetis公司研发的ACURATE neo瓣膜
1.6 Direct Flow Valve和Lotus valve瓣膜
这两款瓣膜主要经股动脉入径置入,在具有上述瓣膜某些特点的同时,最大的优势是它们具有可回收的特性,如果术者对瓣膜的位置或稳定性不满意,这两款瓣膜可以完全回收并重新置入[24-25]。在提高手术成功率的同时,也能大大提高术者的信心。
2 困难与挑战
与AS多由主动脉瓣退行性变及钙化造成不同,单纯性AR的病因往往更为多样,解剖结构也更为复杂,这在一定程度上增大了手术操作的难度[6,16]。对于单纯性AR常见的缺少钙化和主动脉根部及升主动脉扩张的问题,前者通过二代瓣膜锚定方式的不断改进在一定程度上得到了解决,而后者则是目前还无法攻克的一个难题,许多患者因此只能选择开胸手术甚至保守治疗。另外,与严重AS患者相比,单纯性AR患者往往伴有更为严重的临床症状,如肺动脉高压、心功能不全等[6]。同时,单纯性AR导致的晚期左心室肥大、心肌纤维化及心功能不全即使在TAVR后也可能无法逆转,因此,这类患者的预后往往较差[16]。最后,如何选择合适的人工瓣膜,目前尚无统一科学的标准。Webb等[24]认为,治疗单纯性AR的理想瓣膜应包括以下几个特点:(1)有多样性及大尺寸的瓣膜可供选择;(2)不依靠钙化和过度扩张进行锚定;(3)瓣膜可以重新定位和回收。目前临床上各款瓣膜的研究结果往往由于样本量小、随访时间短等因素的限制而缺少足够的说服力,实际的瓣膜选择更多还是依靠术者的经验。目前我国研发的J-Valve瓣膜,与一代瓣膜相比,在瓣中瓣置入率及术后瓣周漏的发生率上都有一定程度的改善,独特的定位装置已初步解决了瓣膜定位、防止瓣周漏及三度房室传导阻滞等问题,为单纯AR的微创治疗带来曙光。最新的研究显示,在治疗单纯性AR时,二代瓣膜与一代瓣膜相比能达到更为理想的手术成功率和术后生存率,而以J-Valve瓣膜为代表的专门针对单纯性AR的人工瓣膜在手术成功率上则好于其他二代瓣膜[26-27]。但目前阶段,多数的经导管瓣膜器材仍选用经心尖入径,器材输送系统尺寸过大,限制了其进一步临床应用。因而,开发稳定可靠、能够经外周血管入径置入、更理想的人工瓣膜,并建立科学统一的人工瓣膜选择标准,是推动TAVR不断发展的有效途径。
3 展望
虽然面临着各种各样的问题,但是大量的临床研究也让我们看到了TAVR用于治疗单纯性AR的光明前景[28-29],尤其是J-Valve瓣膜等产品的应用,目前已经让我们看到了TAVR应用于单纯性AR的曙光。随着临床医师对这种疾病认识的不断提升、人工瓣膜性能的不断改进和手术水平的不断提高,这项技术一定会得到更为广泛的传播和应用,从而使更多单纯性AR患者从中获益。
