工程大肠杆菌异源表达D-阿洛酮糖3-差向异构酶的诱导工艺研究
2020-01-03超陈博李义45佟毅45
彭 超陈 博李 义45佟 毅45
(1.中粮营养健康研究院有限公司,北京102209;2.营养健康与食品安全北京市重点实验室,北京 102209;3.老年营养食品研究北京市工程实验室,北京 102209;4.中粮生物科技股份有限公司,安徽 蚌埠 233010;5.玉米深加工国家工程研究中心,吉林 长春 130033)
D-阿洛酮糖是D-果糖在C-3的差向异构体,是自然界中存在含量极少的一种稀有单糖,具有极低的热量值,与蔗糖甜度相似,但吸收率仅为蔗糖的0.3%,故可以替代蔗糖作为低热甜味剂,而且研究表明D-阿洛酮糖具有多种营养学和生理学功能[1-3]。但是,D-阿洛酮糖的化学合成比较困难,以钼酸盐为催化剂,反应温度维持在80~120 ℃,过程副产物较多[4],目前尚未有突破性进展。生物转化方法单一,纯化步骤简单,受到科研人员的重点关注,利用微生物途径和酶催化转化法生产D-阿洛酮糖是目前的主流研究方向,而DPEase酶可以催化D-果糖和D-阿洛酮糖之间的转化,利用D-果糖生产D-阿洛酮糖[5-6]。
笔者以中粮营养健康研究院构建的高效表达DPEase酶的工程大肠杆菌为研究对象,在5 L发酵罐中考察诱导时间、诱导温度、诱导pH和诱导剂用量对大肠杆菌生长和蛋白酶表达的影响,确定了大肠杆菌异源表达DPEase酶的较优诱导条件,为进一步研究D-阿洛酮糖的生物转化提供技术参考。
1 材料与方法
1.1 菌 株
工程大肠杆菌NHRI-Ec01,中粮营养健康研究院实验室构建并保藏,卡那霉素抗性。
1.2 菌种培养基
种子培养:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L。
发酵培养基:磷酸二氢钾9 g/L,磷酸氢二铵4 g/L,无水柠檬酸1.7 g/L,酵母粉5 g/L,葡萄糖20 g/L,七水硫酸镁0.6 g/L,维生素B1 0.004 5 g/L,消泡剂0.1 g/L,微量元素1 mL/L,25%氨水溶液调节pH至7.0±0.1。
微量元素:EDTA 0.72 g/L,六水氯化钴0.25 g/L,四水氯化锰1.5 g/L,五水硫酸铜0.22 g/L,硼酸0.3 g/L,钼酸铵0.182 g/L,硫酸锌1.7 g/L,五水柠檬酸铁铵17.58 g/L,浓硫酸1 mL,去离子水1 L。按配方配好后在超净台用0.22 μm无菌过滤膜过滤,装入无菌棕色瓶避光4 ℃保存。
补料培养基:葡萄糖600 g/L,无水柠檬酸15 g/L,七水硫酸镁2 g/L。
1.3 仪器与设备
Y-1200型可见分光光度计,上海美谱达仪器有限公司;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;Milli-Q超纯水仪,美国密理博有限公司;ZQZY-CF8振荡培养箱,上海知楚仪器有限公司;1-14小型台式离心机,Sigma;1260 infinity高效液相色谱仪,Agilent Technologies;SBA-40E生物传感分析仪,山东省科学院生物研究所;BioFlo 115发酵罐,New Brunswick;LX-600冷却水循环装置,YKKY;750-30无油空气压缩机,上海捷豹压缩机制造有限公司。
1.4 培养方法
1.4.1 种子培养
工程大肠杆菌NHRI-Ec01的甘油管菌种保藏于-80 ℃冰箱内待用。取甘油管内200 μL菌悬液接入装有100 mL种子培养基的250 mL三角瓶中,30 ℃,200 r/min条件下在恒温振荡培养箱内培养16~17 h后得一级种子液,种子液OD600达到3.0以上。
1.4.2 发酵罐发酵
新鲜种子液按体积分数5%的接种量接入灭菌并冷却后的5 L发酵罐中,培养液的初始体积为3 L,卡那霉素抗性加至质量终浓度为50 μg/mL。初始培养温度为37 ℃,初始通气比为1 m3/(m3·min),25%氨水调节pH在6.8~7.2,初始糖耗尽后,采用补料-溶氧联动方式控制补料培养基流加速率,使得发酵液中残糖含量恒定维持在较低水平(小于1.0 g/L),溶氧(Dissolved oxygen,DO)与转速级联,并控制DO在25%左右,发酵液OD600达到一定水平后,调整发酵温度和pH至不同水平,添加一定量的诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导表达。
1.5 检测方法
1.5.1 菌体量测定
将发酵液按照一定倍数稀释,直至在600 nm波长处的吸光值介于0.3~0.7,测量600 nm下的吸光值,乘以稀释倍数即为菌体量(OD600)。
1.5.2 残糖测定
取新鲜均一发酵液,以12 000 r/min高速离心,收集上清液,稀释至可检测范围,SBA-40E型生物传感器进行分析检测。
1.5.3 DPEase酶浓度测定
安捷伦HPLC 1260化学工作站,色谱柱为waters sugar-Pak I,规格为10 μm ×6.5 mm×300 mm,示差折光检测器RID,检测器温度55 ℃,进样量10 μL,以脱气超纯水作流动相,流速为0.4 mL/min,柱温为85 ℃。
样品的测定:发酵液离心收集菌体后,无菌生理盐水重悬至OD600值为100,60 MPa压力下均质机处理2~3次,细胞破碎液经离心得到澄清酶液。新鲜酶液经稀释后,与30%质量浓度的果糖葡萄糖混合液按体积比1∶20混合,55 ℃条件下反应5 min。反应后的样品在100 ℃条件下高温煮10 min以终止酶反应。酶反应产物低温离心,上清液用0.22 μm微滤膜过滤处理,稀释后进行HPLC检测。
假设标准曲线方程为Y=AX+B,Y为峰面积,由液相检测可得,A和B分别代表标准曲线的斜率和截距,X为D-果糖浓度,由标准曲线方程式计算可得。平衡转化率计算公式为

式中:X1为各样品的D-果糖浓度;X2为空白对照的果糖浓度。
2 实验设计与结果分析
2.1 工程大肠杆菌NHRI-Ec01的生长曲线测定
按1.4.2描述的方法进行5 L发酵罐培养(未诱导无补料),每隔2~4 h取样测定OD600,并绘制出NHRI-Ec01菌株在5 L发酵罐培养的生长曲线如图1所示。
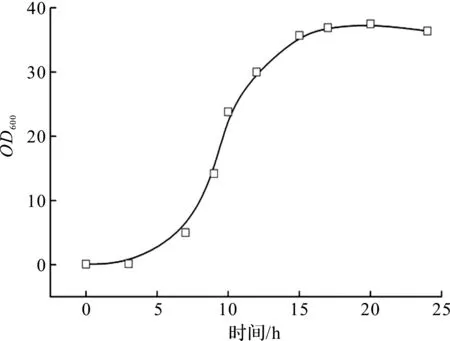
图1 工程菌在5 L发酵罐中生长曲线Fig.1 The growth curve of engineering bacteria NHRI-Ec01 in 5 L bioreactor
由图1可知:培养6 h,菌体生长进入指数期(OD600为3.59),16 h进入稳定期(OD600维持在35~37)。若进一步延长周期,菌体会因为营养缺陷而进入衰亡期。指数生长期中期,菌体生长最为活跃,对外界环境最为敏感[7-8],因此将指数生长期中期(6~12 h)作为NHRI-Ec01菌株的最佳诱导时机。
2.2 诱导温度对工程菌生长和DPEase酶平衡转化率的影响
异源蛋白的表达很大程度上会增加宿主菌株的负担,影响自需蛋白的正常表达,蛋白质三维结构的正确折叠才是功能蛋白的合成基础。通过降温处理,可减缓多肽合成速率,为肽链正确空间折叠预留充足时间,避免形成无生物活性的包涵体结构[9-10]。本实验按照1.4.2描述的方法进行5 L发酵培养,初始温度固定37 ℃,从指数期中期开始,培养温度分别降至30,25,20 ℃,待温度稳定后进行IPTG诱导,以考察诱导温度对工程菌生长和DPEase酶表达的影响。发酵结果及酶活转化率数据如图2,3所示。
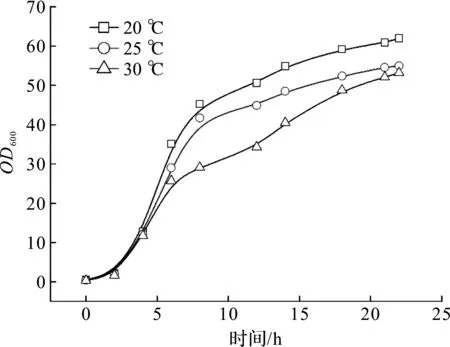
图2 诱导温度对工程大肠杆菌生长的影响Fig.2 Effect of induction temperature on biomass growth and DPEase conversion rate
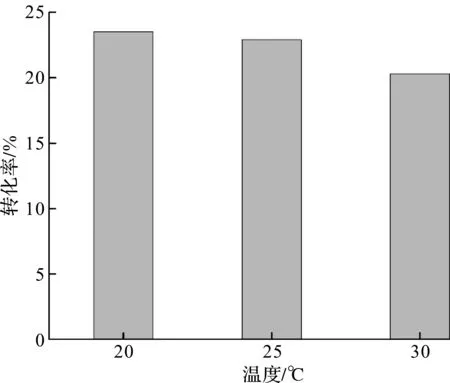
图3 诱导温度对DPEase酶平衡转化率的影响Fig.3 Effect of induction temperature on DPEase conversion rate
由图2可知:菌种活力旺盛,接种量合理,没有明显的延滞期,发酵6 h生长曲线已经达到指数中期,分别降温至不同水平并诱导后,菌体生长速率不同程度受影响,其中20 ℃诱导后的菌体生长速度影响最小,最高菌体OD600为62,可能是因为异源蛋白正确折叠,菌体负载压力变化不大,而继续保持较高温度,形成包涵体沉淀的蛋白越多(蛋白胶图未提供),不可溶性错误蛋白的积累不利于菌体生长,诱导18 h后发酵结束。
由图3可知:低温诱导表达的DPEase酶平衡转化率最高,接近24%,尽管离文献报道的最大转化率64%相差甚远[11],但基本可以证明低温诱导的优越性。另外,低温发酵往往会增加冷却机组的能耗,加重企业运行成本,而图3同样揭示了不同温度诱导后的平衡转化率差异不大。基于此,该工程菌的最佳诱导温度可以因季节和区域的不同,选定20~30 ℃比较适宜。
2.3 pH对工程菌生长和DPEase酶平衡转化率的影响
蛋白质的四级结构同样受外界环境pH的影响。蛋白质一级结构是正确翻译的氨基酸序列,序列中酸性氨基酸和碱性氨基酸的数量不同,影响到肽链或者蛋白质的等电点;同时,维持蛋白质二级和三级结构的氢键和静电作用也受环境pH的影响[12-13]。本实验按照1.4.2描述的方法进行5 L发酵培养,初始pH 7.0,培养至指数中期后降温至25 ℃,并分别调整pH为6.6,7.0,7.4,待温度和pH稳定后进行IPTG诱导,诱导时长超过18 h,以考察不同诱导pH对工程菌生长和DPEase酶表达的影响。发酵结果及酶活转化率数据如图4,5所示。
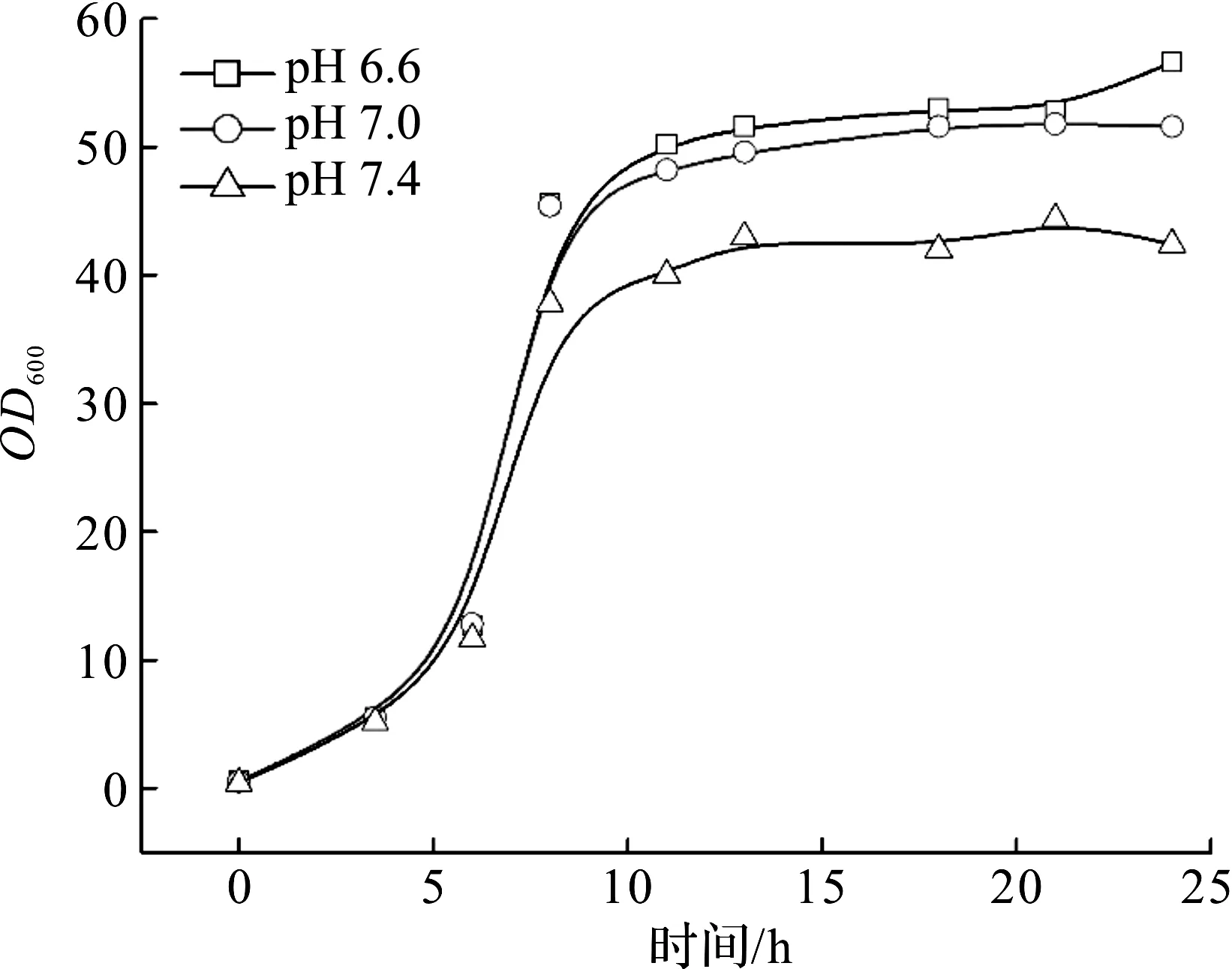
图4 诱导pH对工程菌生长的影响Fig.4 Effect of induction pH level on biomass growth

图5 诱导pH对不同时间点相应DPEase酶的平衡转化率的影响Fig.5 Effect of induction pH level on DPEase conversion rate at different time
图4,5分别了揭示了诱导pH对该工程菌生长和DPEase酶活性的影响。由图4,5可知:诱导之前,发酵罐之间的生长平行性良好,降温调pH后,相对来说,碱性环境对生长的影响较为明显,稳定平台期的生物量比其他两组低16%~19%,推断是过量氨水中和了中间代谢有机酸,对有机酸的传递与供应产生了竞争抑制。控制pH为6.6时,发酵稳定平台期的OD600比pH 7.0方案稍高,说明该改造菌株适应于中性和偏酸性环境,与文献报道的工程大肠杆菌异源表达类人胶原蛋白生长最适pH接近[14]。
对于DPEase酶的表达,发酵终点DPEase酶的平衡转化率受pH影响变化不大,均在28%左右,但是相对于其他2组,pH 7.0恒定方案在发酵周期控制上有明显优势,在诱导12 h、发酵18 h就可以达到最高的平衡转化率,发酵周期压缩25%,恒定pH亦不会额外增加酸碱用量。因此,选择pH 7.0作为诱导pH。
2.4 诱导剂用量对工程菌的生长和DPEase酶表达的影响
Lac操纵子来源的启动子经常被用于原核表达系统(如大肠杆菌)的启动表达,乳糖及类似物作为诱导剂,IPTG被认为是一种高效的非代谢性分子生物学诱导剂,但IPTG价格昂贵,诱导剂成本往往成为最大的原料成本[15],甚至可以决定一个工程菌产业化项目的利润率高低,因此合适的诱导剂用量,即可以保证异源蛋白的有效表达,又可以避免高价IPTG的浪费。
本实验按照1.4.2描述的方法进行5 L发酵培养,初始pH7.0,培养至指数中期后降温至25 ℃,并维持pH为7.0,待温度和pH稳定后进行IPTG诱导,诱导剂的终浓度分别为0.2,0.5,1.0 mmol/L。诱导时长18 h,以考察不同诱导剂用量对工程菌生长和DPEase酶表达的影响。发酵结果及酶活转化率数据如图6,7所示。
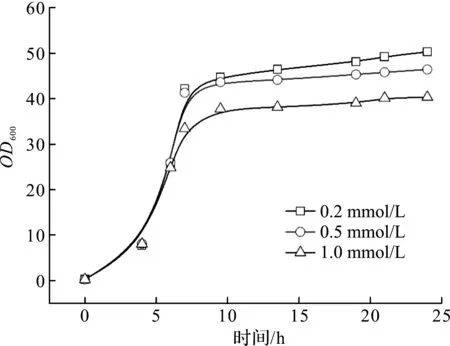
图6 诱导剂用量对工程大肠杆菌生长的影响Fig.6 Effect of terminal concentration of IPTG on biomass growth
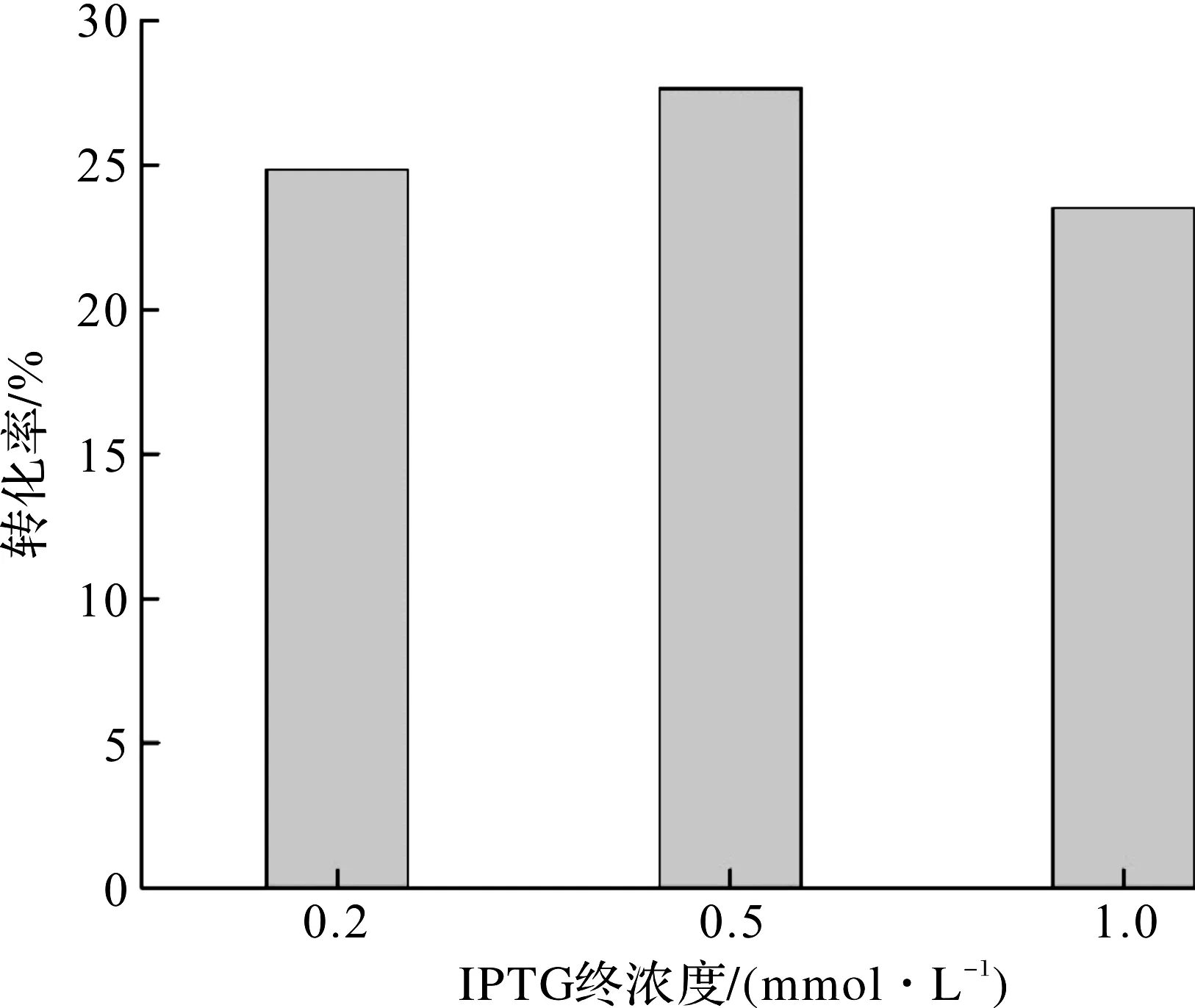
图7 诱导剂用量对DPEase酶平衡转化率的影响Fig.7 Effect of terminal concentration of IPTG on DPEase conversion rate
由图6,7可知:诱导剂的影响非常显著,其中图6比较了诱导前后的生长趋势,图7显示最适诱导剂浓度为0.5 mmol/L。IPTG作为一种强效诱导剂,对菌体具有一定的毒性,瞬间的浓度过高,导致异源蛋白非正常折叠的概率增加,非可溶性蛋白进一步增加了菌体的生长负担,发酵中后期菌株逐渐适应,表现出轻微增长,低浓度的诱导剂收获最高的生物量。对于DPEase酶的平衡转化率,IPTG的终浓度符合0.1~1.0 mmol/L的经验范围[16],且在实验范围内,平衡转化率先增后降,IPTG终浓度为0.5 mmol/L时对应的平衡转化率最高,达到27.6%。
3 结 论
对基因工程菌株进行诱导培养的目的在于提高目的蛋白的表达产量,降低成本。目的基因的表达量,除了受菌株自身因素和质粒稳定性的影响外,还受诱导工艺的影响,因此探索一套最优的诱导工艺至关重要[17]。本研究系统考察了工程大肠杆菌NHRI-Ec01诱导表达D-阿洛酮糖3-差向异构酶的最优条件,经验证,生长初期温度为37 ℃,指数中期(6 h)开始降温至25 ℃,pH恒定7.0,待温度和pH稳定后,一次性加入终浓度为0.5 mmol/L的IPTG诱导剂,诱导时长18 h,该工程大肠杆菌发酵生产DPEase酶的平衡转化率可达到28%,达到已公开报道的平均水平[5]。该诱导工艺同时兼顾能耗成本和发酵周期,为项目的下游工艺探索和提升提供了一定的参考依据。
