慢性光照联合氢醌诱导小鼠年龄相关性黄斑变性模型
2020-01-01张晶许凯梁洁陈强马群英梁丽娜
张晶,许凯,梁洁,陈强,马群英,梁丽娜
(中国中医科学院眼科医院,北京 100040)
年龄相关性黄斑变性(age-related macular degeneration,AMD)是55岁以上人群主要的致盲眼病之一。随着中国老龄化问题的日益严重,其患病率逐年升高,其发病机制和防治成为研究的热点,合适的动物模型是相关研究工作的重要工具。近年来国内外建立了各种AMD动物模型[1],不同的动物模型各有其优缺点,理想的动物模型应该更经济和更接近于人类AMD自然病程。AMD的病因和发病机制仍然存在很大的争议,目前得到公认的是受年龄、基因和环境的影响,其中吸烟和光暴露是AMD发生的重要环境危险因素,既往大量报道以吸烟、光照诱导出部分AMD病理改变动物模型[2-3],而人类AMD是一个多因素作用、光感受器细胞、RPE细胞和脉络膜毛细血管之间相互影响形成的复杂“系统”的表现。因此,联合多种发病诱因,尽可能模拟AMD发生的环境因素,可能会建立更接近人AMD发病机制的动物模型。本研究,我们采用慢性光照联合氢醌饲料喂养的方法诱导出类似晚期AMD病变模型,报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
4月龄健康雄性SPF级C57BL/6小鼠20只,购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。实验动物饲养于中国中医科学院眼科医院实验动物中心屏障级动物房内【SYXK(京)2014-0019】。温度(22±5)℃,湿度(50±5)%。所有实验操作遵循眼科技视觉研究动物ARVO宣言,并按实验动物3R原则给予人道关怀。
1.1.2 试剂与仪器
氢醌(Sigma-Aldrich,H9003);TUNEL细胞原位凋亡试剂盒(Roche Life Science,12156792910); HE染色试剂盒(北京博奥森生物技术有限公司,C02-04004);4′,6-二脒基-2-苯基吲哚染色液(4′,6-diamidino-2-phenylindole,DAPI,BD PharmingenTM,564907);抗荧光淬灭剂(北京博奥森生物技术有限公司,C-101); DNA酶I(大连TaKaRa公司,D2270 A);冰冻包埋剂(optimal cutting temperature compound,O.C.T,美国Sakura公司,4583); 4%多聚甲醛(北京Unique生物科技有限公司,P1110);VEGF(Abcam,ab52917);CD31(Abcam,ab28364);罗丹明标记的山羊抗兔二抗(北京博奥森生物技术有限公司,AE042337);牛血清白蛋白(Bovine Serum Albumin, BSA, 北京博奥森生物技术有限公司,bs-2315)。光学显微镜(DM2500,Leica,德国), 透射电子显微镜(JEM-1400,日本电子株式会社,日本), 冰冻切片机(CM1850,Leica,德国),光照度计(北京师范大学光电仪器厂,ST-85,中国),大鼠SPF级生长繁育饲料(北京科奥协力饲料有限公司,中国)。
1.2 方法
1.2.1 动物模型建立
动物按照随机数字表法分为模型组10只,正常对照组10只。模型组小鼠置于自主设计的LED光照装置中(专利号:2017210439226)波长400~750 nm,光照度计测量,保证在动物头部水平测量光照强度可达2500 lx,每日接受12 h光照;同时被喂以基于基础纯净合成的含8 g/(kg·bw)的饮食;正常组小鼠被喂以不含氢醌的同配方饮食,正常昼夜节律饲养。两组动物饲养3.5个月后进行模型评价。
1.2.2 视网膜电图(ERG)检测
各组小鼠于检测前暗适应24 h,复方托吡卡胺滴眼液点双眼常规散瞳20 min;采用盐酸氯胺酮-盐酸塞拉嗪混合麻醉剂(v∶v=1∶7)肌注(0.01 mL/kg)麻醉小鼠。检测操作全程均在弱红光灯下进行操作。将参考电极和接地电极分别置于小鼠正中头皮下及双下肢皮下。将双侧角膜电极置于大鼠双侧眼睑内,保持各电极间阻抗始终<5 kΩ。以Ganzfeld全视野刺激器进行刺激,根据国际临床视觉电生理协会(ISCEV)制定的最新国际标准[4],依次选定暗适应0.01 ERG,暗适应3.0 ERG,暗适应3.0 震荡电位,(自动明适应 10 min)明适应3.0 ERG,闪烁光反应进行检测。依次记录各组a波、b波的峰时值(ms)和振幅值(μV)。
1.2.3 视网膜光镜观察
颈椎脱臼法处死小鼠,快速摘取眼球,1 mL注射器角膜穿刺置于4%多聚甲醛固定20 min,解剖显微镜下小心去除眼前节和部分玻璃体,余下组织继续固定24 h,梯度酒精脱水、二甲苯透明后浸蜡包埋。连续4 μm切片,切片常规脱蜡至水后行HE染色,光学显微镜观察视网膜各层病理改变。
1.2.4 视网膜透射电镜检测
颈椎脱臼法处死小鼠,快速摘取眼球,立刻置于4℃,2.5%戊二醛中固定0.5 h,显微镜下去除眼前节组织及部分玻璃体,保留视杯,解剖显微镜下切取视乳头颞侧1 mm上方全层眼球壁,大小1 mm× 1 mm × 2 mm。锇酸固定、梯度酒精脱水、环氧丙烷树脂浸透包埋组织,制作900 nm超薄切片,醋酸双氧铀、枸橼酸铅避光染色、风干,透射电子显微镜观察视网膜超微结构。
1.2.5 TUNEL检测视网膜细胞凋亡
动物眼球取材固定同HE染色,4%多聚甲醛液中4℃固定24 h后,冰冻包埋剂OCT包埋后液氮冷冻。冰冻切片机-23℃下行垂直视网膜的8 μm冰冻切片。冰冻切片磷酸缓冲液(PBS)室温15 min ×3次洗脱包埋剂,进行TUNEL检测,具体操作参见试剂盒说明,完成后进行DAPI复染细胞核,抗荧光衰减封片剂封片,荧光显微镜下观察。每组随机选取10张片子,每张切片计数一个高倍视野下凋亡的感光细胞数及感光细胞总数,计算凋亡率。
1.2.6 免疫荧光检测VEGF及CD31表达
将冰冻切片置于磷酸缓冲液(PBS)室温10 min × 3次,然后置于1% Triton X-100 溶液30 min,2%牛血清白蛋白的室温封闭 2 h后依组别分别滴加一抗VEGF,CD31,4℃孵育过夜。PBS溶液室温洗涤10 min × 3次,滴加罗丹明标记的山羊抗小鼠二抗,室温下孵育 1 h,PBS清洗10 min × 3次,DAPI复染细胞核5 min。抗荧光衰减封片剂封片,荧光显微镜下观察。
1.3 统计学分析
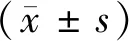
2 结果
2.1 视网膜电图(ERG)检测
暗适应0.01 ERG正常组视网膜b波振幅(234.00±20.95)μV,模型组b波振幅(113.00±16.13)μV,模型组较正常组明显降低,差异有统计学意义(P<0.05);暗适应3.0 ERG正常组b波振幅(355.50±61.08)μV,模型组(129.00+18.05)μV,模型组较正常组明显降低,差异有统计学意义(P<0.05)。暗适应3.0 震荡电位正常组b波振幅(575.00±115.11)μV,模型组(284.25±55.25)μV,两组差异有统计学意义(P<0.05);明适应3.0 ERG正常组b波振幅(138.00±17.53)μV,模型组(44.50±7.59)μV,较正常组明显降低,差异有统计学意义(P<0.05);闪烁光反应正常组b波振幅(163.00±30.27),模型组(50.50±11.03)μV,模型组较正常组明显降低,差异有统计学意义(P<0.05);见表1。

表1 正常组及模型组视网膜电图检测结果比较Table 1 Electroretinogram (ERG) test between the normal and model groups ± s,n=10)
注:A:正常组,视网膜各层结构排列规整,细胞形态均一,视网膜色素上皮层连续整齐。B:模型组,视网膜各层结构排列较为疏松,感光细胞较正常组减少,视网膜色素上皮层呈现萎缩样改变,Bruch膜可见中断,血管样组织长入(白色箭头)。RGCs:视网膜神经节细胞;INL:内核层;ONL:外核层;RPE:视网膜色素上皮层。图1 正常组及模型组视网膜病理图像(HE染色,×400)Note.A, Normal group, the retina layers were arranged regularly, the cell morphology was uniform, and the retinal pigment epithelium layers were continuous and orderly. B, Model group, the arrangement of retinal layers was looser, the number of photoreceptor cells was less than which in normal group, the RPE layer showed atrophic changes, Bruch membrane was interrupted, and vascular-like tissue grew into (white arrow). RGCs:Retinal ganglion cells. INL:Inner nuclear layer. ONL:Outter nuclear layer. RPE:Retinal pigment epithelium layer.Figure 1 Pathological changes of the retinas in the normal and model groups(HE staining,×400)
2.2 视网膜结构光镜观察
正常组视网膜各层结构排列规整,细胞形态均一,视网膜色素上皮层连续整齐,与正常组相比,模型组视网膜各层结构排列较为疏松,感光细胞较正常组减少,视网膜色素上皮层呈现萎缩样改变,Bruch膜结构破坏,可见血管样组织长入,部分区域增厚,部分区域变薄,感光细胞计数正常组为(243.33±15.231),模型组(164.67±34.37),模型组感光细胞数目明显低于正常组,差异有统计学意义(t=-9.77,P<0.05),见图1。
2.3 视网膜电镜观察
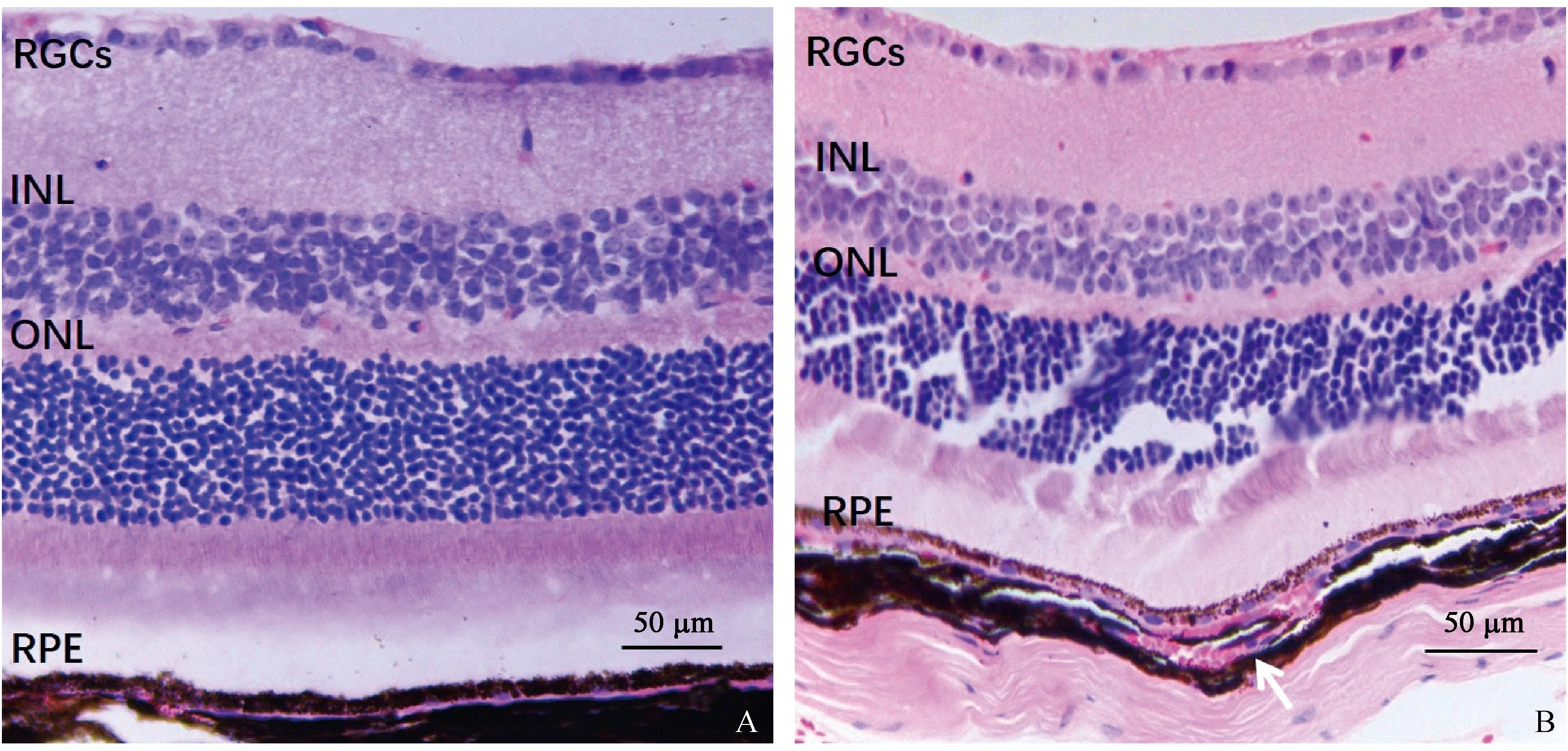
正常组小鼠视网膜感光细胞膜盘结构清晰,排列整齐,色素上皮细胞线粒体丰富,顶部微绒毛数量多而且长,Bruch膜结构规整,厚度均匀。模型组小鼠感光细胞膜盘结构松散变形,出现分离、碎解,固缩等改变。视网膜色素上皮细胞内色素粒减少,顶部微绒毛较正常组稀疏变短,RPE下可见沉积物,Bruch膜结构不规整,厚度不均匀,部分出现中断,内皮细胞长入,见图2。
注: A、B正常组,A图示膜盘结构,B图示Bruch膜及周围结构。C-F模型组,C图可见盘膜结构散乱变形,D-F图色素上皮细胞顶部微绒毛稀疏变短,RPE下沉积物(箭头),Bruch膜不规则,可见中断,内皮细胞长入(黑色箭头)。图2 小鼠视网膜透射电子显微镜图Note. A,B. Normal group. A, Structure of the rod outer segment. B, Bruch membrane and its surrounding structures.C-F. Model groups. C. The disc membrane structure was disorganized and deformed. D-F. the microvilli at the top of the pigment epithelial cells were sparse and shorter, the deposits under RPE (arrow), the Bruch membrane was irregular, and the endothelial cells grew in (black arrow).Figure 2 Transmission electron micrographs of the mouse retinas
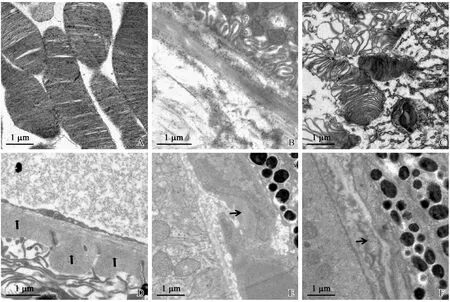
注:A:正常组,未见凋亡细胞;B:模型组,视网膜感光细胞层可见大量凋亡细胞,凋亡细胞呈红色,蓝色为DAPI复染细胞核。RGCs:视网膜神经节细胞;INL:内核层;ONL:外核层;RPE:视网膜色素上皮层。图3 TUNEL检测正常组及模型组视网膜感光细胞凋亡情况Note. A, Normal group, showing no apoptotic cells. B, Model group, showing a large amount of apoptotic cells (red) in the photoreceptor layer of the retina. The cell nuclei were stained as blue by DAPI.(RGCs:Retinal ganglion cells;INL:Inner nuclear layer;ONL:Outter nuclear layer:RPE:Retinal pigment epithelium layer)Figure 3 Apoptosis in photoreceptor cells of the normal and model groups(TUNEL staining)
2.4 视网膜细胞凋亡情况
正常组视网膜各层细胞核排列规整,几乎未见凋亡细胞,模型组感光细胞层细胞核较正常组减少,可发现明显的凋亡现象,感光细胞凋亡率(43.00±2.73)%。见图3。
2.5 视网膜VEGF表达情况
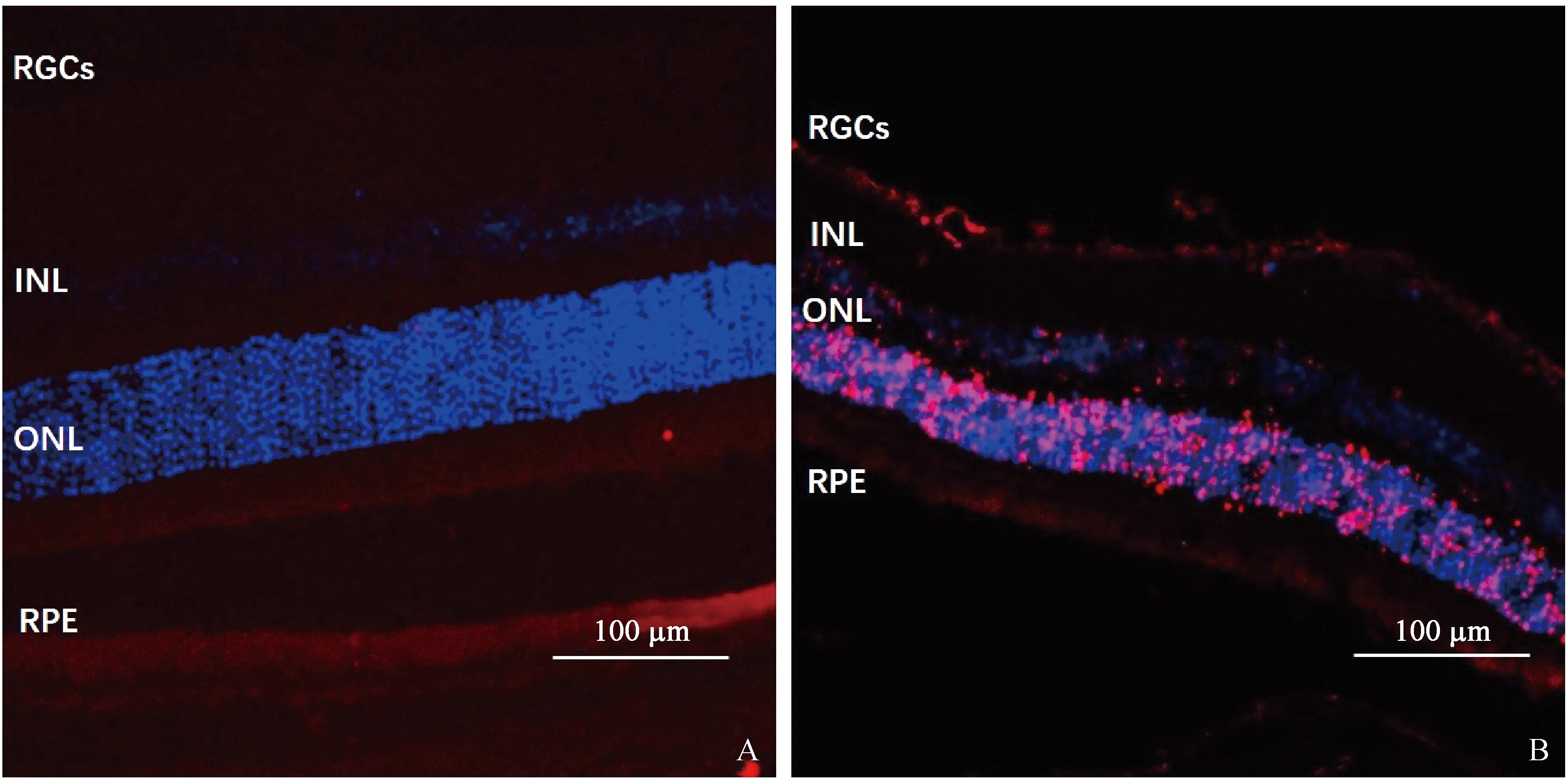
正常组视网膜未见明确的VEGF表达,模型组视网膜色素上皮层及内核细胞层可见较强的VEGF阳性染色。见图4。
2.6 视网膜CD31表达情况
正常组视网膜未见明确的CD31表达,模型组视网膜色素上皮层可见较强的CD31阳性染色。见图5。
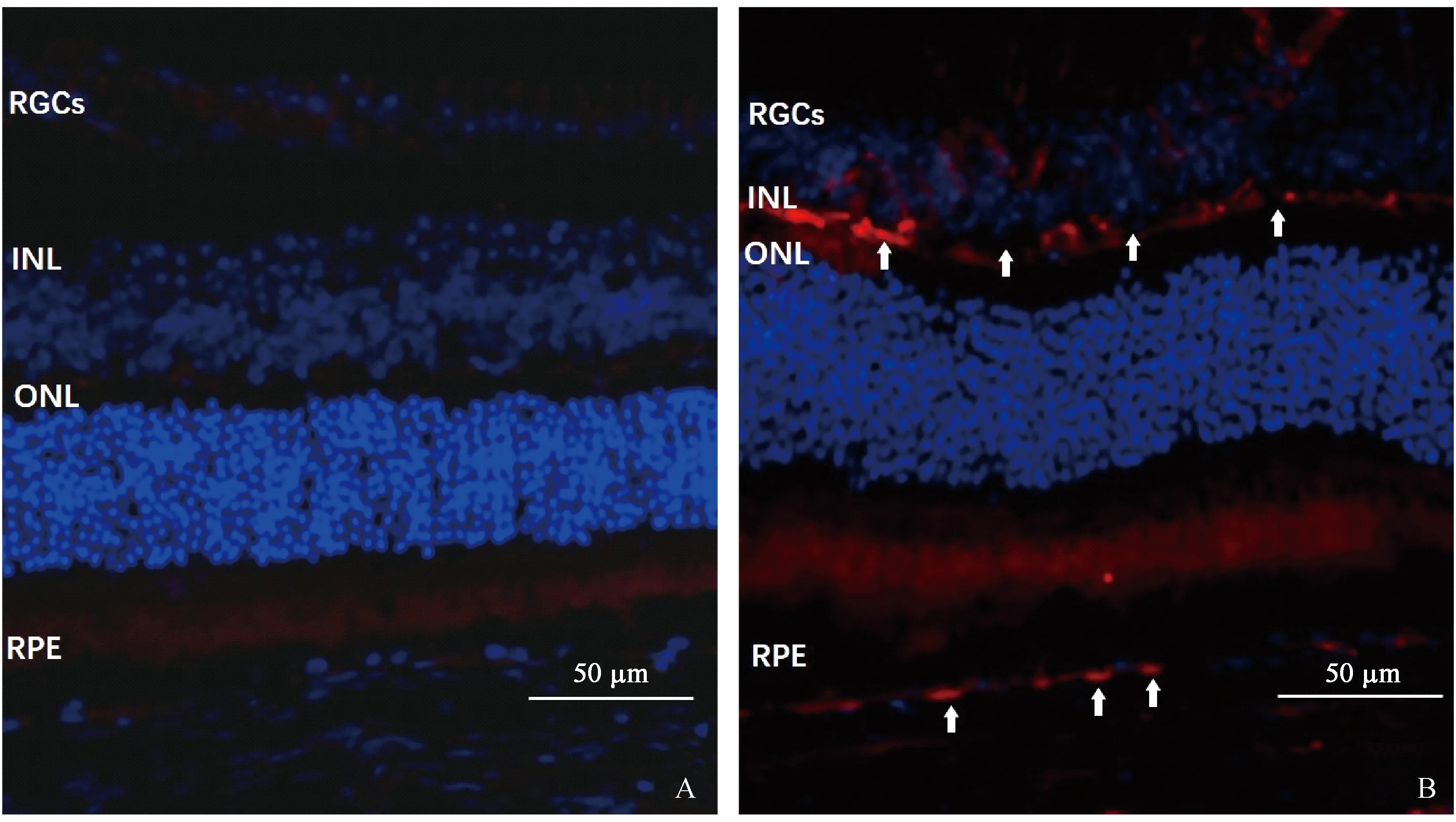
注:A:正常组,未见明确VEGF染色;B:模型组,视网膜色素上皮层及内核层可见VEGF阳性染色呈红色(白箭),蓝色信号为DAPI复染的细胞核。RGCs:视网膜神经节细胞;INL:内核层;ONL:外核层;RPE:视网膜色素上皮层。图4 免疫荧光检测正常组及模型组视网膜VEGF表达情况Note. A, Normal group, showing no VEGF-stained cells. B, Model group, showing VEGF-positive cells in both RPE layer and the inner nuclear layer (white arrow),and all the cell nuclei were stained as blue by DAPI. RGCs:Retinal ganglion cells;INL:Inner nuclear layer;ONL:Outter nuclear layer:RPE:Retinal pigment epithelium layer.Figure 4 VEGF expression in the retina tissues of normal and model groups(Immunofluorescence staining)
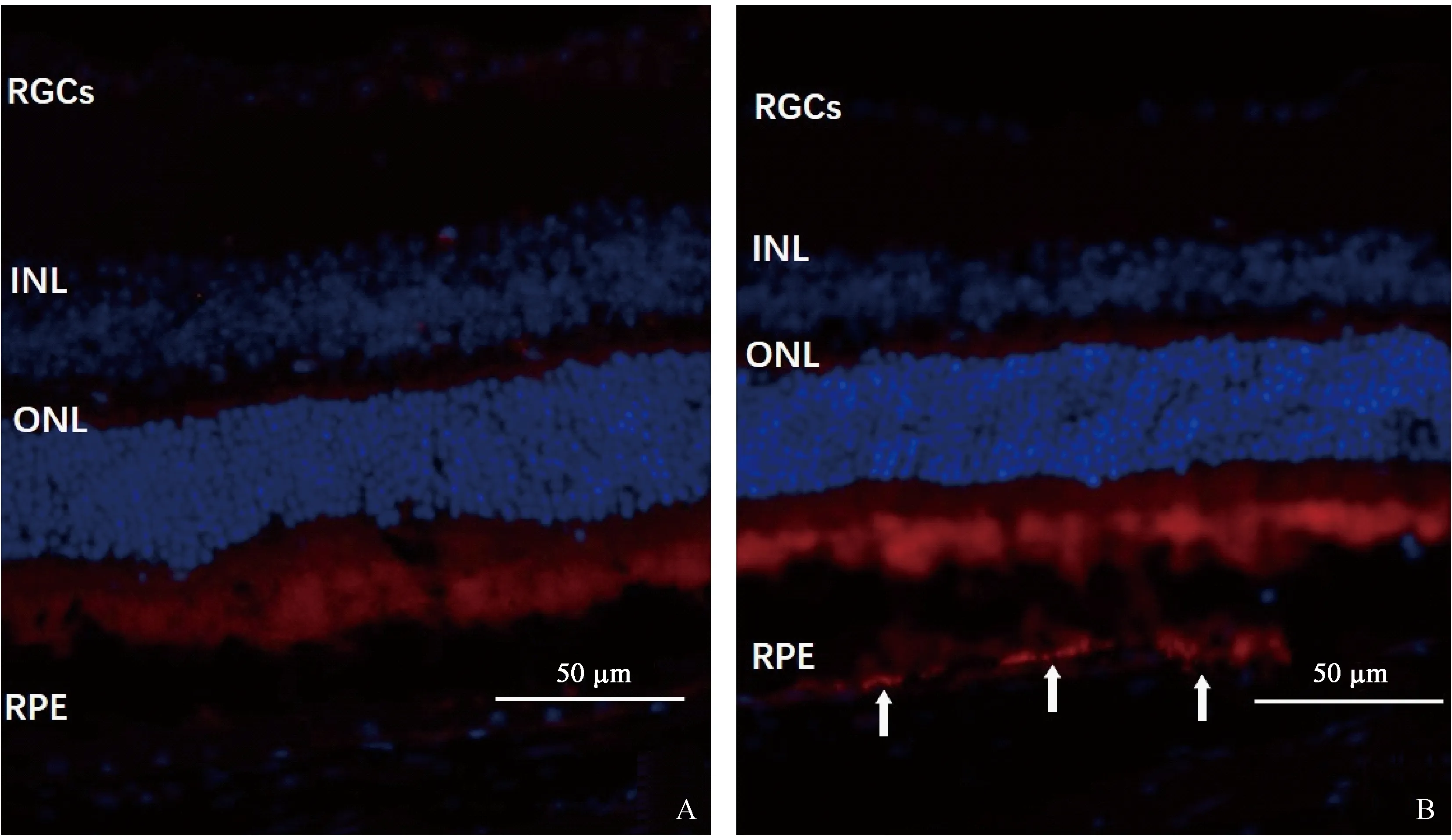
注:A:正常组,未见明确CD31染色;B:模型组,视网膜色素上皮层可见CD31阳性染色呈红色(白箭),蓝色信号为DAPI复染的细胞核。RGCs:视网膜神经节细胞;INL:内核层;ONL:外核层;RPE:视网膜色素上皮层。图5 免疫荧光检测正常组及模型组视网膜CD31表达情况Note. A, Normal group, showing no significant CD31-stained cells. B, Model group, showing numerous CD31-positive cells in the retinal pigment epithelium (white Arrows),and all the cell nuclei were stained as blue by DAPI. RGCS:Retinal ganglion cells;INL:Inner nuclear layer;ONL:Outter nuclear layer:RPE:Retinal pigment epithelium layer.Figure 5 CD31 expression in the retinas of the normal and model groups(Immunofluorescence staining)
3 讨论
目前用于AMD研究的动物模型种类较多,如AMD易感基因工程动物模型[5];激光诱导脉络膜新生血管(choroidal neovascularization, CNV)模型,玻璃体腔注射生长因子诱发脉络膜视网膜新生血管模型,静脉注射碘酸钠诱导视网膜损伤模型,光致视网膜损伤模型等[6]。模型各有特点,但大多偏重于AMD某种病理特征。部分基因工程小鼠模型虽可以呈现人类AMD的特征性变化,但模型建立费用高昂,动物因免疫缺陷及代谢异常存活率低,不易于普及利用。理想动物模型应更近似于临床AMD发病过程,大量研究证实衰老、吸烟[7-8]及持续可见光暴露[9-11]与AMD发生的关系密切。故本研究选择氢醌饲料喂养及慢性可见光暴露模拟AMD发病的环境危险因素。氢醌是香烟中的主要有害物质,具有极强的氧化性,既往研究证实,置于吸烟环境中的小鼠可出现视网膜色素上皮层下沉积物、Bruch膜变薄及RPE细胞凋亡等改变,与人AMD早期改变类玻璃膜疣形成相似[12]。体外实验证实,氢醌处理体外培养的ARPE-19细胞系,可观察到细胞出现过氧化损伤,大量亲电子化合物细胞内蓄积并诱发内质网应激反应,引起细胞系列损伤[13-16]。本课题组前期实验利用含0.8 g/(kg·bw)氢醌饲料喂养小鼠3.5月后,观察到视网膜色素上皮-脉络膜下出现类玻璃膜疣状物沉积,但光感受器细胞病变并不明显[3]。光损伤是AMD另一个重要的环境危险因素,AMD 发病与长期低强度光损伤有关。研究发现可见光通过光毒性和化学毒性导致视网膜感光细胞及RPE损伤[17],实验证实,应用光照强度为2500 lx 的白色光源照射2月龄小型猪3个月后,视网膜发生慢性损伤,以视网膜RPE细胞及感光细胞凋亡为特点,内核层细胞数量减少,视网膜厚度降低[18-19]。此外研究证实,吸烟与可见光暴露对于视网膜细胞损伤还存在交互作用,Zinflou 等[20]实验发现香烟烟雾成分可导致RPE细胞对于蓝光呈现较高的吸收率,导致RPE细胞光损伤加剧。因此,将吸烟与光照两种AMD发病诱因相联合,有可能建立与AMD自然病程及病理特点更接近的动物模型。
人类AMD是涉及光感受器细胞、RPE细胞以及脉络膜血管病变的复杂病理过程。早期病变为视网膜黄斑区出现玻璃膜疣状沉积物drusen,直径65~125 μm,RPE细胞无异常改变;进入中期,黄斑区可见直径125 μm以上drusen形成,同时伴有RPE细胞色素紊乱;随着病情进展,视网膜RPE局灶性脱离,内层视网膜细胞萎缩;晚期可见脉络膜新生血管长入Bruch膜或视网膜地图状萎缩,前者又被称为湿性AMD,后者为干性AMD[21]。本实验选择C57BL/6近交系小鼠为观察对象,尽管小鼠视网膜缺乏确切的黄斑结构,但其视网膜光感受器细胞、RPE细胞、Bruch膜及脉络膜血管等结构与人类视网膜结构极为类似,因此观察小鼠视网膜各结构在AMD重要发病因素作用下的病理变化,可为研究人类AMD的发生提供客观的基础数据。本实验将AMD发病的重要危险因素相联合,4月龄C57BL/6小鼠依据发育周期已属于中年[22],历经3.5个月实验周期恰好进入老年期;每日以含有0.8 g/(kg·bw)氢醌饲料喂养小鼠模拟吸烟环境;采用自主设计的LED冷光源灯架,光源波长范围为400~750 nm模拟人眼可感知的光波范围,以光照强度2500 lx每日光照小鼠12 h,进行慢性光诱导视网膜损伤,既保持动物正常的昼夜节律,又模拟人类随着时间进展视网膜细胞不断发生变化的特点,进而对模型组动物视网膜进行功能学和形态学评价。模型组动物ERG结果暗适应0.01 ERG,暗适应3.0 ERG以及明适应3.0 ERG的b波振幅降低,提示视网膜光感受器细胞以及内层视网膜细胞发生损伤,与人类视网膜变性类疾病ERG呈现类似的变化趋势;电镜观察到模型组视网膜感光细胞膜盘结构松散变形,碎解,RPE细胞内色素粒减少,下方可见沉积物;上述变化与本课题组前期实验单纯氢醌喂养小鼠结果一致[3],此外视网膜还出现Bruch膜结构及厚度均欠规整,部分出现中断,内皮细胞长入等变化。光镜下不但观察到模型组视网膜内、外核层细胞数量显著减少(t=-9.77,P<0.05),RPE细胞呈现萎缩状态,还可见血管样组织由脉络膜层向内长入,破坏Bruch膜结构,经免疫荧光检测该区域内与血管生长密切相关的因子VEGF、CD31呈阳性表达,提示病变向中晚期进展。
本研究选择AMD发病的高危因素:衰老、吸烟以及持续可见光暴露建立动物模型,实验动物不但出现类似于玻璃膜疣的视网膜下沉积物,还可观察到Bruch膜破坏,血管样结构由脉络膜向内长入等更类似于临床晚期AMD的病理特征。实验动物选择遗传背景清晰的近交系小鼠,个体差异小,模型建立过程操作难度适中,可重复性高,为进一步研究AMD发病、预防及治疗提供了较好的研究工具。本次研究未发现突破RPE层的典型脉络膜新生血管组织,可能与观察时间较短有关,在今后的研究中延长造模时间,同时增加脉络膜铺片等观察方法进一步明确CNV的生长和发展。
