尿毒症大鼠肠道屏障功能紊乱与微炎症的关系
2019-12-31梁珊珊薛瑾虹孙凌霜魏丽敏蒋红利
魏 萌 梁珊珊 王 萌 刘 华 薛瑾虹 孙凌霜 魏丽敏 蒋红利
研究表明终末期肾病(ESRD)患者普遍处于微炎症状态,可能是其心脑血管疾病发生的主要原因[1-2],且与营养不良、动脉粥样硬化、贫血及高死亡率存在密切的关系[3]。微炎症状态原因包括尿毒症毒素的刺激、氧化应激损伤、透析膜生物相容性差、透析用水不纯、透析器复用、血管通路各接口的感染及内瘘口感染等[4]。本课题组在国际上首先提出了尿毒症肠道菌群失调、肠道菌群移位可能参与尿毒症微炎症状态发生及发展的观点[5-6]。尿毒症肠道屏障功能状态、肠道细菌移位与微炎症状态的关系及机制值得不断探索。
材料与方法
实验分组及动物模型取雄性SPF级SD 大鼠45 只,体重为150±10g,由西安交通大学医学院动物中心提供。编号法随机分为假手术对照组(n=20)及尿毒症组(n=25)。采用5/6肾切除法制备尿毒症动物模型,假手术组仅打开肾包膜。假手术组、尿毒症组在第6、8、10周末采集全血,随后进入示踪菌实验。
应用绿色荧光蛋白(GFP)标记的示踪菌检测肠道细菌移位
建立示踪菌方法 按照说明书方法制备感受态细胞,加入用于转化的质粒pGFPuv Vector(大连TaKaRa公司)4ng转化大肠杆菌,取2 ml大肠杆菌菌液,应用天根质粒小提试剂盒提取质粒。根据质粒pGEFP酶切位点选择限制性内切酶EcoRⅠ及 HindⅢ行双酶切,对双酶切后的DNA片段1.2%琼脂糖凝胶电泳检测其片段长度是否符合预期。经双酶切电泳后质粒生成2条DNA链,分别为770 bp和2 560 bp。证实此示踪菌可用于后续实验。
示踪菌灌胃动物 比浊法调整示踪菌浓度至2×108Cfu/ml。灌胃前动物禁食24h,不禁水。大鼠每只灌胃示踪菌菌液1 ml。灌胃后2h 给予10%水合氯醛0.3 ml/100g体重麻醉动物,取外周血、肝脏、脾脏、肠系膜淋巴结,立即置于液氮冷冻并转移至-80℃冰箱中保存。
提取血液及肠外组织总DNA 肝、脾、肠系膜淋巴结、血液中基因组DNA的提取采用Qiagen公司DNeasy blood& tissue kit试剂盒,提取操作严格按说明书进行。
组织示踪菌检测 根据质粒pGFPuv中GFP基因序列设计特异性引物:Forward primer:C ̄T ̄C ̄T ̄T ̄A ̄T ̄G ̄G ̄T ̄G ̄T ̄T ̄C ̄A ̄A ̄T ̄G ̄C ̄T ̄T ̄T ̄T ̄C ̄C; Reverse primer:C ̄G ̄T ̄C ̄T ̄T ̄G ̄T ̄A ̄G ̄T ̄T ̄C ̄C ̄C ̄G ̄T ̄C ̄A ̄T ̄C ̄T ̄T,扩增片段:143 bp。扩增条件:预热94℃,5 min;变性94℃,1 min;退火56℃,30s;延伸72℃,1 min ;35个循环,终末延伸72℃ 5 min。结果观察:2%琼脂糖凝胶电泳检测扩增结果,质粒DNA扩增产物作为阳性对照。成功扩增出GFP产物条带代表示踪菌移位至该样品中。
肠道组织病理学将肠道组织标本按常规脱水、透明、包埋,石蜡切片。按组别进行苏木素-伊红染色(HE 染色)。
透射电镜观察肠上皮细胞紧密连接超微结构用PBS充分漂洗切取的回肠组织,充分洗净肠内容物,将肠组织快速置于3%的冷戊二醛溶液中,固定2h,取出后置于1%锇酸中固定 1h,再经丙酮梯度脱水,环氧丙烷置换,Epon-812 树脂包埋,超薄切片机切片,醋酸铀-柠檬酸铅双重电子染色,透射电镜观察。
免疫组织化学染色观察取回肠组织,中性甲醛固定,经乙醇脱水、二甲苯透明后行石蜡包埋、切片、脱蜡、置水后经3% H2O2浸泡消除内源性过氧化物酶,微波修复,分别滴加50 μl JAM-1、claudin-1和Occludin(美国abcam公司)一抗,室温过夜,滴加二抗,室温孵育30 min,DAB 显色,常规脱水透明、封片; 每张切片随机选6 个视野,利用KS400 图像分析系统进行阳性率分析比较。
血清炎症介质检测示踪菌灌胃前、灌胃后分别收集大鼠血清。免疫比浊法测定血浆超敏C 反应蛋白(hs-CRP)(西安交通大学医院第一附属医院检验科)。 ELISA法检测检测白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α),严格按照试剂盒说明书进行。
统计学方法所有实验数据均采用《SPSS 19.0》统计软件分析。实验数据用均数±标准差表示。连续变量组间比较采用student’st检验分析。P<0.05为差异有统计学意义。
结 果
模型建立情况术后两组大鼠伤口无出血和感染。尿毒症组大鼠逐渐表现出活动减少、对外界刺激反应迟钝,喜拱背蜷缩。食物摄入减少,体重增长缓慢。毛色枯黄,疏松不齐,眼、耳、尾渐苍白。假手术组活动灵活,毛色、眼、耳及尾部均无异常变化,食量随体重增长不断增加,尿量无异常改变。
术后7天尿毒症组大鼠出现蛋白尿,尿素氮、肌酐水平逐渐升高,术后第10周,尿毒症组大鼠共有21只存活且肌酐水平达到尿毒症诊断标准,随机取20只进入后续实验。假手术组20只大鼠全部存活。尿毒症组大鼠体重、红细胞压积均显著低于假手术组(P<0.05),尿毒症组大鼠尿量有减少趋势,但与假手术组无统计学差异(表1)。
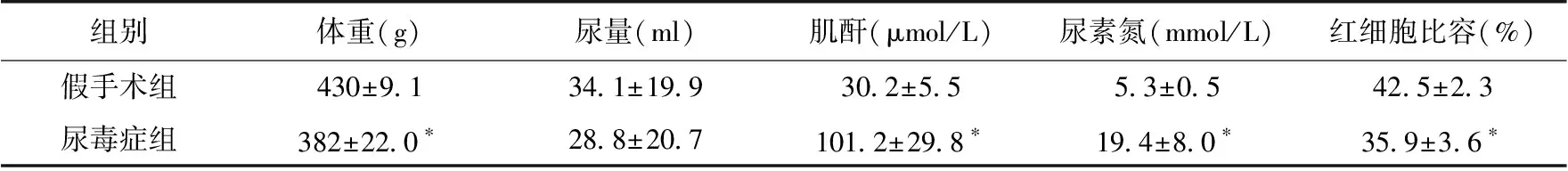
表1 尿毒症组与假手术组生物学参数
*:与假手术组比较,P<0.05
肠道组织病理学改变尿毒症组空肠、回肠明显可见肠绒毛萎缩、倒塌,黏膜层大量炎性细胞浸润,吸收细胞减少;结肠亦见炎性细胞浸润,但与假手术组差异较小。假手术组大鼠各肠段肠绒毛结构清晰饱满,几乎无炎性细胞浸润。绒毛部上皮见大量吸收细胞(图1)。
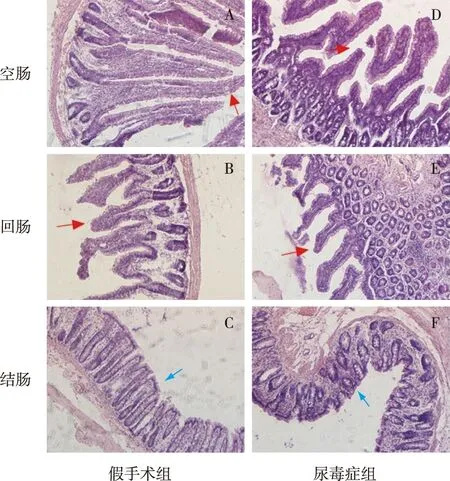
图1 两组大鼠肠道病理图(HE染色,×100)红色箭头示微绒毛结构;蓝色箭头示炎症细胞
肠道细菌移位尿毒症组中70%的实验对象可在肠系膜淋巴结、肝脏、脾脏、血液等一个或多个组织中检测到示踪菌GFP片段(图2);假手术组中细菌移位发生率为10%。尿毒症组细菌移位(BT)发生率显著高于假手术组(P<0.01,χ2= 15)。尿毒症组肠外器官检出BT的百分比:淋巴结>肝脏>脾脏>外周血。假手术组10%个体(2例)肠系膜淋巴结中检出示踪菌(表2)。

图2 尿毒症组不同组织中DNA扩增GFP基因片段电泳图M:DNA分子量标准;N:阴性对照;P:阳性对照;B1、M1、L1和S1分别为动物NO.1血液、肠系膜淋巴结、肝脏和脾脏;B2、M2、L2、S2分别示动物NO.2血液、肠系膜淋巴结、肝脏、脾脏;依次类推

组别(n=20)检出BT总个体数淋巴结检出BT肝脏检出BT脾脏检出BT血液检出BT假手术组2 (10)2 (10)000尿毒症组14 (70)∗14 (70)7 (35)6 (30)5 (25)
BT:细菌移位;MLNs:淋巴结;*:与假手术组比较,P<0.01
肠上皮细胞紧密连接超微结构假手术组肠上皮细胞间的紧密连接结构完整、连接致密;胞膜表面绒毛整齐、走形规则。尿毒症组肠上皮细胞间紧密连接结构不完整,部分断裂,连接疏松、电子密度降低;胞膜表面绒毛走形紊乱,部分上皮细胞绒毛断裂、消失(图3)。
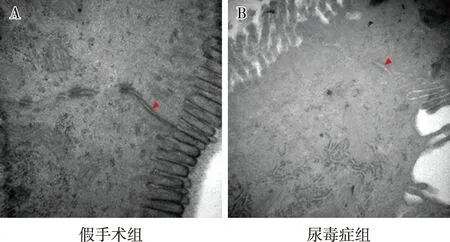
图3 两组大鼠肠上皮细胞间紧密连接超微结构(×50 000) A:表示假手术组;B:表示尿毒症组;红色箭头示紧密连接超微结构
肠道免疫组化假手术组肠黏膜表面紧密连接蛋白 Occludin、claudin-1 和JAM-1棕色颗粒较多,黏膜表面和隐窝均有紧密连接蛋白Occludin、claudin-1 和JAM-1分布;尿毒症组肠上皮细胞间紧密连接蛋白Occludin、claudin-1 和JAM-1表达下降,棕色颗粒明显减少,且从黏膜表面向隐窝部位移位(图4)。
血清炎症介质尿毒症组血清IL-6、TNF-α和hs-CRP水平较假手术组显著增高(P<0.05)。尿毒症组和假手术组,在灌胃示踪菌前、后,组内IL-6、TNF-α、hs-CRP水平均无统计学差异(图5)。

图4 两组大鼠回肠Occludin、claudin-1、JAM-1表达(IH,×400)红色箭头示相应蛋白染色呈棕色颗粒
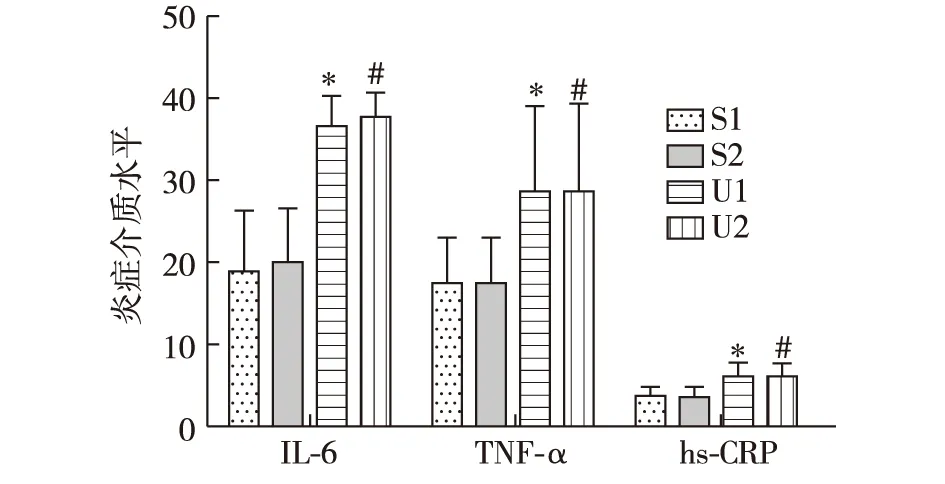
图5 尿毒症及假手术组大鼠灌胃示踪菌前后血清炎症介质IL-6、TNF-α、hs-CRP水平*:与假手术组(灌胃后)比较,P<0.05;#:与假手术组(灌胃前)比较,P<0.05;S1:假手术组(示踪菌灌胃前);S2:假手术组(示踪菌灌胃后);U1:尿毒症组(示踪菌灌胃前);U2:尿毒症组(示踪菌灌胃后)
讨 论
肠道是分隔肠腔中微生物和机体内环境的重要壁垒,数量巨大的微生物系统与机体内环境通过肠道屏障发生相互接触作用。微生物与肠道相互作用的结果是或为肠道所隔绝而局限于肠腔,或穿透上皮细胞层而被肠道免疫细胞消化杀灭,另有极少数细菌可作用于肠道组织或全身循环而导致多种炎症性疾病[7-8]。尿毒症时肠黏膜屏障功能决定了机体与微生物相互关系的最终走向,因此本研究通过探讨肠道细菌移位评估尿毒症肠黏膜屏障功能状态,并进一步探讨肠道屏障功能障碍与微炎症状态关系。
肠道屏障包含机械屏障、生物屏障、化学屏障、免疫屏障等多重含义。肠道细菌移位是评价肠道屏障功能的直接方法。细菌移位的概念由Berg于1979年提出,其定义为胃肠道的活细菌或其产物出现在胃肠以外的位置,如肠系膜淋巴结、肝、脾、肾脏及血液[9]。本研究通过尿毒症大鼠灌胃GFP标记示踪菌的方法,在肠外器官(肠系膜淋巴结、肝脏、脾脏、外周血)中成功扩增了特有的GFP基因片段,证实尿毒症肠道细菌移位,该方法具有敏感、直观、简便等的优点。尿毒症大鼠血液中炎症介质升高,结合细菌移位的情况分析,肠道屏障功能障碍使得肠腔中大量的细菌、内毒素可突破肠黏膜上皮细胞层,与黏膜下免疫细胞相互作用,刺激肠道免疫反应,亦能被肠道中免疫细胞吞噬并随之移位入血循环,可能是导致机体微炎症状态的重要原因之一。
肠上皮紧密连接在维持肠黏膜通透性和完整性方面起着重要作用,是构成肠道机械屏障的重要组成部分。本研究经透射电镜技术观察到尿毒症大鼠肠道上皮细胞间连接复合体结构异常,其中紧密连接、黏附连接结构模糊。并且发现尿毒症大鼠回肠组织中紧密连接复合体中Occludin,Claudin-1,JMA-1蛋白表达降低,本研究结果与Vaziri等应用分子生物学方法检测慢性肾衰竭大鼠胃及肠道组织中上皮细胞间紧密连接复合体中Occludin,Claudin-1,ZO-1蛋白表达水平上降低[10-11]相一致,而我们的研究从超微结构上对Vaziri 等试验结果进行了有益补充,也为后续实验研究提供基础的形态学信息。我们推测尿毒症肠道菌群移位可能有以下几个原因:(1)尿毒症时结肠转运时间延长,且患者饮食差异,使肠道菌群失调,需氧菌、兼性厌氧菌大量繁殖,具备了肠道细菌移位先决条件;(2)尿毒症时肠道中含有尿毒酶基因的肠道细菌明显增多。这些细菌在尿素酶作用下使尿素水解,其大量碱性产物能够改变肠道内化学环境[12],影响了肠道的化学屏障;(3)尿毒症时肠组织多有水肿、局部坏死,超微结构观察示肠上皮细胞间紧密连接结构模糊、在蛋白水平亦呈现下降,即肠道机械屏障破坏;(4)尿毒症时除机体整体免疫功能下降外,在肠道组织中亦表现为局部免疫功能的紊乱,尤其是肠道固有层中巨噬细胞由(抑炎型)M2型向(促炎型)M1型分化,这些巨噬细胞可携带吞噬的肠道细菌进入血循环或远隔脏器。
本研究尿毒症大鼠肠系膜淋巴结中发现细菌的比例(14/20)明显高于血液(5/20)、肝(7/20)、脾(6/20)的比例,这提示:(1)细菌移位发生在淋巴循环和血循环中,肠道细菌可通过肠壁上的毛细血管进入血循环的肝门静脉、再进入其他脏器和组织的血循环,也可以通过肠系膜淋巴结进入淋巴循环[13]、再回流到上腔静脉中,但优先途径可能是淋巴途径;(2)细菌在移位过程中,由于免疫组织和器官中巨噬细胞的免疫捕获作用,使细菌在移位过程中被淋巴结、脾脏等组织器官的巨噬细胞吞噬、溶解,而无法进入远隔部位的淋巴和血循环。肠系膜淋巴结相对于其他组织和器官离肠道最近,细菌移位最容易发生;有的大鼠仅在肝脏、脾脏、血液中一个或两个器官中发现细菌,这也说明了机体各个系统对细菌移位的抑制作用。
本研究假手术组大鼠中有2例肠系膜淋巴结中也发现细菌,该结果与其他研究中发现的正常对照组肠系膜淋巴结也能检测移位肠道菌的结论相一致[14]。分析原因:极少量正常个体中肠道菌群也可能会出现短暂波动变化。当肠道黏膜屏障受到损害、肠道血流量下降、宿主免疫功能下降等情况发生时,在正常个体也会发生肠道菌群移位,但细菌在移位过程中迅速被宿主免疫器官捕获,不会在组织器官中长期存在,更不会对正常人造成影响[15],所以对照组虽然有2例肠系膜淋巴结中出现细菌,但在血、肝、脾中均未检测到细菌。
综上所述,本研究较全面的评价尿毒症肠道屏障功能,尿毒症大鼠存在肠黏膜屏障功能障碍,肠道细菌可移位进入远隔脏器及血液循环并激活炎症反应,是微炎症状态的发生机制之一。机体免疫细胞与移位的肠道菌群具体的作用机制及部位仍需要深入研究。
