Ⅲ型高脂蛋白血症肾脏损害的临床病理特征
——附3例报告并文献复习
2019-12-31钟永忠曾彩虹
钟永忠 朱 莹 曾彩虹
Ⅲ型高脂蛋白血症是一类少见的脂代谢异常性疾病,表现为三酰甘油和胆固醇水平明显升高,掌纹黄瘤以及早发心血管疾病。近年来对脂类代谢相关肾脏损害如脂蛋白肾病(LPG)关注较多,对Ⅲ型高脂蛋白血症肾损害少有报道。本文收集3例Ⅲ型高脂蛋白血症肾损害,并结合文献报道的病例分析其临床、病理特点,探讨Ⅲ型高脂蛋白血症肾损害的诊断和鉴别诊断要点,以提高临床及病理医师对本病的认识。
对象和方法
观察对象收集2010年1月至2015年3月在东部战区总医院国家肾脏疾病临床医学研究中心住院,结合肾活检病理结果以及临床脂质代谢异常类型,排除其他继发性因素,最终诊断为Ⅲ型高脂蛋白血症合并肾损害的3例患者。
方法汇总3例患者的临床资料,肾组织标本均行光镜、免疫病理及电镜检查。肾活检组织采用石蜡包埋、切片,行HE、PAS、PASM-Masson及Masson三色染色;冰冻切片行免疫荧光IgG、IgA、IgM、C3、C1q、ApoA、ApoB、ApoE、CD68染色。
结 果
一般情况3例患者入院时的实验室检查及其他临床资料见表1。3例患者均否认遗传和家族性疾病史。
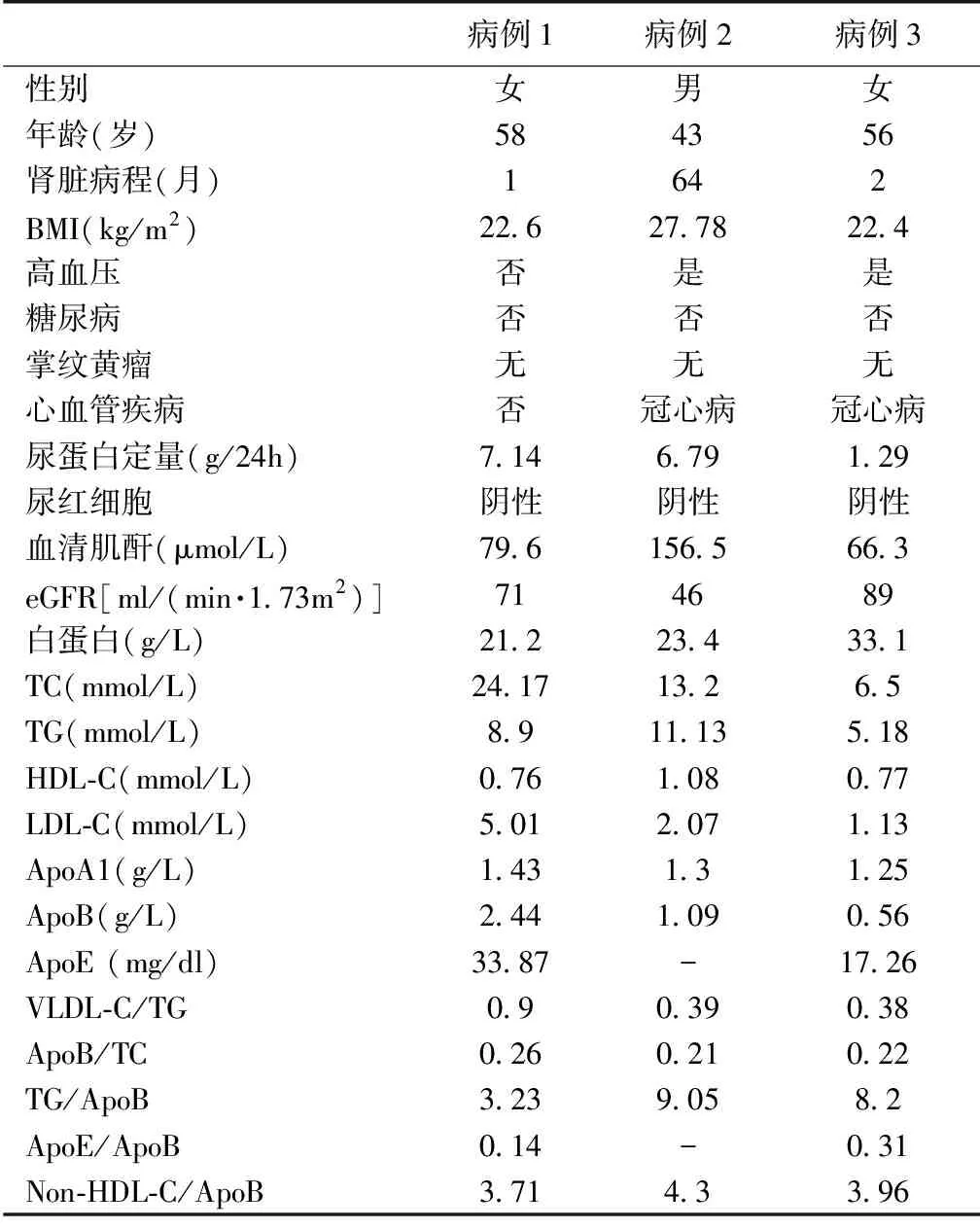
表1 3例患者的临床特点
BMI:体质量指数;eGFR:估算的肾小球滤过率;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;ApoA1:载脂蛋白A1;ApoB:载脂蛋白B;ApoE:载脂蛋白E;VLDL-C:极低密度脂蛋白胆固醇
例1 女,58岁,因“双下肢水肿1月余”入院,既往甲状腺功能减退病史1月余,否认高血压、糖尿病、冠心病病史。 血压116/86 mmHg,体质量指数(BMI) 22.6 kg/m2。尿蛋白定量 7.14 g/24h,血清白蛋白(Alb)21.2 g/L, 尿素氮(BUN)29.2 mg/dl,血清肌酐(SCr)79.6 μmol/L,尿酸(UA)424 μmol/L,总胆固醇(TC)24.17~31.23 mmol/L,三酰甘油(TG)8.90~13.29 mmol/L,高密度脂蛋白胆固醇(HDL-C)0.76 mmol/L,低密度脂蛋白胆固醇(LDL-C)5.01 mmol/L,载脂蛋白E(ApoE)33.87 mg/dl, 脂蛋白(a)Lp(a) 1 797 mg/dl,葡萄糖(Glu)6.24 mmol/L。自身抗体阴性,补体正常。游离T3(FT3)3.31 pmol/L,游离T4(FT4) 88.80 nmol/L, 促甲状腺激素(TSH)2.50 mI U/L。心电图正常。ApoE基因型检测:ApoE2/E2。
例2 男,43岁,因“眼睑及双下肢水肿5年,发现血肌酐升高1周”入院,既往高血压病史5年余,冠心病1月余,否认糖尿病病史。血压122/90 mmHg,BMI 27.78 Kg/m2。尿蛋白定量 6.79 g/24h,Hb 155 g/L,Alb 23.4 g/L,BUN 29.1 mg/dl,SCr 156.5 μmol/L,UA 452 μmol/L,TG 10.79 ~11.13 mmol/L,TC 13.20~22.86 mmol/L,HDL-C 1.08 mmol/L,LDL-C 2.07 mmol/L, Glu 4.45 mmol/L,自身抗体阴性,肿瘤指标,补体正常。心电图:左心室肥厚。
例3 女,54岁,因“发现泡沫尿2月”入院,既往高血压病史半年,冠心病病史2月余,否认糖尿病病史。血压165/100 mmHg,BMI 22.4 kg/m2。尿蛋白定量1.29 g/24h,Hb 130 g/L,Alb 33.1 g/L, BUN 5.14 mmol/L,SCr 66.3 μmol/L,TC 6.50 mmol/L,TG 5.18 mmol/L, HDL-C 0.77 mmol/L,LDL-C 1.13 mmol/L,ApoE 17.26 mg/dl,Lp(a)266 mg/dl,Glu 5.3 mmol/L。抗核抗体谱阴性,体液免疫及补体系列正常。心电图:ST-T改变。
病理特点
光镜 3例患者肾活检取材均良好,肾小球数目25~49个,均存在球性废弃,例2和例3同时存在节段硬化,余肾小球体积增大,肾小球系膜细胞轻到中度增生,系膜基质增多,肾小球毛细血管袢内可见散在较大直径泡沫细胞,充满袢腔,导致毛细血管袢开放欠佳,部分系膜区可见泡沫细胞,肾小管急慢性病变较少见,肾间质中未发现泡沫细胞。例3个别袢呈链条样改变,例2和例3有不同程度的小动脉透明变性,弹力层增厚、分层。
免疫荧光 冰冻切片荧光染色IgG、IgA、C1q均阴性,例2和例3有IgM及C3的非特异性沉积,同时例1和例3泡沫细胞CD68 染色阳性(例2未做),例1的ApoA、ApoB、ApoE均为阴性(例2和例3未做)。
电镜 可见不同程度的足细胞足突融合(例1>90%,例2>90%,例3 50%~60%),电镜下可见毛细血管袢内泡沫细胞,泡沫细胞胞质内见脂性空泡及嗜锇性物质分布,部分肾小球系膜区及基膜内亦可见,部分基膜呈空泡化。3例患者的肾脏病理改变特点见表2和图1。
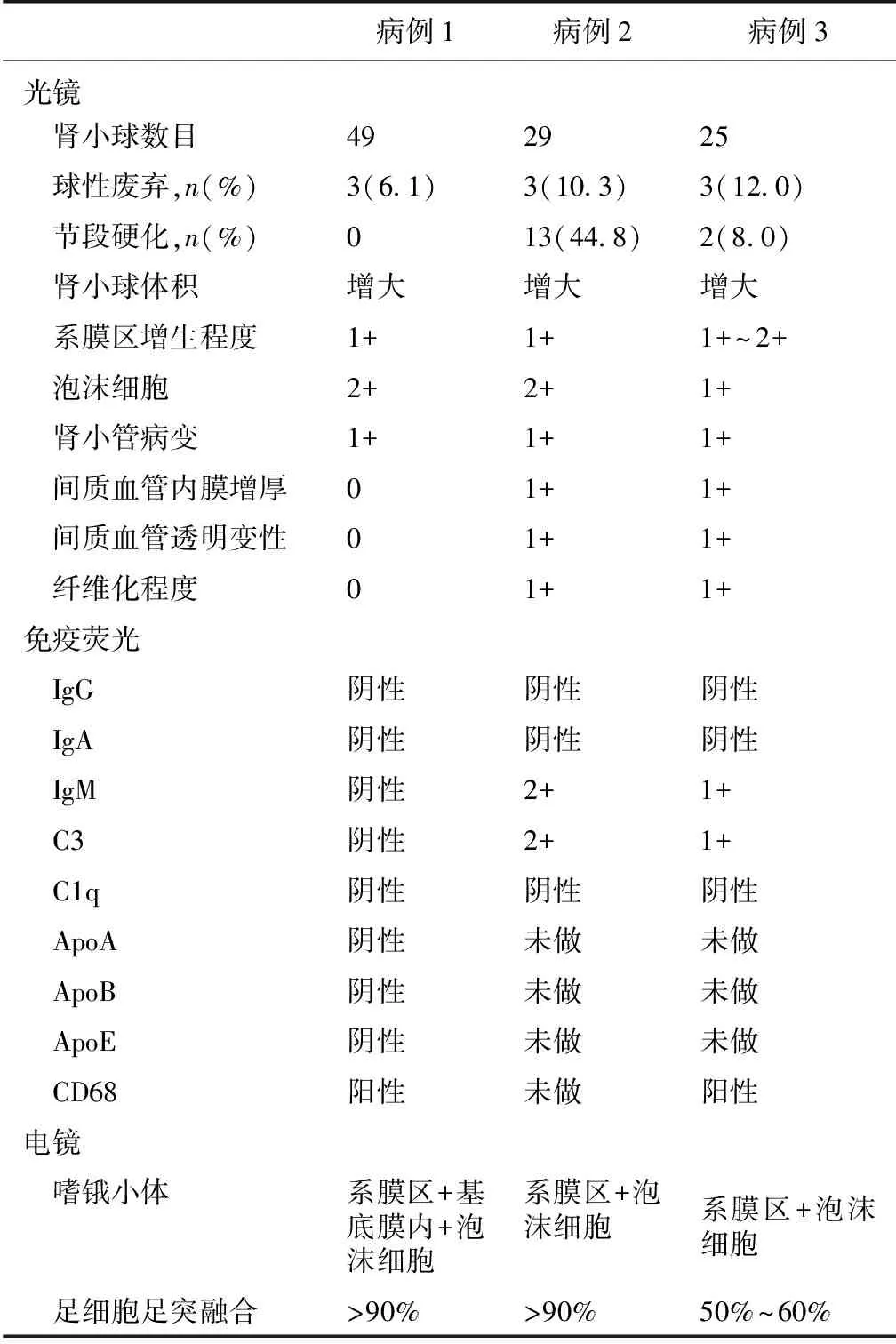
表2 3例患者的病理特点
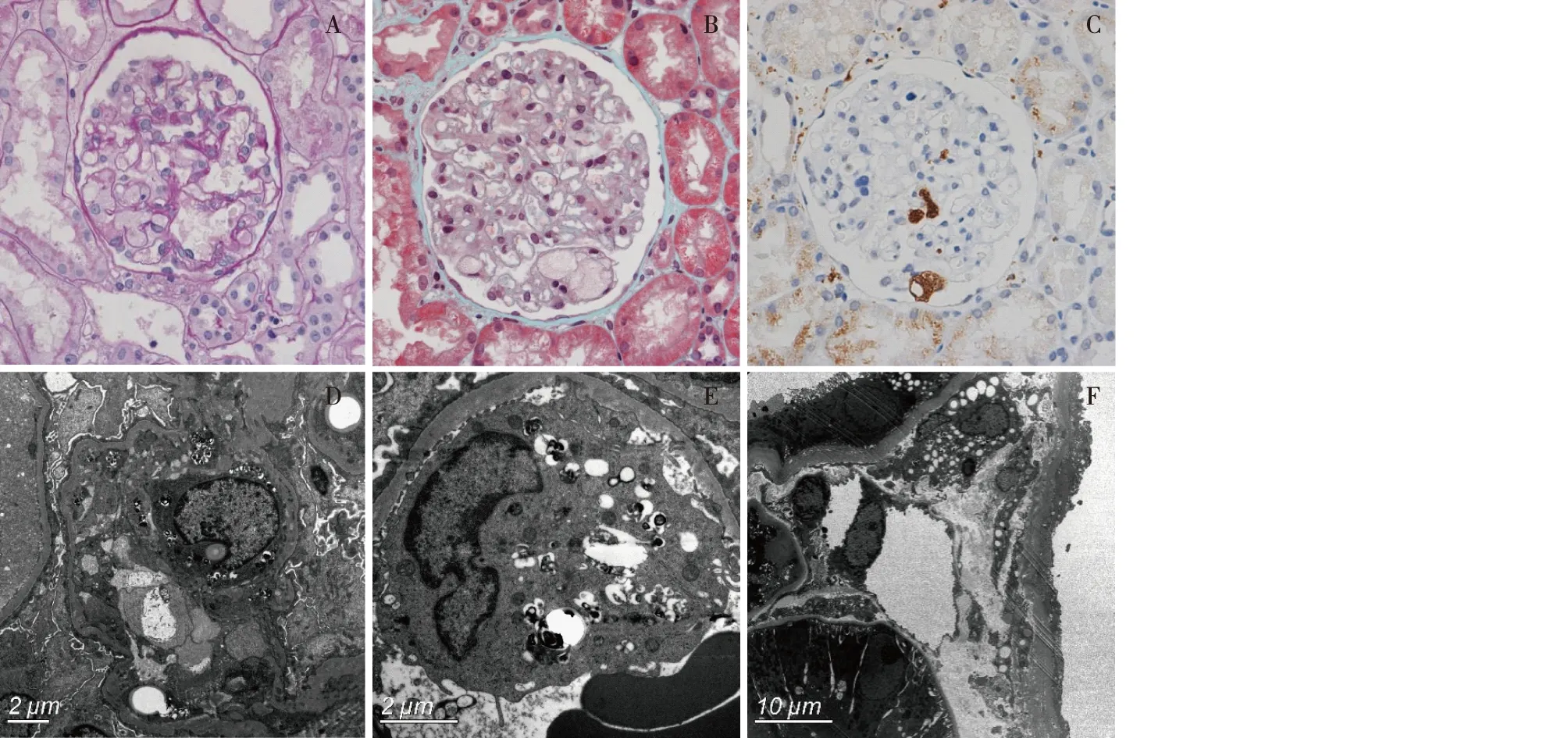
图1 例1患者肾穿刺活检病理改变A、B:肾小球系膜区及袢内见较多泡沫细胞(A:PAS,×400;B:Masson三色,×400);C:泡沫细胞CD68染色阳性(IH,×400);D:肾小球系膜及内皮细胞见脂性空泡与嗜锇小体(EM);E:肾小球毛细血管袢内见吞噬较多脂质的巨噬细胞(EM);F:肾间质毛细血管周围见含有脂性空泡及嗜锇小体的巨噬细胞(EM)
小结结合病理特点以及临床资料分析最后诊断为Ⅲ型高脂蛋白血症合并肾脏损害。
治疗及随访例1以瑞舒伐他汀联合依折麦布降脂治疗,患者随访1年后SCr逐渐升至152.0 μmol/L,此后未随诊。例2以缬沙坦以及福辛普利控制血压减少蛋白尿,氟伐他汀降脂治疗,SCr进行性升高,3年后进入终末期肾病(ESRD)行维持性血液透析治疗。例3使用缬沙坦控制血压减少蛋白尿,非诺贝特降脂治疗,出院后失随访。
讨 论
Ⅲ型高脂蛋白血症又称异常β脂蛋白血症,是与ApoE相关的脂质代谢异常性疾病,发病率约为0.2‰~1‰[1-2],男性发病率为女性的两倍,但绝经期后女性的发病率与男性发病率相当[3],临床特征为TG和TC明显升高,掌纹黄瘤以及早发心血管疾病。另一种与ApoE相关的肾脏疾病为LPG较为常见,而Ⅲ型高脂蛋白血症发病率低,临床表现无特异性,易被临床所忽视。本研究中3例患者血脂及ApoE水平均明显升高,VLDL/TG、ApoB/TC、TG/ApoB、ApoE/ApoB、Non-HDL/ApoB等均符合诊断标准[1,4-5],其中1例行ApoE2基因测序为ApoE2/E2纯合子型,符合Ⅲ型高脂蛋白血症的诊断。
ApoE是存在于乳糜颗粒(CM)、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)及部分高密度脂蛋白(HDL)中的糖蛋白,是LDL受体的配体,介导脂类物质代谢。由于ApoE2与LDL受体的亲和力仅为野生型ApoE3的1%~2%[6],不能将血浆中的脂类物质运送至肝脏进行有效代谢,导致血浆中的TG和TC水平异常升高,从而诱发Ⅲ型高脂蛋白血症的发生。但仅1%左右的ApoE2纯合子出现Ⅲ型高脂蛋白血症的表型,说明在ApoE突变的基础上需要继发因素的存在才能表现出血脂异常,比如糖尿病、肥胖、甲状腺功能减退、饮食失衡等。本研究中,例1 入院时存在空腹血糖异常及甲状腺功能异常,例2为超重患者。Eto等[1]观察了16例Ⅲ型高脂蛋白血症患者,12例(75%)存在肥胖,11例(69%)存在糖代谢异常,6例(38%)存在冠心病,但所有患者均未出现掌纹黄瘤。Feussner等[2]对64例(男性35例,女性29例)Ⅲ型高脂蛋白血症患者的临床特征进行分析,发现男性平均发病年龄为49岁,女性为53岁,肥胖患者占72%,42%患者存在掌纹黄瘤,39%患者存在动脉硬化,糖尿病患者占14%,同时有4例(6.2%)合并肾脏疾病。Brewer等[7]综合了4篇较大的研究文献,共纳入患者115例(表3),发现男性的中位发病年龄较女性早10岁,有学者认为雌激素通过增加肝脏中识别ApoE的受体数目或亲和力,来促进富含TG的脂蛋白(如VLDL)代谢,能够使女性患者的表现延迟。
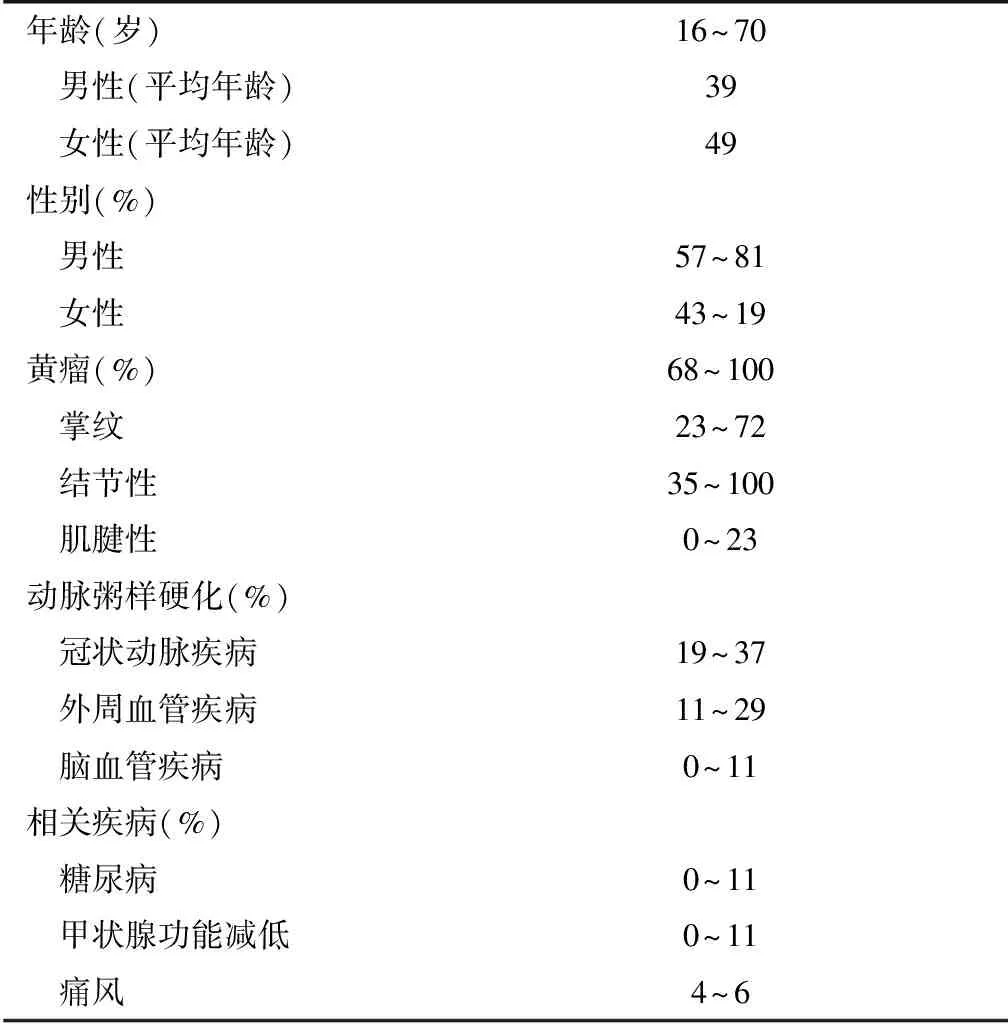
表3 115例Ⅲ型高脂蛋白血症诊断时的临床特点
动物模型证实高脂蛋白血症具有促进肾小球硬化及肾小管间质损伤的作用[8-9],ApoE2基因同时是肾脏疾病易感基因[10-11]。但目前有关Ⅲ型高脂血症合并肾脏损害的报道很少[12-16],一方面是由于Ⅲ型高脂蛋白血症合并肾脏损害的发病率低,约为1.5/百万[15],另一方面是由于叠加肾病本身引起的脂类代谢异常(通常为Ⅳ高脂蛋白血症)后造成Ⅲ型高脂蛋白血症的诊断更加困难。Ⅲ型高脂蛋白血症肾损害除Ⅲ型高脂蛋白血症原发病的表现外,肾脏损害早期表现以蛋白尿为主,甚至肾病综合征范围的蛋白尿,血尿少见,后期由于蛋白尿、代谢因素、心血管早发等因素加重肾病的进展,出现肾功能异常。肾脏病理改变主要为肾小球体积增大,可见节段性硬化性改变,系膜区和扩张的血管袢内可见成簇较大的泡沫细胞,泡沫细胞可充满整个袢腔,引起袢腔闭塞,脂类物质沉积在基膜可出现链条状改变,肾间质偶可见泡沫细胞散在分布。CD68染色阳性提示泡沫细胞来源于巨噬细胞,油红“O”染色阳性。免疫荧光常规染色一般为阴性,或为IgM、C3等非特异性沉积,泡沫细胞ApoA、ApoB、ApoE染色一般为阴性。电镜下泡沫细胞内可见脂性空泡,部分空泡内可见层状的嗜锇小体,肾小球系膜区、内皮细胞偶见类似病变,脂类物质沉积于基膜内引起基膜增厚,足细胞足突融合较广泛。
Ⅲ型高脂蛋白血症导致的肾脏损害需要与LPG相鉴别。两者均为ApoE异常引起的疾病,但LPG肾小管毛细血管袢腔内主要是脂蛋白栓子,而Ⅲ型高脂蛋白血症合并肾损害系膜区或毛细血管袢内主要为泡沫细胞[17]。但亦有合并存在两种病理性损害的报道[18-19]。与LPG中脂蛋白栓子ApoB、ApoE染色阳性不同,Ⅲ型高脂蛋白血症载脂蛋白染色一般为阴性。Ⅲ型高脂蛋白血症与LPG的主要不同点见表4。Ⅲ型高脂蛋白血症的肾脏病变还需与其他一些脂类代谢异常性疾病相鉴别,比如卵磷脂胆固醇脂酰基转移酶缺乏肾损害,高雪病,尼曼匹克病等[20]。由于Ⅲ型高脂蛋白血症患者常合并存在其他代谢性因素,如糖尿病及肥胖,肥胖相关性肾病一般为非肾病综合征范围的蛋白尿,且血白蛋白下降不明显,肾穿刺活检病理改变可见肾小球体积增大,部分可出现门周型局灶节段性肾小球硬化,电镜下足细胞足突融合程度较轻;糖尿病肾病如出现大量蛋白尿,肾小球病变可出现结节状改变(K-W结节),入球小动脉透明变性以及球囊滴较为常见,这些疾病的临床及病理特点有助于鉴别诊断。

表4 脂蛋白肾病与Ⅲ型高脂蛋白血症的鉴别
由于Ⅲ型高脂蛋白血症肾损害治疗以控制原发病为主,积极的降脂治疗,同时积极控制合并症,如糖尿病、肥胖和甲状腺功能减退等代谢异常性疾病。应予低脂饮食、控制体重,经饮食控制后血脂仍不达标者予药物降脂治疗,比如贝特类以及烟酸被认为治疗效果较理想[7,21-22]。对于药物强化降脂治疗后血脂仍下降不明显者,可使用含有硫酸葡聚糖纤维素柱的血浆吸附术,可结合血浆中的LDL, VLDL及IDL,显著降低血脂[14]。依那普利除可降低蛋白尿的作用,还可降低胆固醇、LDL和Lp(a)水平,可作为降压的首选药物。小剂量的阿司匹林可减少Ⅲ型高脂蛋白血症早发心血管事件的发生。研究显示,降脂治疗可显著减少肾小球中泡沫细胞的数量,缓解蛋白尿。综合以上阐述的个案报道分析,Ⅲ型高脂蛋白血症合并肾损害患者临床预后欠佳,本研究中,3例患者均经过强化降脂治疗。例1肾功能进行性下降;例2随访3年,最后进入ESRD,行肾脏替代治疗;例3出院后失随访。
总之,Ⅲ型高脂蛋白血症主要表现为TG和TC的异常升高,脂类物质在肾脏沉积可造成肾脏损害,肾脏病理改变主要为系膜区和肾小球毛细血管袢内大量的泡沫细胞浸润,治疗以控制血脂和代谢紊乱为主。
