足细胞靶向治疗激素抵抗性肾病综合征
2019-12-31程金波综述赵景宏审校
程金波 综述 赵景宏 审校
约90%的初发肾病综合征患者在足量激素治疗后会在1年内缓解,表现为激素敏感性肾病综合征(steriod- sensitive nephrotic syndrome,SSNS),然而有60%~70%患者会频繁复发(frequently-relapsing nephrotic syndrome,FRNS)或表现为激素依赖(steroid-depended nephrotic syndrome,SDNS),最终约20%患者成为激素抵抗型肾病综合征(steriod-resistant nephrotic syndrome,SRNS,含部分初治患者就表现为激素抵抗)[1]。尽管肾活检肾脏病理结果是指导激素及其他免疫抑制剂的“金标准”,然而因肾病综合征病因及发病机制的复杂性及异质性,单纯依靠肾脏病理分型,对肾病综合征的预后判定及指导精准治疗,越来越力不从心。研究表明,12%~15%患者对基于肾病理分型指导下的免疫抑制剂治疗无效,最终表现为SRNS,其中50%的患者会在10年进展为终末期肾病(ESRD)[2]。
自从Tryggvason团队1998首次证实足细胞相关NPSH1基因异常与SRNS发病相关以来,目前已有约70个与足细胞发育、结构及代谢相关的基因被证实可能与SRNS发病有关,足细胞损伤在肾病综合征发病的重要性日益受到重视[3]。因此对足细胞基因异常及相关损伤机制的进一步研究,不但有助于更新对肾病综合征发病机制的认识,也有助危险分层及预后判定,同时也能为寻找更有效的治疗手段提供重要裨益。
肾病综合征与足细胞损伤相关的基因
过去二十年,越来越多的研究表明,与足细胞结构及功能有关的细胞信号通路和分子机制不但在肾病综合征的发病中起重要作用,同时也决定患者对治疗的反应与预后[4]。
对于足细胞损伤在肾病综合征发病的认识开始于对编码裂孔膜结构蛋白Nephrin基因NPHS1及Podcin基因NPHS2的研究,目前与SRNS相关的基因突变大部分与足细胞独特的结构蛋白复合体和信号途径有关[5],其中包括:(1)足细胞裂孔膜蛋白结构与功能相关,如NPHS1、 NPHS2、 PLCE1、 CD2AP、TRPC6、CRB2F及AT1等;(2)足细胞核蛋白及转录因子相关,如WT1、 LAMX1B、 SMARCL1、 NUP93、 NUP107、 NUP205、 XPO5、E2F3、 NXF5、 PAX2、 LAMNA及WDR73等;(3)足细胞肌动蛋白及细胞骨架蛋白相关,如ACTN4、MYH9、 INF2、 MYOIE、 MAGI、 ANLN、ARHGAP24、 ARHGDIA、 KANK1/2/4、 SYNPO、 PTPRO、EMP2、 APOL1、 CUBN 及 PODXL等;(4)线粒体辅酶Q合成蛋白相关,如COQ2、 COQ6、PDSS2、 ADCK4及 MTTL1等;(5)溶酶体相关蛋白,如SCARB2 及d OCRL1等;(6)基膜基质粘附功能相关,如LAMB2、 ITGB4、 ITGA3及 COL4A 3/4/5等。上述的蛋白除LAMB2主要表达于基底膜外,其他均定位于足细胞(表1)。
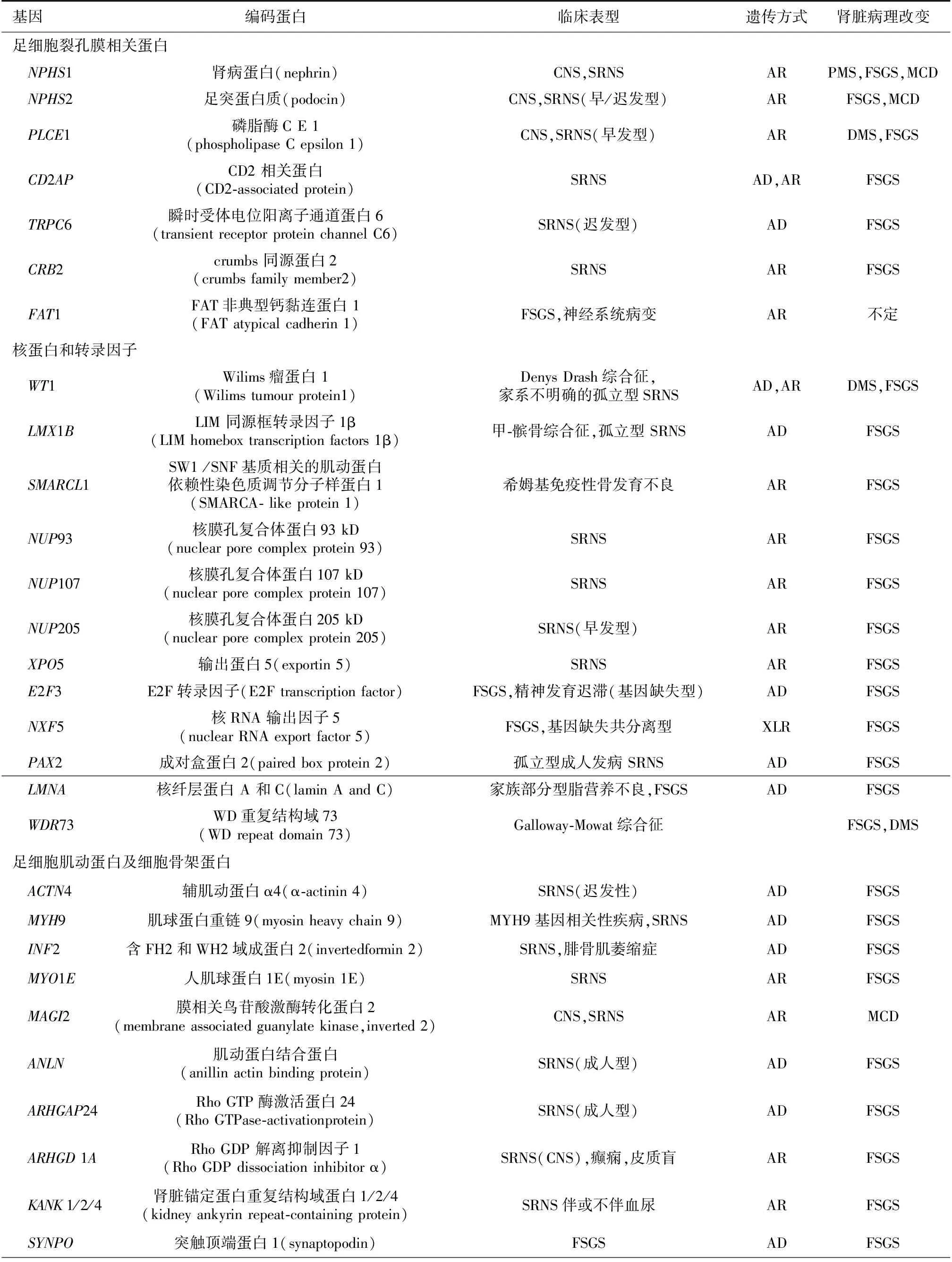
表1 目前发现与激素抵抗性肾病综合征相关足细胞基因列表[6]
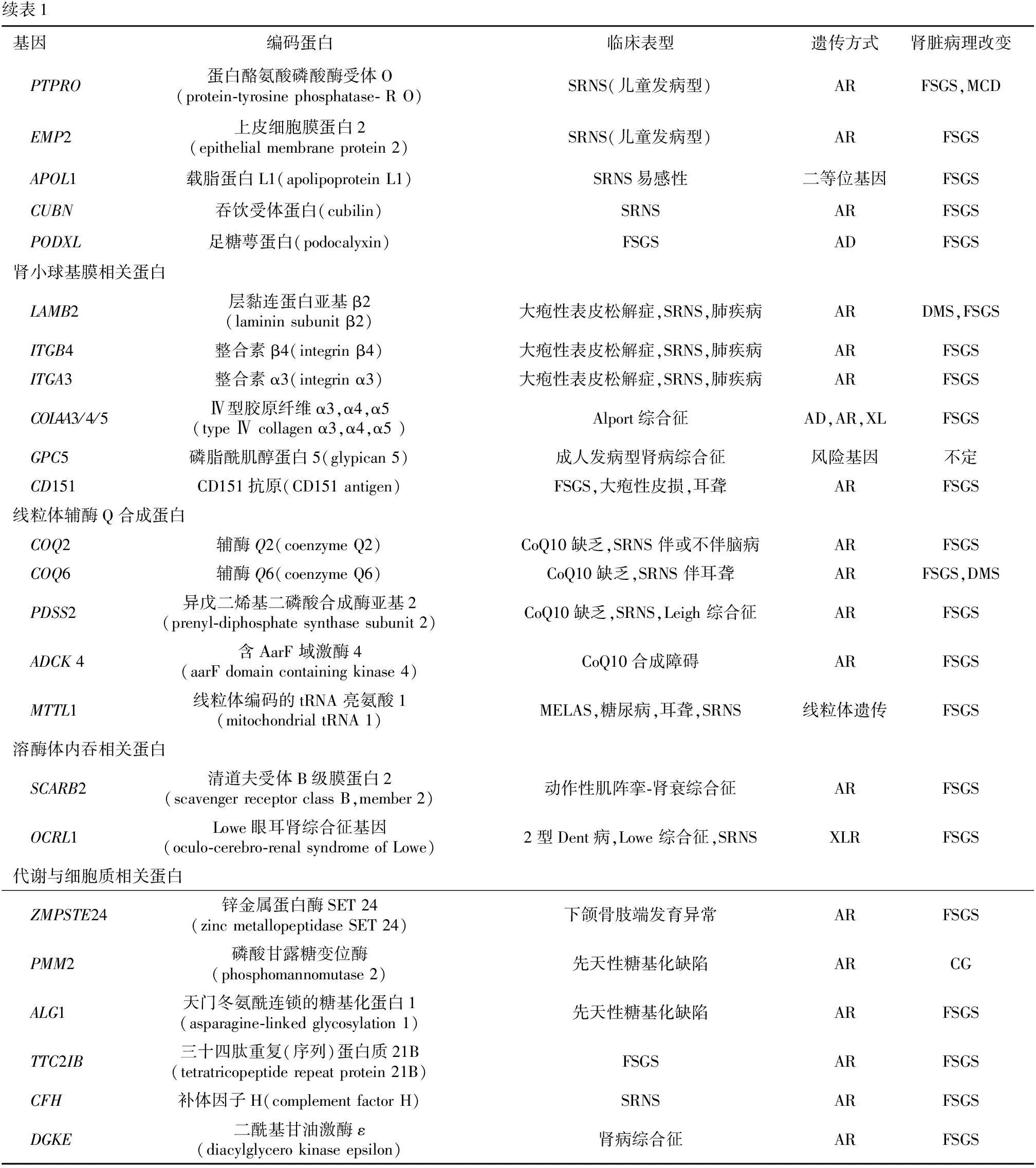
续表1基因编码蛋白临床表型遗传方式肾脏病理改变 PTPRO蛋白酪氨酸磷酸酶受体O(protein-tyrosine phosphatase- R O)SRNS(儿童发病型)ARFSGS,MCD EMP2上皮细胞膜蛋白2(epithelial membrane protein 2)SRNS(儿童发病型)ARFSGS APOL1载脂蛋白L1(apolipoprotein L1)SRNS易感性二等位基因FSGS CUBN吞饮受体蛋白(cubilin)SRNSARFSGS PODXL足糖萼蛋白(podocalyxin)FSGSADFSGS肾小球基膜相关蛋白 LAMB2层黏连蛋白亚基β2(laminin subunit β2)大疱性表皮松解症,SRNS,肺疾病ARDMS,FSGS ITGB4整合素β4(integrin β4)大疱性表皮松解症,SRNS,肺疾病ARFSGS ITGA3整合素α3(integrin α3)大疱性表皮松解症,SRNS,肺疾病ARFSGS COL4A3/4/5Ⅳ型胶原纤维α3,α4,α5(type Ⅳ collagen α3,α4,α5 )Alport综合征AD,AR,XLFSGS GPC5磷脂酰肌醇蛋白5(glypican 5)成人发病型肾病综合征风险基因 不定 CD151CD151抗原(CD151 antigen)FSGS,大疱性皮损,耳聋ARFSGS线粒体辅酶Q合成蛋白 COQ2辅酶Q2(coenzyme Q2)CoQ10缺乏,SRNS 伴或不伴脑病ARFSGS COQ6辅酶Q6(coenzyme Q6)CoQ10缺乏,SRNS 伴耳聋ARFSGS,DMS PDSS2异戊二烯基二磷酸合成酶亚基2(prenyl-diphosphate synthase subunit 2)CoQ10缺乏,SRNS,Leigh 综合征ARFSGS ADCK 4含ΑarF 域激酶4(aarF domain containing kinase 4)CoQ10合成障碍ARFSGS MTTL1线粒体编码的tRNA 亮氨酸1(mitochondrial tRNA 1)MELAS,糖尿病,耳聋,SRNS线粒体遗传FSGS溶酶体内吞相关蛋白 SCARB2清道夫受体B级膜蛋白2(scavenger receptor class B,member 2)动作性肌阵挛-肾衰综合征ARFSGS OCRL1Lowe眼耳肾综合征基因(oculo-cerebro-renal syndrome of Lowe)2型Dent病,Lowe 综合征,SRNSXLRFSGS代谢与细胞质相关蛋白 ZMPSTE24锌金属蛋白酶SET 24(zinc metallopeptidase SET 24)下颌骨肢端发育异常ARFSGS PMM2磷酸甘露糖变位酶(phosphomannomutase 2)先天性糖基化缺陷ARCG ALG1天门冬氨酰连锁的糖基化蛋白1(asparagine-linked glycosylation 1)先天性糖基化缺陷ARFSGS TTC2IB三十四肽重复(序列)蛋白质21B(tetratricopeptide repeat protein 21B)FSGSARFSGS CFH补体因子H(complement factor H)SRNSARFSGS DGKE二酰基甘油激酶ε(diacylglycero kinase epsilon)肾病综合征ARFSGS
AD:常染色体显性遗传; AR:常染色体隐性遗传; CG: 塌陷型肾小球病变; CNS: 先天性肾病综合征; DMS:弥漫系膜硬化;FSGS: 局灶节段性肾小球硬化; MCD:微小病变; PMS:进展型系膜硬化;MELAS:线粒体脑肌病、乳酸酸中毒及卒中样发作综合征:PTRD: 近端肾小管扩张症; SRNS: 激素抵抗性肾病综合征; XL: X性染色体连锁遗传
研究表明,25岁前发病的SRNS患者中,已知致病基因检出率为29.5%,并与疾病的发病年龄呈明显负相关。如在新生儿先天性肾病综合征患者(<3个月)中,其致病基因的检出率可高达69.4%,4~12个月的患儿中致病基因检出率为49.7%,而13~18岁青少年肾病综合征患者中只有12%的可检测出致病基因突变。因此,对于发病年龄<25岁,表现为先天性、幼儿型(发病年龄>3个月,≤12个月)以及青少年型肾病综合征的患者,或肾病综合征患者合并肾外症状和(或)家族史,应尽快行基因筛查[7]。不同于儿童肾病综合征和家族性FSGS患者,散发性SRNS患者,尽管发病的影响因素较多,其基因检测阳性率约30%左右,其中与遗传相关者,疾病严重程度更高,对激素治疗反应差及快速进展至ESRD[8]。
与SRNS的发病机制不同,目前倾向于将SSNS的发病机制归因于免疫机制异常,一项利用全外显子测序技术(WES)的研究表明,定位于6 号染色体的主要组织相容性复合物MHC基因的HLA-DOQ1可作为SSNS的同位易感性基因。同样与SRSN不同,迄今为止仅有EMP2基因突变被认为与SSNS发病有关,该项研究再次表明继发性免疫可能在SSNS发病中扮演重要角色[9]。最近一项在17个对激素部分有效的肾病综合征家系中所做的WES结果表明,首次发现MAGI2、 TNS2、 DLCI、 CDK20、 ITSN1和 ITSN2 等6个基因的隐性突变与激素的部分有效有关。上述基因的发现描绘出一条与足细胞调控Rho样小G蛋白酶 (Rho-like small GTPase,RLSG)活性有关的发病途径,表明激素部分有效的肾病综合征可能处于SSNS与SRNS交界区[10]。
鉴于目前,以激素为代表的免疫抑制剂在肾病综合征仍被无区别的应用于SSNS和SRNS患者中,因此发病初期尽快明确肾病综合征基因诊断,将有助于优化治疗方案临床决策。
基因与肾病综合征临床表型
长期以来,肾脏病理一直被作为肾病综合征临床诊断、预后分析及治疗决策的重要依据。但在临床实际中,伴有基因异常的肾病综合征患者临床表现及遗传形式多种多样,即便是携带有同样的致病基因甚或同一位点突变,其临床表现也可大相径庭(表1)。随着临床实践的发展,仅依靠病理学分型而制定的治疗决策案及基于此所做的预后判断,日益显示出不足的一面。
一项来自于PodoNet研究表明:在纳入研究的1 665名SRNS患者中(包括发病年龄≤20岁的少年型肾病综合征、先天性肾病综合征及可能有基因机制参与的持续亚肾病蛋白尿患者),最常见的病理学类型分别是:局灶节段性肾小球硬化(FSGS)约占(56%)、微小病变(MCD)型(21%)、系膜增生型肾小球肾炎(MesPGN)(12%)及弥漫系膜硬化型(DMS)。其中在FSGS、MesPGN及MCD人群里,蛋白尿水平及低血压的发生率接近,NPHS2 (n=138)、 WT1(n=48)和NPHS1(n=41) 等基因突变的检出率最高[11]。在所采用的免疫抑制剂方案中,钙调磷酸酶酶抑制剂(CNIs)和利妥昔单抗的临床应答最好,40%~45%SRNS患者可以完全缓解。该研究也表明早期的病理学分型并不能预测对上述药物在内的免疫抑制剂治疗应答,如MCD的应答率为51%,MesPGN为40.6%,FSGS为39.0%,统计学意义差别并不十分显著。在所有SRNS病理学分型中,FSGS的基因突变检出率为22%,MesPGN为40.6%,MCD为12%,单纯从肾活检结果并不能区别是否合并基因异常;但一些常见的基因突变可能与某些病理学类型有着密切的联系,如弥漫系膜硬化型常可检出WTI及PLCE1,而先天性肾病综合征却与NPHS1密切相关。研究还表明:在携带同样基因变异的SRNS中,FSGS类型患者进入ESRD较MCD高出3成[2]。还有研究显示尽管以环孢素A为代表的CINs可能使某些携带NPSH2和WT1基因SRNS患者受益,但没有基因变异的患者环孢素A的治疗反应要远好于有基因变异的患者[12]。以上研究表明基因诊断对肾病综合征的临床表型及预后转归预测有重要意义,而非传统的肾活检病理分型。
免疫抑制剂的直接足细胞保护效应
目前糖皮质激素依然是初发肾病综合征治疗的首选,然而在面对激素依赖、频繁复发甚或激素抵抗情况时,往往需要启用非激素类免疫抑制剂如细胞毒性药物、吗替麦考酚酯(MMF)类药物、CNIs及CD20单克隆抗体制剂等。在选择应用激素及其他免疫抑制剂时,必须要考虑以下因素来仔细平衡临床获益和潜在风险的关系,包括不同肾病综合征类型发病机制的差异、药物内在药理活性的不同及长期应用的副作用等[13]。
对于SDNS及FRNS患者,上述非激素类免疫抑制剂的应用,对减少复发提高临床缓解率均显示了较好的疗效,然而临床在选择这些药物,应特别关注各自的毒副作用[14]。新近一项关于在SDNS的平行随机对照开放性临床研究表明,利妥昔单抗在维持临床缓解、减少激素相关副作用及肾毒性方面要优于他克莫司[15]。但对于SRNS患者而言,非激素类免疫抑制剂的疗效大相径庭。PodoNet的研究结果显示[11],基于CNIs的治疗方案要远胜于激素冲击、环磷酰胺及MMF等药物,这些药物在85%的SRNS患者中作为初始治疗无效;如果SRNS显示对CNIs治疗抵抗,那意味着包含激素冲击、环磷酰胺及MMF等药物也将无效,然而B细胞清除剂如利妥昔单抗却可在此类患者诱导仍达44%完全缓解及约15%的部分缓解[16]。
有足细胞基因异常机制参与的SRNS患者,通常会对常用免疫抑制剂方案缺乏反应或疗效不佳。然而不断有个案报告或回顾性临床研究显示,某些基因突变的患者会对基于CNIs如环孢素A的方案有效,可表现为部分缓解或完全缓解。这些基因包括 WT1、NPHS1、NPHS2、PLCE 1和TRPC6[17],还包括RHO样GTP小蛋白调控子相关的ARHGDIA,KANK1,KANK2 和 KANK3等基因突变[18]。但对于大多数的与足细胞基因突变的SRNS患者而言,对环孢素A治疗仍然无效。
近年来的基础研究表明,某些免疫抑制剂具有不依赖于免疫药理的,直接通过足细胞稳定效应,达到抗肾小球蛋白尿的作用。如环孢素A不但可以直接作用于足细胞,通过通过减少激活钙调磷酸酶所需的细胞钙内流,阻断钙调磷酸酶介导的突触足蛋白(synaptopodin)去磷酸化来稳定肌动蛋白(actin)细胞骨架,还可通过抑制激活的T细胞核因子途径(NATF),起到保护足细胞、修足细胞损伤的作用[19]。作为B细胞清除剂的利妥昔单抗,可直接与足细胞结合,通过与足细胞表达的鞘磷脂磷酸二酯酶酸样3b蛋白(sphingomyelin phosphodiesterase acid-like 3bprotein,SMPDL-3b)相互作用,起到稳定足细胞骨架,防止足细胞凋亡的作用,表现出不依赖于其抗B细胞CD20单抗的作用[20]。而糖皮质激素,可通过血清或(和)糖皮质激素调控的激酶来提高nephrin 的磷酸化,来减少足细胞凋亡,增加足细胞前体细胞数量,并通过调控环磷酸鸟苷(cGMP)的产生来防止足细胞迁移及肌动蛋白(actin)分解[21]。另外,糖皮质激素还可通过修复Bcl-2表达和减少P53水平来减少嘌呤霉素处理的足细胞凋亡。上述效应也可用来阐述糖皮质激素不依赖其通过作用于基因组而发挥抗炎及免疫抑制活性。另外,左旋咪唑也可通过增加足细胞表达的糖皮质激素受体水平及糖皮质激素受体信号途径的活性,来发挥直接的足细胞保护效应[22]。目前尚无环磷酰胺及MMF类药物的对于足细胞直接作用的报道。
因此,不同免疫抑制剂对足细胞直接作用内在活性的不同,可能在一定程度解释他们对于不同类型肾病综合征的疗效差异,基于此将有助于临床合理选择免疫抑制剂方案。
特殊基因突变与非免疫抑制剂足细胞靶向治疗
足细胞富含线粒体,对能量供应要求较高,任何原因造成的与能量代谢相关的氧化磷酸化障碍,都将导致过量的活性氧产物(ROS)的产生,引发足细胞的结构及功能异常,并导致肾小球滤过屏障受损,导致蛋白尿及肾小球硬化。因此由COQ2、 COQ6、 ADCK4及PDSS2等基因突变所致线粒体疾病而使辅酶Q10合成缺乏而引起的SRNS,可通过人为补充而达到治疗目前[23]。不断有病例报告证实:由COQ2,COQ6 和ADCK4等与CoQ10合成相关基因突变所致SRNS患者,可以通过补充CoQ10可达到临床缓解。目前尚无明确推荐剂量,但临床实践中按30~50 mg/(kg·d)的初始剂量是安全的,绝大多数患者对更大剂量耐受性也非常良好[24]。这类患者如能早期识别,尽早补充CoQ10将可能逆转或缓解肾脏或肾外神经系统病变。其他研究表明如果能明确肾病综合征的发生与吞饮受体蛋白(CUBN)基因缺陷有关,补充维生素B12将有效;如患者被确认存在ARHGDA基因突变,那提示可能会对盐皮质激素受体拮抗剂依普利酮有效[18]。
具有修复足细胞损伤作用的药物
随着对足细胞损伤机制的深入认识,一些具有或兼具足细胞靶向治疗的药物逐步被发现或重新认识。目前认为,半乳糖(galactose)通过与肾小球糖萼蛋白的相互作用,阻止局部硬化渗透因子(FSPF)接触足细胞,从而可保护足细胞免于遭受攻击,表现为足细胞保护效应[25]。在动物实验中,静脉应用半乳糖可显著减少经激素抵抗性型FSGS患者血清处理大鼠模型白蛋白的漏出。在儿童及成年肾病综合征患者的临床观察也证实了其有效性,其中一例为多种免疫抑制剂抵抗并经血浆置换无效的SRNS患者[26]。尽管早期有研究显示半乳糖可以降低儿童SRNS血清FSPS水平,但并没减少患者蛋白尿。但新近的在SRNS患者进行的FONT2临床研究表明,半乳糖可使患者蛋白尿水平下降50%,同时不影响患者eGFR水平。该研究提示半乳糖在包括FSGS在内的SRNS患者早期应用,可能获益更大[27]。
研究表明足细胞所受到的机械牵张力会特异性增加足细胞特异性的Ⅰ型血管紧张素Ⅱ受体(AT1R)的表达,从而导致足细胞足突融合及蛋白漏出,且不依赖于收缩期血压水平改变[28]。因此RAAS拮抗剂通过阻断AT1R,在减轻足细胞损伤及减少尿蛋白的生成起重要作用,其减少蛋白尿的作用往往呈现剂量依赖性。对于SRNS患者而言,早期应用肾素-血管紧张素-醛固酮系统(RAAS)抑制剂可能意义更大,尤其是可能携带多重免疫抑制剂抵抗的基因突变患者。对于此类患者如不联合使用RAAS抑制剂,CNIs可能会治疗无效或不优于单用RAAS抑制剂[2]。一些小样本研究表明不同类型RAAS抑制剂联合应疗效可能大于单用制剂,然而联合应用所带来的潜在风险尤其是高血钾和急性肾损伤不可忽视[29]。进一步而言,在评估任何新兴的治疗方案的有效性时必须要考虑到RAAS抑制剂所提供的背景效应。 最近一项关于内皮素受体及AT1R双重拮抗剂sparsentan的随机、双盲、阳性对照Ⅱ期研究(DUET)结果初步表明:FSGS患者使用sparsentan(≥400 mg/d)治疗8周后蛋白尿下降幅度大于AT1受体单阻断药厄贝沙坦(300 mg/d),且安全性和耐受性较好[30]。但鉴于该研究周期仅为8周,sparsentan对肾功能的长期影响还需进一步研究评估。目前sparsentan即将进入III期临床研究DUPLEX,可以预见,不管来自于DUPLEX的结果如何,都将会对以FSGS为病理学表现的SRNS治疗具有重要意义。
其他兼具有足细胞保护作用的药物还包括促肾上腺皮质激素(ACTH)及拟钙剂。其中ACTH可通黑皮质素Ⅰ型受体直接作用足细胞[31],其在包括MCD、FSGS及系膜增生型肾病综合征患者人群中的有效率为29%~ 100%[32]。拟钙剂如西那卡塞通能过激活钙敏受体改善足细胞的稳定性,在肾病综合征的治疗中具有潜在的应用价值[33]。然而以上这些药物尚需进一步的临床研究验证其在肾病综合征中的疗效。
总结与展望
基因组医学的兴起,不但有望阐明肾病综合征的发病机制,也会为个体化治疗提供基于基因识别基础上的治疗靶点[34]。尽管目前临床上在肾病综合征患者中,尚未达成基因筛查策略或共识,但是在选择基因筛查策略时,必须要将患者的发病年龄、肾外症状、家族史、初发肾功、初始治疗反应甚或肾活检结果等因素纳入综合考虑中。因此对于发病年龄偏小,如儿童肾病综合征和家族性FSGS患者,或肾病综合征患者合并肾外症状和(或)家族史,应尽快行基因筛查;而对于散发型SRNS患者,也应尽可能行基因检测。尽管不断有新的致病基因被确认,通常情况下,也只有少数几个突变基因会被高频率检测出。但所谓的阴性结果亦可能提示有新的基因突变亟待确认,并有可能在将来的治疗方案制定方面提供重要参考意义。将来随着对肾病综合征疾病本质分子机制的进一步认识,有可能会揭示新的发病途径,制定行的诊断分类,更准确做出预后评判,这必将推动了作用相关途径的新药研发,并提供基于足细胞靶向性的个体化治疗(图1)。

图1 基于足细胞靶向的肾病综合征治疗流程图 SSNS:激素敏感性肾病综合征;FRNS: 频繁复发型肾病综合征;SDNS:激素依赖型肾病综合征;SRNS:激素抵抗性肾病综合征;CNIs:钙调磷酸酶酶抑制剂;强化免疫抑制剂治疗:当临床确认口服激素无效后的治疗,包括静脉应用激素(甲泼尼龙冲击治疗)、细胞毒性药物、吗替麦考酚酯类药物、CNIs及CD20单克隆抗体制剂等治疗手段
