胸腺素β4对大鼠皮质神经细胞氧糖剥夺-复氧损伤的保护作用研究
2019-12-31张忠胜刘双凤黄四春
张忠胜 刘双凤 黄四春
脑缺血损伤指由于脑血循环障碍引起的局灶性或全脑缺血和缺氧所致的神经功能缺损[1]。脑缺血时,多种原因使得脑细胞内钙离子超载,造成线粒体损伤,导致三磷酸腺苷生成减少,能量代谢障碍,同时产生大量的自由基可进一步加重脑组织损害,导致细胞死亡[2]。胸腺素β4最初从胸腺中分离纯化获得,在体内广泛分布,是胸腺肽家族成员之一[3]。胸腺素β4由43个氨基酸残基构成,研究结果表明,胸腺素β4可通过影响血管内皮细胞分化与迁移从而促进血管生成和创伤愈合[4]。在糖尿病大鼠的损伤模型中,使用胸腺素β4治疗后的第4天,血管再生最强[5]。胸腺素β4能增加梗死心肌的微血管密度,促进梗死后微血管形成,提高血管内皮生长因子的表达[6]。胸腺素β4对卒中的保护作用也有报道[7-8],但其潜在作用机制尚未得到证实。因此,本研究采用体外培养大鼠皮质神经细胞,通过氧糖剥夺-复氧法模拟缺血-再灌注损伤,使用外源性胸腺素β4作用于氧糖剥夺-复氧损伤大鼠的皮质神经细胞,旨在研究胸腺素β4对大鼠皮质神经细胞氧糖剥夺-复氧损伤的影响,并评估其作用机制。
1 材料与仪器
1.1 实验动物
健康清洁级新生48 h内SD大鼠乳鼠,雌雄不限,体质量5~7 g,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)(2016-0002)。大鼠生长环境:温度 20~25 ℃,湿度约50%;室内风速控制于0.1~0.2 m/s。光照:12 h照明与12 h黑暗交替。
1.2 实验试剂与仪器
NeurobasalTM培养基(21103049,美国Gibco公司);胎牛血清(26400-036,美国Gibco公司); Hank′s平衡盐溶液(14065-056,美国Gibco公司);磷酸盐缓冲溶液(phosphate buffer saline,PBS,14190136,美国Gibco公司);牛血清白蛋白(A8010-5,美国Solarbio公司);胰蛋白酶(25200072,美国 Gibco公司);Lipofectamine® 3000试剂(美国invitrogen公司,18882752);b-27TM Supplement(50X)(美国Gibco公司 17504044);胸腺素β4(MCE HY-P0029,美国CLOUD-CLONE CORP公司);CCK-8 (cell counting Kit-8)试剂(96992-500TEST,美国Sigma公司);β-神经生长因子(SB 50385-MNAC,美国Gibco公司);L-谷氨酰胺(G0200,北京索莱宝科技有限公司);兔抗神经元特异性烯醇化酶(neuron-specific enolase,NSE)多克隆抗体(bs-10445R,北京博奥森生物技术有限公司);末端脱氧核苷酸转移酶脱氧尿苷三磷酸缺口末端标记法(terminal deoxynucleotidyl transferase deoxyuridine triphosphate nick end labeling,TUNEL)检测试剂盒(C1088,上海碧云天生物技术有限公司);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(annexin V-fluoresceine isothiocyanate/propidum lodide,Annexin V-FITC/PI) 细胞凋亡检测试剂盒(AP101-100-kit,中国MULTI SCIENCES 联科生物);PI(C1062,Beyotime,宁波);Trizon试剂(CW0580S,中国康为世纪生物科技有限公司);UltraSYBR Mixture(CW0957M,中国康为世纪生物科技有限公司);RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司);PVDF膜(IPVH00010, 美国Millipore公司);超敏发光液(RJ239676,美国赛默飞公司);兔多克隆抗胸腺素β4(DF12334,美国Affinity公司);兔多克隆抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78,YT5858,美国ImmunoWay公司);兔多克隆抗CCAAT增强子结合蛋白(CCAAT/enhancer binding prolein,C/EBP)同源蛋白(C/EBP-homologous protein,CHOP,ab179823,英国Abcam公司);兔多克隆抗Bax(ab32503,英国Abcam 公司);鼠单克隆抗B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2,bsm-33047M,北京博奥森生物技术有限公司)。酶标仪(Rayto RT6000,美国Rayto公司);Microplate Reader(Thermo,美国);荧光显微镜(CKX53,日本OLYMPUS公司);流式细胞仪(美国BD公司);NovoCyteTM流式细胞仪[NovoCyte 2060R,艾森生物(杭州)有限公司];蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);超高灵敏度化学发光成像系统[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司];ChemiDoc XRS凝胶成像系统(美国Bio-Rad公司)。
1.3 分离大鼠皮质神经细胞
将出生48 h内的大鼠乳鼠处死,采用75%乙醇消毒后,应用眼科剪剪开大鼠颅骨,眼科镊夹取脑组织置于预先冰浴处理 的Hank′s平衡盐溶液中。剥去皮质表面的脑膜及血管,快速将脑组织移入另一盛有预冷Hank′s平衡盐的培养皿中,将脑组织剪成大小约1 mm3的碎块,加入0.125%胰蛋白酶后,37 ℃水浴振荡消化10~15 min后,吸去胰蛋白酶,采用PBS洗涤2次后,加入配制的培养基(Neurobasal培养基+FBS)+B27 Supplement+β-神经生长因子+ L-谷氨酰胺,吹打成细胞悬液。通过70 μm筛网过滤后,离心(1 000 r/min,离心半径为5 cm,离心5 min),加入上述配制的新鲜培养基重悬细胞悬液,铺板,置于37 ℃、5%CO2培养箱中培养。
1.4 免疫荧光
在培养板中将已爬好细胞的培养皿(培养7 d)用PBS浸洗3次,每次3 min; 用4%多聚甲醛固定15 min,PBS浸洗培养皿3次,每次3 min;0.5%Triton X-100( PBS配制 )室温通透20 min;PBS浸洗培养皿3次,每次5 min,吸干PBS,在培养皿内滴加5%牛血清白蛋白37 ℃封闭30 min。培养皿内滴加稀释好的一抗NSE(1∶200),4 ℃孵育过夜。PBS浸洗培养皿3次,每次3 min,吸干培养皿内多余液体后滴加稀释好的荧光二抗FITC(1∶100),37 ℃孵育30 min,PBS浸洗培养皿3次,每次3 min;滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)避光孵育5 min,对标本进行核染,应用PBS冲洗多余的DAPI;应用50%甘油封闭培养皿,在荧光显微镜下观察并采集图像。
1.5 筛选药物浓度
细胞铺板,选择胸腺素β4浓度分别为0、0.1、1、10、100、1 000、10 000 μg/L 。细胞弃去培养液,PBS冲洗2次,加入胰蛋白酶消化2~3 min,加入含10%胎牛血清的完全培养基,将细胞吹打下来并吸取至10 ml离心管中,离心(转速1 000 r/min,离心半径11 cm,离心时间5 min),弃上清液,加入上述配制的培养液重悬,计数,细胞密度为8 000个/孔。按上述浓度分组,并接种至96孔板中待细胞贴壁后,加药处理48 h,将待测的96孔板细胞换成相同的培养基,每孔100 μl,每孔加入10 μl CCK-8 试剂,置于培养箱中孵育2 h;酶标仪在450 nm波长处检测每孔的吸光度值。
1.6 氧糖剥夺-复氧制作细胞缺血-再灌注模型与实验分组
氧糖剥夺6 h,复氧12 h制作细胞模拟缺血-再灌注损伤模型[9]。取培养7 d的皮质神经细胞,吸去原培养液,清洗后加入无糖 Earle′s液,将细胞培养瓶置于缺氧罐内,向罐内持续通入含有95%N2和5%CO2的混合气体。通气30 min后夹闭缺氧罐的进出口,置于培养箱内密闭6 h,取出缺氧罐,吸去无糖Earle′s液,换回维持培养液,放回37 ℃、5%CO2培养箱中继续培养24 h后进行后续实验。将实验组分为对照组、模型组(氧-糖剥夺6 h,复氧12 h)和治疗组(10 μg/L胸腺素β4)。对照组(含糖Earle′s液)始终在CO2培养箱中培养(37 ℃、5%CO2)。治疗组建模前2 h加入浓度为10 μg/L 的胸腺素β4。
1.7 CCK-8检测细胞活力
当细胞达到70%汇合时,用外源性胸腺素β4处理48 h。48 h后,通过CCK-8测定检测细胞活力[10]。将晶体溶解在二甲基亚砜中,在Microplate Reader上以450 nm的波长测量吸光度。
1.8 流式细胞术检测细胞凋亡
用胰蛋白酶消化后收集细胞。将细胞与annexin V-FITC和PI在黑暗中孵育30 min后,通过流式细胞术检测细胞凋亡,并通过NovoCyteTM流式细胞仪分析数据。
1.9 TUNEL法检测细胞凋亡
将培养皿中培养的细胞用PBS洗涤3次(每次3 min)并在4%多聚甲醛中固定15 min。用PBS洗涤3次后,将细胞与0.5%Triton X-100(PBS制剂)在室温下孵育20 min,PBS浸洗培养皿3次,每次3 min。吸去细胞培养皿中的PBS,加入TUNEL检测液,45 ℃避光孵育2 h。滴加DAPI避光孵育5 min,对标本进行染核,应用PBS冲洗多余的DAPI;应用50%甘油封闭培养皿,在荧光显微镜下观察并采集图像。
1.10 Western blotting测定蛋白表达
从细胞中收集蛋白质用于蛋白质印迹[11]。使用蛋白质分离试剂盒提取蛋白质,并使用二辛可宁酸试验试剂盒定量。将20 μg蛋白质加载到泳道中,通过12%凝胶上的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,并转移至硝酸纤维素膜上。室温下在5%脱脂乳中封闭2 h后,将膜与下列一抗在4 ℃下孵育过夜:兔多克隆抗胸腺素β4、兔多克隆抗GRP78、兔多克隆抗CHOP、兔多克隆抗Bax、鼠单克隆抗Bcl-2。将硝酸纤维素膜洗涤3次,并与辣根过氧化物酶标记的山羊抗兔IgG二抗在4 ℃下孵育2 h。使用增强的化学发光试剂盒显现蛋白质的表达水平,并使用ChemiDoc XRS凝胶成像系统扫描印迹。利用Image J软件进行光密度分析。
1.11 统计学分析
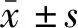
2 结果
2.1 大鼠皮质神经细胞分离及鉴定结果
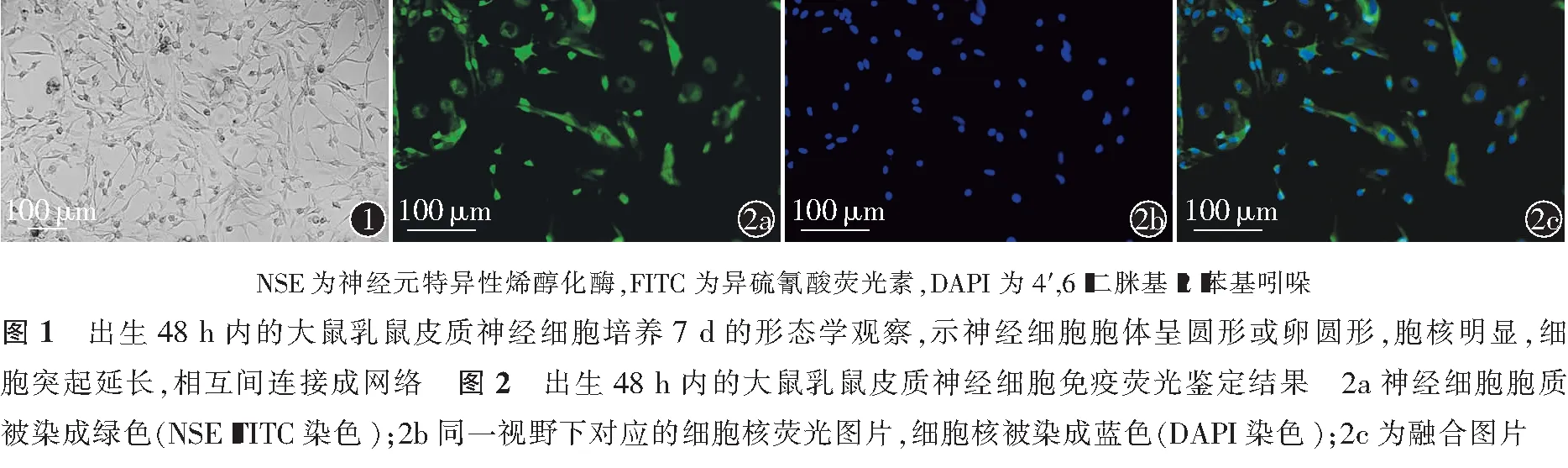
体外培养7 d大鼠皮质神经细胞,分支连接成明显的网络(图1)。皮质神经细胞中可见NSE表达(图2),说明皮质细胞分离正确。
2.2 CCK-8检测不同浓度胸腺素β4亚组细胞活力
如图3所示,与对照组比较,10 μg/L 胸腺素β4组作用的细胞活力明显升高,差异具有统计学意义(P=0.032)。因此选择浓度10 μg/L胸腺素β4进行实验。与对照组比较,模型组细胞存活率显著下降(P=0.002);治疗组(10 μg/L外源性胸腺素β4)细胞活力明显高于模型组(P=0.008),见图4 。
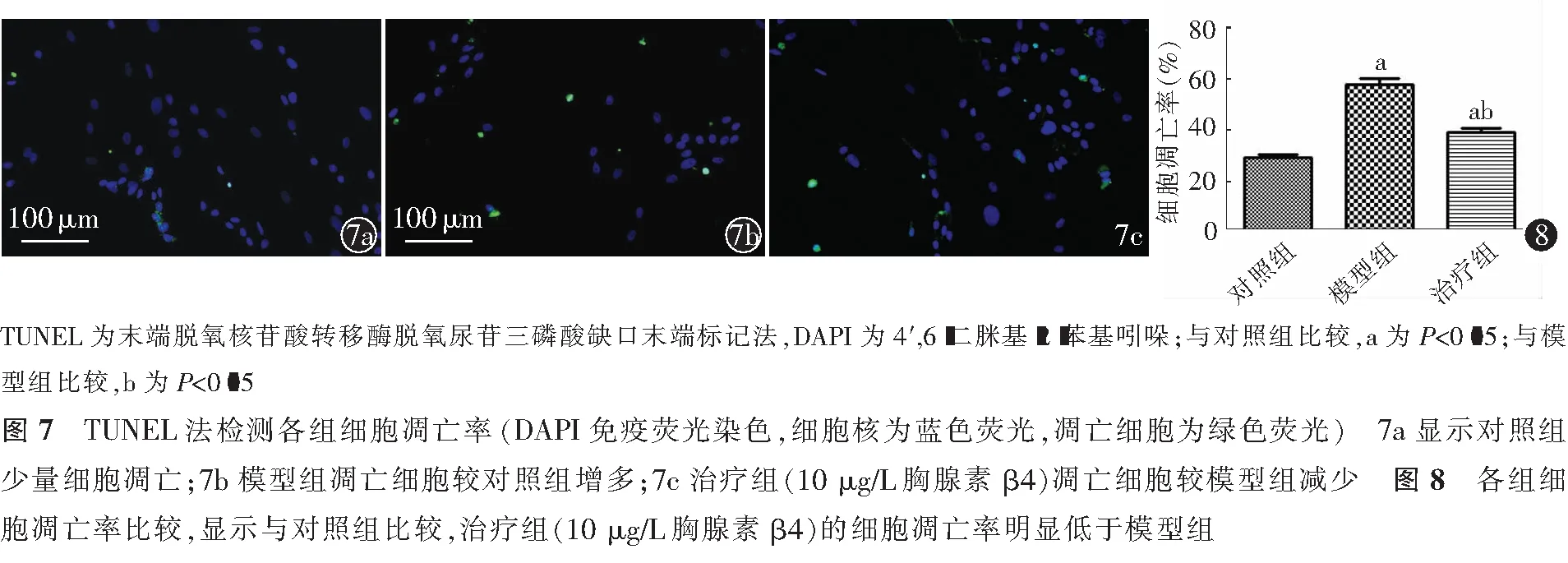
2.3 胸腺素β4抑制氧糖剥夺-复氧法诱导的大鼠皮质神经细胞凋亡
如图5~8所示,模型组细胞凋亡明显高于对照组(P<0.01);与模型组比较,治疗组细胞凋亡率显著降低(P=0.002)。
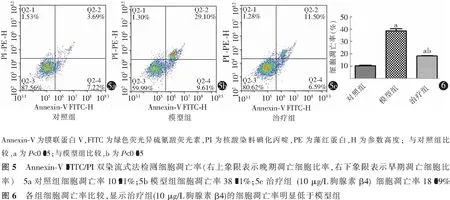

2.4 胸腺素β4改善氧糖剥夺-复氧法诱导的内质网应激相关凋亡蛋白的表达
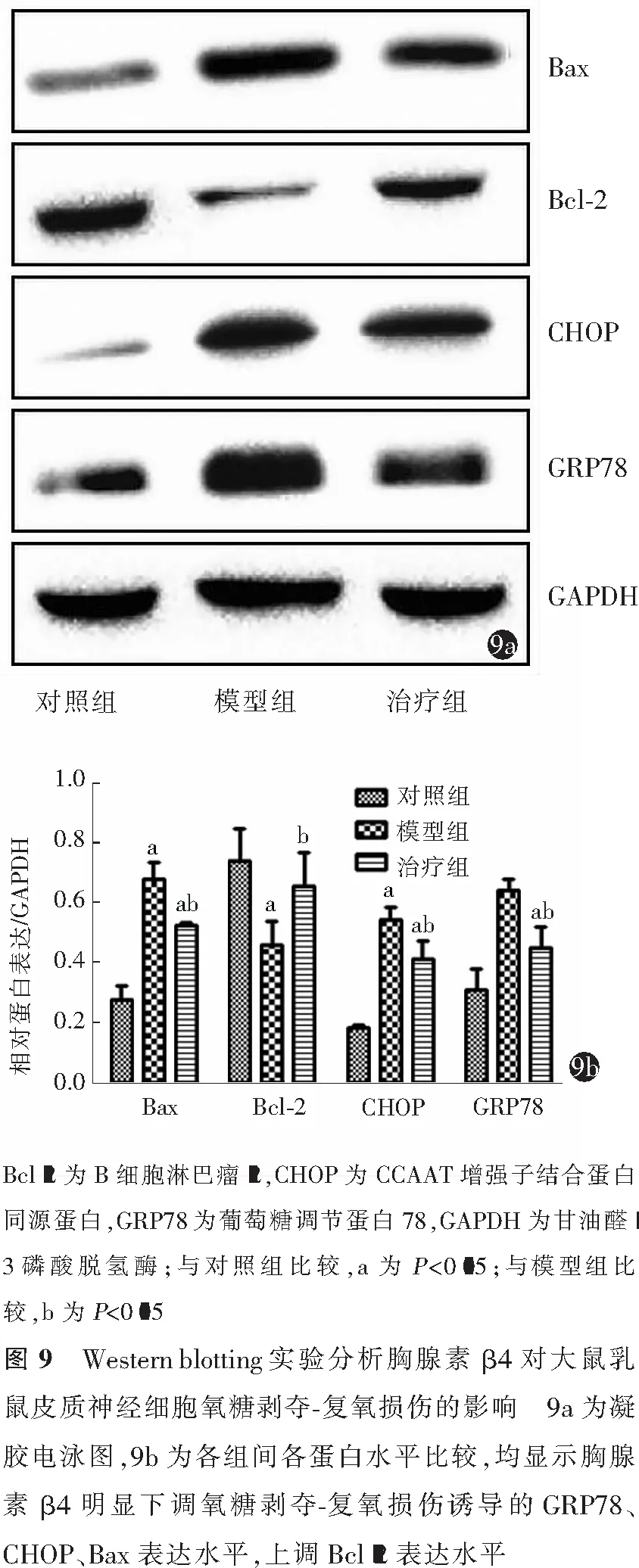
如图9所示,与对照组比较,模型组的GRP78、CHOP、Bax表达明显升高(P值分别为0.034、0、0.045),Bcl-2的表达明显下降(P=0.006);与模型组比较,治疗组的GRP78、CHOP、Bax表达明显下降(P值分别为0.032、0.027、0.019),Bcl-2表达明显升高(P=0.028),差异均有统计学意义。
3 讨论
本研究利用原代分离大鼠皮质神经细胞并体外培养,采用氧糖剥夺-复氧法建立模拟缺血-再灌注模型,利用大鼠皮质神经细胞NSE蛋白,通过免疫荧光法鉴定,结果显示细胞分离成功。胸腺素β4有多种功能,可促进血管再生、神经轴突修复[12]、抑制炎性反应[13],是治疗脑缺血后“血管神经单元”修复和再生的最佳选择之一[14]。有研究表明,心肌梗死后胸腺素β4的表达增高能抑制心肌细胞凋亡,促进心脏功能恢复[15]。局灶性脑缺血和全脑缺血后海马部位均有胸腺素β4 表达增加[16]。向局灶性脑缺血模型的大鼠腹腔注射合成的胸腺素β4多肽后,发现大鼠脑缺血半暗带区的血管密度增加,神经轴突修复增多,大鼠神经功能恢复加快[17]。本研究结果表明,利用外源性胸腺素β4能改善氧糖剥夺-复氧诱导的细胞凋亡,这也与上述结果一致。
细胞凋亡是缺血-再灌注损伤的主要形式之一[18]。Bcl-2家族成员在凋亡过程中扮演着关键作用[19]。Bcl-2是最重要的抗凋亡蛋白,主要位于线粒体外膜、核膜和内质网等部位,在细胞调控中,其可以阻断细胞色素C释放至胞质,抑制下游的凋亡级联反应[20]。而促凋亡蛋白Bax位于细胞质中,其通过与Bcl-2的同源结构域结合形成异源二聚体,阻断Bcl-2活性,促进细胞色素C穿过线粒体膜,导致细胞凋亡[21]。Bcl-2家族通过调节Bcl-2/Bax的平衡来维持线粒体的稳定[22]。因此,抗凋亡Bcl-2和促凋亡Bax的比例对细胞存活起到重要作用。已有研究报道,在脑缺血模型中,Bcl-2表达减少而Bax表达增加[23]。本研究结果表明,大鼠皮质神经细胞体外培养模拟建立缺血-再灌注模型后,Bcl-2表达水平下降,Bax表达水平升高,经胸腺素β4干预后,Bcl-2表达水平升高和Bax表达水平下降,与之前的报道一致。
GRP78属于热休克蛋白70家族的一员,是存在于内质网中最多的伴侣蛋白。在生理情况下,GRP78的表达处于较低的基础水平,其主要功能是参与新生多肽链的折叠、装配和转运;在缺血缺氧、低血糖、氧化应激、钙离子失衡等不利环境应激下,大量多肽链在内质网内变性、积聚,GRP78表达量明显增高[24]。研究表明,在肾脏、脑、视网膜等组织缺血-再灌注的实验过程中,GRP78表达均上调[25]。多项研究结果表明,内质网保护性伴侣蛋白表达的上调可以缓解多种组织的缺血损伤,在小鼠脑、肺、肾、心肌、视网膜缺血模型及人肝细胞癌移植瘤等实验中均发现,缺血可导致GRP78等内质网伴侣蛋白表达显著增加,内质网保护伴侣蛋白表达和活性的上调可以刺激内质网应激,因而缓解了细胞损伤[26-28]。CHOP是一个碱性亮氨酸拉链(b-zip)转录因子,属于CCAAT增强子相连蛋白的转录因子C/EBP 家族[29]。正常情况下,CHOP 表达较低,而在内质网应激时,CHOP表达明显升高,过度表达的CHOP促使细胞周期停滞或凋亡,而CHOP-/-则可保护细胞,避免细胞凋亡[30]。本研究结果表明,模型组GRP78和CHOP的表达水平明显升高,这也与上述结果一致;通过胸腺素β4干预后,GRP78和CHOP的表达水平明显下降,表明胸腺素β4能够改善缺血损伤引起的细胞凋亡。这些结果表明,胸腺素β4可能通过调节内质网对缺血-再灌注损伤的应激反应,从而调节GRP78、CHOP、Bcl-2、Bax等蛋白的表达,并最终改善缺血-再灌注损伤。
综上所述,缺血-再灌注损伤可以引起内质网应激,从而引起GRP78、CHOP、Bax等蛋白表达水平升高,最终诱导调亡的发生,而胸腺素β4能够改善氧糖剥夺-复氧诱导的内质网应激依赖性细胞凋亡。本研究结果为胸腺素β4在脑缺血-再灌注损伤治疗中的应用提供了理论依据。
