不同Mori分型椎动脉颅内段重度狭窄的彩色多普勒血流成像特点和血流动力学参数分析
2019-12-31李秋萍华扬刘佳宾杨洁杜利勇侯伟红
李秋萍 华扬 刘佳宾 杨洁 杜利勇 侯伟红
椎动脉颅内段狭窄是引起后循环缺血的重要原因,且具有较高的卒中复发率[1-2]。国内外关于颅内动脉狭窄支架治疗的随机对照试验或多中心研究表明,颅内动脉支架置入具有相对较高的围术期卒中或死亡风险[3-6],而对术前病变特点进行更详细的影像学评估及针对不同患者选择介入治疗的适应证可以降低严重并发症的发生率[5-6]。1998年Mori等[7]提出,根据狭窄处病变长度、走行角度等结构特征对颅内动脉重度狭窄进行分类,即Mori分型,能够指导介入治疗方式的选择并提高操作成功率。然而,采用超声检查对不同Mori分型的颅内动脉重度狭窄的血流动力学进行客观性评估研究少有报道。本研究拟通过经颅彩色多普勒超声(transcranial color-coded sonography,TCCS)联合颅外段超声检查,按照Mori分型对椎动脉颅内段重度狭窄(intracranial vertebral artery severe stenosis,SIVAS)病变及其颅外段(狭窄近段)的血流动力学参数进行检测分析,以期为临床提供不同Mori分型的超声血流动力学变化信息。
1 对象与方法
1.1 对象
回顾性连续纳入2017年1月至2018年6月于首都医科大学宣武医院神经内科、神经外科住院的症状性单侧SIVAS患者122例,其中男101例,女21例;年龄37~84岁,平均(61±9)岁;既往病史:高血压病95例,糖尿病61例,高血脂57例,吸烟71例;临床表现包括发作性头晕或眩晕症状者72例,肢体无力或麻木或言语不利者49例,视物成双或视物旋转者14例;头部MRI检查诊断为后循环供血区(包括延髓、小脑、桥脑、中脑、丘脑、枕叶、颞叶内侧等)脑梗死患者89例(73.0%);病变侧左侧70例,右侧52例;病变长度3.8~8.7 mm。本研究方案经首都医科大学宣武医院伦理委员会审核批准。
纳入标准:经彩色多普勒血流成像(CDFI)和TCCS联合检测并经CT血管成像(CTA)和(或)DSA检查明确诊断为单侧SIVAS(70%~99%),且病历资料及影像学资料完整。排除标准:(1)非动脉粥样硬化性椎动脉狭窄,如椎动脉夹层、椎动脉瘤、椎动脉狭窄支架术后再狭窄等;(2)锁骨下动脉近段、椎动脉颅外段、基底动脉等存在重度狭窄或闭塞(影响椎动脉血流动力学参数检测结果);(3)患有心力衰竭、恶性肿瘤、颅内动脉瘤、动静脉畸形等疾病;(4)影像学资料不完整,无法完成回顾性测量。
1.2 资料收集
收集所有患者的一般资料,如年龄、性别、高血压病、糖尿病、高血脂、吸烟史等相关脑血管病危险因素,诊断依据中国国家卒中登记研究中使用的方法[8]:高血压病(自述既往高血压病史,或口服降压药,或入院后血压≥140/90 mmHg)、糖尿病(自诉既往糖尿病病史,或口服降糖药或注射胰岛素)、高血脂(自诉既往高血脂病史或口服降脂药)、吸烟史(既往或当前吸烟),并收集临床资料,如患者症状体征及影像学资料等。
1.3 研究方法
1.3.1超声检查仪器和方法:采用美国飞利浦公司IU-Eliter或日立-阿洛卡公司Ascendus型号的 TCCS诊断仪,选择1.0~5.0 MHz纯净波探头,于枕窗探查椎动脉颅内段,探查深度50~85 mm,取样容积2.5~4.0 mm,彩色血流与声束之间的角度<30°,CDFI显示椎动脉与基底动脉呈“Y”字型结构特征,频谱多普勒测量并记录狭窄处收缩期峰值流速(PSV)、舒张期末流速(EDV)、平均流速(mean flow velocity,MFV)及血管搏动指数(PI)。超声对SIVAS的血流参数评估参照本研究小组既往发表的血流动力学标准[9]。符合重度狭窄流速标准:PSV≥190 cm/s;流速升高但未达标准:PSV 110~189 cm/s;流速正常:PSV 40~109 cm/s; 流速减低:PSV<40 cm/s[9]。
椎动脉颅外段超声检查选择3.0~9.0 MHz超宽频线阵探头和4.0~8.0 MHz微凸阵探头,测量并记录V2段(选取走行平直的颈椎3~4、颈椎4~5间隙,即为狭窄前段)的PSV、EDV、血管阻力指数(resistance index,RI)。所有超声检查由5年以上工作经验的血管超声科医师进行,评估方法遵照国家卫生健康委员会脑卒中防治工程委员会发布的《中国脑卒中血管超声检查指导规范》[10],所有患者于超声检查后1周内行CTA或DSA检查。
1.3.2CTA和DSA检查方法:CTA 检查采用德国西门子公司的64排螺旋CT(siemens sensation cardiac 64),采用最大密度投影法(maximum intensity projection,MIP)和容积再现法(volume rendering,VR)图像后处理技术进行血管影像重组。DSA 采用美国GE公司的Advantx-LCN+双C型臂血管造影系统,行主动脉弓及全脑血管造影,常规采集椎动脉正侧位图像。根据Mori等[7]提出的Mori分型标准,将SIVAS分为三型,即A型,病变长度<5 mm,同心或轻度偏心的重度狭窄;B型,病变长度为5~10 mm,极度偏心,中等成角;C型,病变长度>10 mm,极度成角>90°(图1)。病变长度的测量、Mori分型的判断由1名有10年以上工作经验的血管超声科医师和1名放射科医师分别在PACS(Picture Archiving and Communication System)图像系统测量,结果不同的患者再行重复测量并经第3位医师判定。串联病变标准参照文献[11],在本研究中指椎动脉颅内段相邻位置存在一处以上中-重度狭窄(狭窄程度≥50%);极重度狭窄为经DSA或CTA测量狭窄程度达90%~99%。狭窄程度参照症状性颅内动脉疾病华法林-阿司匹林研究(the warfarin-aspirin symptomatic intracranial disease study,WASID)方法计算,即(1-狭窄处内径/正常内径)×100%[12]。
1.4 统计学分析

2 结果
2.1 临床资料比较
122例单侧SIVAS患者中,Mori A型46例,Mori B型55例,Mori C型21例,不同Mori分型患者在年龄、性别、病变侧别以及高血压病、糖尿病、高血脂、吸烟等方面差异均无统计学意义(均P>0.05),后循环供血区脑梗死病变的发生率差异无统计学意义(P=0.347),Mori C型的平均病变长度明显长于Mori B型和Mori A型(均P<0.01),见表1。
2.2 不同Mori分型的SIVAS患者CDFI血流显示差异性
Mori A型和B型SIVAS,彩色多普勒血流主要表现为:狭窄处局部血流充盈不全,血流束变细,呈“五彩相间”血流信号,狭窄近段和远段血流显影相对黯淡(A型由于狭窄段较短,有时仅显示局部“五彩”血流,而未见明显血流束变细,图2a,2b)。Mori C型的CDFI主要表现为:狭窄处血流充盈不全,小部分可见“五彩相间”血流信号,大部分血流信号接近中断或不连续,血流显影较暗(图2c)。所有病变血管中共86.9%(106/122支)表现为狭窄典型的CDFI表现,其余16支表现不典型,其中1支Mori A型血流信号黯淡,3支Mori B型显示为血流信号黯淡、连续性差,12支Mori C型显示为血流信号连续性差或中断。此外,16支表现不典型的病变血管中,7支存在串联病变。
2.3 不同Mori分型的椎动脉颅内外段血流动力学参数比较
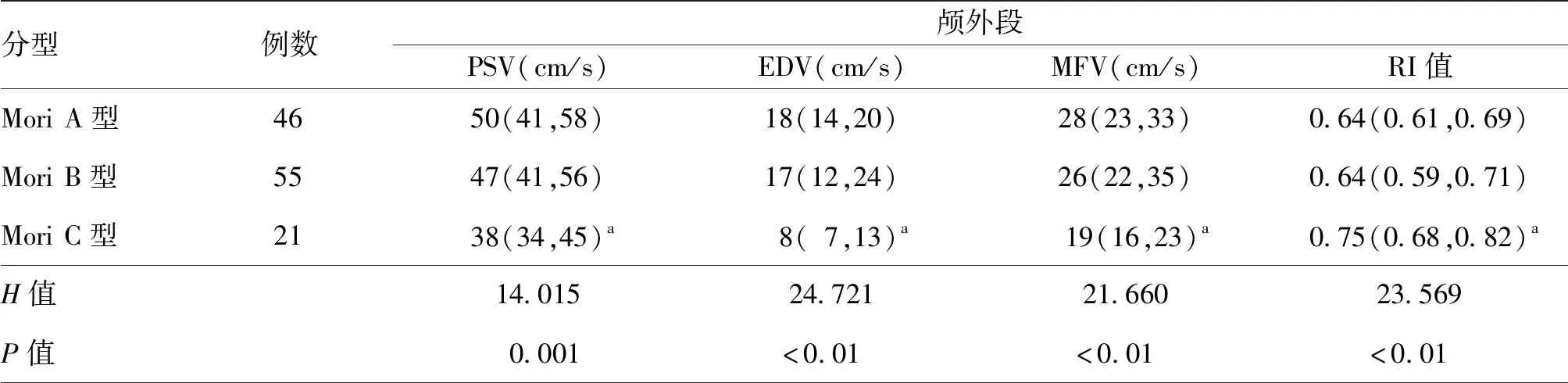
Mori A、B、C型的椎动脉颅外段内径分别为(3.4±0.6)、(3.5±0.5)、(3.3±0.5) mm,差异无统计学意义(F=0.938,P=0.625)。而随着狭窄段病变长度的增加,椎动脉颅内段、颅外段血流参数均存在差异,主要表现为Mori C型的椎动脉颅内段狭窄处的PSV、EDV、MFV及颅外段PSV、EDV、MFV均明显低于A型和B型,PI值、RI值明显高于A型和B型(均P<0.017),而A型和B型之间各血流参数差异无统计学意义(均P>0.017)。见表2。三型病变中分别有6.5%(3/46支)、 20.0%(11/55支)、71.4%(15/21支)血流速度未达到重度狭窄标准(P<0.01),见表3。

表3 不同Mori分型椎动脉颅内段重度狭窄患者椎动脉狭窄处流速分布(例)
注:a为采用Fisher确切概率法计算所得
3 讨论
Mori分型最早由Mori等[7]于20年前提出,目的是根据颅内动脉重度狭窄病变的造影成像特点找出适合行球囊扩张术的患者,该研究报道了42例患者Mori A型、B型、C型球囊扩张术的成功率分别为92%、86%、33%,发生卒中、死亡及再次血运重建(颅内外动脉旁路移植术治疗)患者的累积发生率分别为8%、26%、87%。因此,该研究者认为,Mori A型适合进行介入治疗。姜卫剑等[13]在Mori分型基础上结合颅内动脉狭窄部位和路径建立了更加详细的LMA(the location,morphology and access of lesions )分型,依据该分型对42例症状性颅内动脉狭窄患者行支架置入术的技术成功率达95.2%,
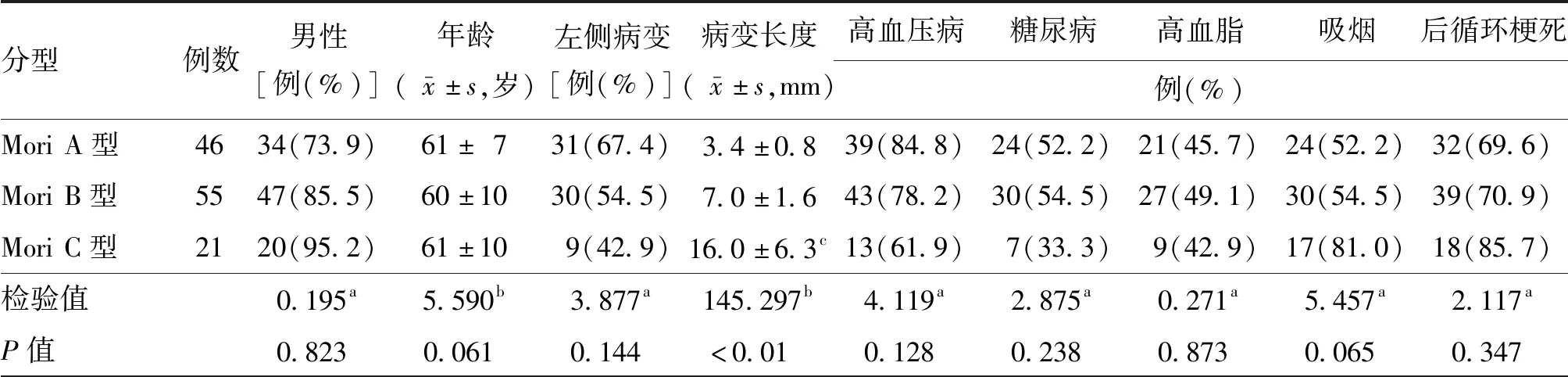
表1 不同Mori分型椎动脉颅内段重度狭窄患者的基线及临床资料比较
注:a为χ2值,b为F值;分别与Mori A、B型比较,cP<0.01
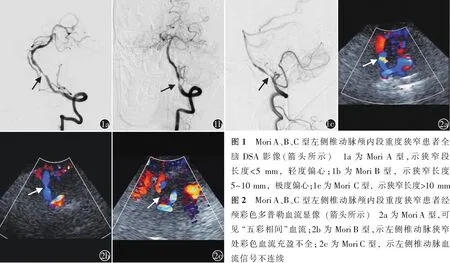

表2 不同Mori分型椎动脉颅内段重度狭窄患者椎动脉颅内外段血流动力学参数比较[M(P25,P75)]
分型例数颅外段PSV(cm/s)EDV(cm/s)MFV(cm/s)RI值MoriA型4650(41,58)18(14,20)28(23,33)0.64(0.61,0.69)MoriB型5547(41,56)17(12,24)26(22,35)0.64(0.59,0.71)MoriC型21a38(34,45)a0a8(07,13)a0a19(16,23)aa0.75(0.68,0.82)aH值14.01524.72121.66023.569P值0.001<0.0100<0.0100<0.0100
注:PSV为收缩期峰值流速,EDV为舒张期末流速,MFV为平均流速,PI为血管搏动指数,RI为血管阻力指数;Mori C型与Mori A型、B型两两比较,aP<0.017
该研究提出Mori C型病变患者治疗的风险增大。王东等[14]对症状性椎-基底动脉重度狭窄Mori A型和B型患者置入球囊扩张式支架,对Mori C型患者置入Wingspan自膨式支架,技术成功率达100%,术后仅1例C型患者出现桥脑出血,认为根据不同形态学和路径特点选择不同支架类型,可以减少术后并发症的发生。
TCCS不仅能够通过测量血流速度判定病变部位和程度,还能通过彩色血流显像显示血管的走行方向、走行角度等,并能显示狭窄处血流束的充盈缺损程度、血流信号的连续性等,较TCD在评估颅内动脉狭窄性病变中有更大优势[15-16]。SIVAS典型的CDFI表现为狭窄处局部血流充盈不全,血流束变细,呈“五彩相间”血流信号,本研究中86.9%(106/122支)病变为此种表现。我们也发现了SIVAS的不典型征象,即血流信号黯淡、不连续或中断,且这些征象更易出现在Mori B、C型中,提示随着狭窄长度和角度增加,血流阻力增加和血流速度减慢。这符合泊肃叶定律中,在血管内径不变的情况下,血流阻力与血管长度呈正比的关系;而且在弯曲成角的狭窄病变中,血管壁内侧缘与外侧缘的血流速度随管道走行变化极大,受检测角度和血管本身走行的影响,不易完整显示狭窄段。此外,我们还发现,TCCS显示为血流信号连续性差的病变中往往合并串联病变(7/16支)。一项关于复杂狭窄病变形态学的血流动力学体外模型研究表明[11],相对于同样狭窄程度的单一病变,串联病变对血流产生的阻力更大。另一项采用定量MR血管成像方法测量症状性椎-基底动脉狭窄的血流特点的研究结果表明,串联病变可致基底动脉血流量明显减低[17]。这可能因为串联病变所产生的总体效应相当于延长了受累血流的总长度,因此造成了血流信号的不连续。
TCCS同样根据血流速度判断狭窄程度,周瑛华等[9]发现,当椎动脉颅内段PSV≥190 cm/s时,诊断重度狭窄的敏感度94.6%、特异度95.9%;Tian等[18]认为,对颅内段椎动脉弥漫性重度狭窄(病变长度≥1 cm或多个病变)和极重度狭窄(狭窄程度>90%),血流速度不升高反降低,PSV≤30 cm/s的敏感度达90.9%,特异度达75.0%,该研究认为动脉粥样硬化病变导致血管弹性、顺应性减低和阻力增加,是造成血流速度减慢的主要原因。Spencer曲线理论表明,严重狭窄时(管腔狭窄>80%),通过狭窄段的压力和血流量的减少致血流速度(PSV)不能进一步升高,从而使得重度狭窄病变既可表现为血流速度的轻度升高,也可表现为正常或减低[19]。本研究有12支Mori C型病变的颅内段血流速度低于正常值,另有2支A型和3支C型病变流速正常,此外有8支B型病变的狭窄处流速虽然升高但未达到重度狭窄的标准[9]。这提示我们重度狭窄血流速度的多样化受狭窄程度和狭窄形态的影响,为提高诊断准确率,须结合其他血流参数如狭窄近段血流速度和阻力[20]。
以往研究表明,椎动脉颅外段的超声血流动力学参数可间接反映颅内段病变程度和部位[21-22],尤其是对颅内段闭塞和重度狭窄的预测准确性较高,但是我们之前的研究发现,诊断为颅内段闭塞的一部分假阳性患者是由于存在长段重度狭窄或串联病变[22]。本研究中Mori A、B型的颅外段血流速度及阻力指数未见明显异常,而Mori C型血流速度明显低于A型和B型,RI明显升高,再次证明了Mori C型重度狭窄对近段血流影响与闭塞的相似性,同时也提示对二者之间鉴别难度的增加。
Mori分型是从血管造影角度对重度狭窄病变的一种分类,区分的是病变的长度和成角,目的是便于对介入风险的预估和治疗方式的选择。本研究从超声角度探讨了不同Mori分型的局部和近段彩色血流及频谱多普勒特点,发现Mori A型和B型病变存在较多的共性,符合重度狭窄的一般特点,但是部分Mori C型病变的血流特点更加接近闭塞性病变,需要进行进一步鉴别。本研究的局限性为Mori C型例数相对较少,其彩色血流特点和血流参数有待加大样本量后进一步总结。
