原核表达家蝇抗菌肽Phormicin A,B蛋白对大肠杆菌标准株的影响
2019-12-30王代琴韦鹏威吴建伟
王 兵,杜 兵,王代琴,覃 海,韦鹏威,姚 杨,万 珊,王 涛,吴建伟
(1.贵州医科大学 生物与工程学院 生物技术教研室,贵州 贵阳 550025;2.贵州医科大学 医药生物技术工程研究中心,贵州 贵阳 550025;3.贵州医科大学第一附属医院 微生物免疫科,贵州 贵阳 550025;4.贵州医科大学 基础医学院 微生物学教研室,贵州 贵阳 550025;5.贵州医科大学 基础医学院 病原生物学教研室,贵州 贵阳 550025)
超级耐药菌的出现,使人们愈发意识到病原菌抗生素耐药问题的严重性,传统抗生素现已不能满足耐药病原菌临床治疗的需求[1-4]。抗菌肽是近年来新兴的新型抗菌剂,关于其对病原菌的研究也有诸多报道[5-7]。Li等[8]发现眼镜王蛇蛇毒抗菌肽OH-CATH30对临床耐药铜绿假单胞菌引起的角膜炎具有很好的治疗效果。Wei等[9]发现了一种既具有强抗菌能力又可抑制炎症反应的新型抗菌肽Cathelicidin-P Y。 Chromek等[10]发现cathelicidin型抗菌肽LL37可以保护尿路防止被大肠杆菌侵入感染。抗菌肽由于可进行多靶点作用,不易产生耐药性,因而已成为新型抗菌剂药物候选者和研究的热点[7,11-12]。
家蝇(housefly,Muscadomestica)又名苍蝇,能够在脏而复杂的环境中生存,很大程度上是依赖其强大的免疫系统[13-15]。而抗菌肽则是其免疫系统中非常重要的一类物质,在其天然免疫系统中发挥着重要的作用。防御素则是抗菌肽中被研究的较多的一种[12,16]。Phormicin 是早在1989年于绿蝇(Phormiaterranovae)中被首先发现的,被称为绿蝇防御素的抗菌肽,同时还发现了2个成员Phormicin A、B,但二者只相差一个氨基酸,且只对革兰氏阳性菌有抑制效果[17-18]。大肠杆菌是在临床造成尿路感染的一种常见菌[10]。
笔者及所在课题组已经克隆了家蝇防御素家族Phormicin A、B基因,将去掉信号肽的部分分别构建于原核表达载体pET28a上,之后采用原核表达法获得了二者蛋白。本研究以家蝇防御素家族PhormicinA、B抗菌肽为研究对象,探究其原核表达蛋白对大肠杆菌的作用效果,并绘制了时间抑菌曲线,以期为抗临床大肠杆菌抗感染药物的研发提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
菌株E.coliDH5α克隆菌株、E.coliBL21(DE3)表达菌株,北京索莱宝有限公司;E.coli标准株(ATCC25922),由贵州医科大学微生物教研室王涛老师提供;质粒pET-28a(+),北京安诺伦生物科技有限公司;质粒pMD19-T,北京宝日医生物技术有限公司。
1.1.2 酶与主要试剂
限制性内切酶、T4 DNA连接酶、DNA聚合酶,美国NEB公司;质粒小抽试剂盒、DNA回收试剂盒, 杭州AXYGEN爱思进生物技术有限公司;Ni-NTA His.Bind蛋白纯化试剂盒、其他相关耗材,德国Merck公司;Tricine-SDS-PAGE小分子蛋白电泳试剂盒,北京索莱宝有限公司。
1.2 实验方法
1.2.1 基因片段的扩增及质粒构建
以家蝇cDNA为模板,采用PCR法扩增,利用分子生物学方法,并将不含信号肽的部分片段插入到pET28a载体上构建原核表达质粒,所用引物有Phormicin A 28 F:C ̄T ̄A ̄G ̄C ̄T ̄A ̄G ̄C ̄T ̄C ̄T ̄C ̄C ̄T ̄G ̄C ̄C ̄C ̄C ̄C ̄A ̄A ̄A ̄G ̄A ̄G ̄G ̄A ̄A ̄G; Phormicin A 28 R:C ̄C ̄G ̄C ̄T ̄C ̄G ̄A ̄G ̄G ̄T ̄T ̄A ̄C ̄G ̄G ̄C ̄A ̄A ̄A ̄C ̄A ̄C ̄A ̄A ̄A ̄C ̄A ̄C ̄C ̄C; Phormicin B 28 F:C ̄T ̄A ̄G ̄C ̄T ̄A ̄G ̄C ̄T ̄T ̄G ̄C ̄C ̄C ̄G ̄C ̄A ̄G ̄A ̄G ̄G ̄A ̄A ̄G ̄C ̄C ̄A ̄A ̄C; Phormicin B 28 R:C ̄C ̄G ̄C ̄T ̄C ̄G ̄A ̄G ̄A ̄T ̄T ̄A ̄C ̄G ̄G ̄C ̄A ̄A ̄A ̄C ̄A ̄C ̄A ̄T ̄A ̄C ̄A ̄G ̄C ̄C ̄C ̄T ̄G ̄C。
1.2.2 目的蛋白的原核表达及检测
将构建好的原核表达质粒转化入大肠杆菌BL21(DE3)中,挑取单克隆37 ℃摇菌并保种。将菌种接入无菌LB培养基中,放入37 ℃、200 r/min 恒温摇床培养2.5 h,酶标仪测OD600。当OD600介于0.3~0.5时,取出菌液并冷却到4 ℃后实验组加入诱导剂IPTG,使诱导剂的最终0.4~0.6 mmol/L。加好IPTG后,继续放入22 ℃、160 r/min恒温摇床继续培养6~12 h。弃上清后离心(本文中如无特殊说明,离心均采用12 000 r/min)收集菌体,高压均质仪破碎后PBS缓冲液重悬备用。根据实验需要,再次离心,分为上清和沉淀。若目的蛋白在沉淀中,则加入8 mol/L尿素促溶解后放入透析袋。梯度透析法对目的蛋白进行透析和重折叠[19-20]。将折叠后目的蛋白粗悬液用滤膜过滤除杂。通过Ni-NTA His.Bind蛋白纯化试剂盒纯化制备目的蛋白。分别加入蛋白上样缓冲液后煮沸制备蛋白电泳样品。Tricine-SDS-PAGE小分子蛋白电泳试剂盒制备小分子胶(16.5%分离胶,10%夹层胶,4%浓缩胶)后,上样、电泳,考马斯亮蓝染色,冰醋酸脱色后,检测目的蛋白表达及纯化情况。为进一步确定蛋白浓度,可用Nanodrop 2000设备和BCA试剂盒共同测定蛋白样品浓度。
1.2.3 微量液体稀释法测定抗菌肽原核表达蛋白的最小抑菌浓度(MIC)
提前1 d将大肠杆菌标准株划线于LB平板上,挑取单克隆菌体接种摇菌12 h左右。将摇好的菌液用生理盐水稀释至0.5的麦氏比浊浓度(约为1×108个/mL,以比浊卡和比浊管来配置和稀释。取1640RPMI无血清培养基或LB培养基100 uL于无菌96孔板中,按相应比例计算好的样品浓度,分别加入卡那、咪唑和目的蛋白悬液后,接入相应的菌种,总体积200 uL。37℃、120 r/min培养3~6 h或根据实验需要培养到相应的时间。酶标仪测定96孔板每孔的OD600值,并将96孔板拍照。根据孔板颜色变化,可以计算出其MIC值。为了进一步验证,避免误检,将相应孔的混合物吹打均匀后涂布平板,培养12~16 h后,进一步观察是否有菌生长及菌落生长密度。根据二者结果,综合测定其MIC值。
1.2.4 原核表达蛋白对大肠杆菌标准株时间生长曲线的绘制
从接种到加药和目的蛋白过程同上1.2.3。同时做多个平行组,到达相应时间点后,酶标仪测定0、1、2、3、4、5、6、8、12、14、16、18、20、22、24、26、28和30 h的OD600值。最后,统一统计并分析数据作图。通过比较OD值的大小,绘制时间生长曲线,来分析目的蛋白对于大肠杆菌标准株生长的影响。
2 结果与讨论
2.1 家蝇防御素家族Phormicin A、B基因原核表达载体的构建
参照NCBI基因库中家蝇Phormicin A、B的序列信息(基因序列号为LOC101887709-8、LOC101888043-5)来设计引物,采用PCR法从家蝇cDNA中扩增目的片段,测得序列后,利用分子生物学方法将去掉信号肽的部分构建于原核表达载体pET28a上。将质粒转化入大肠杆菌BL21(DE3)中,再次用引物筛克隆(图1)测序后并保存菌种。
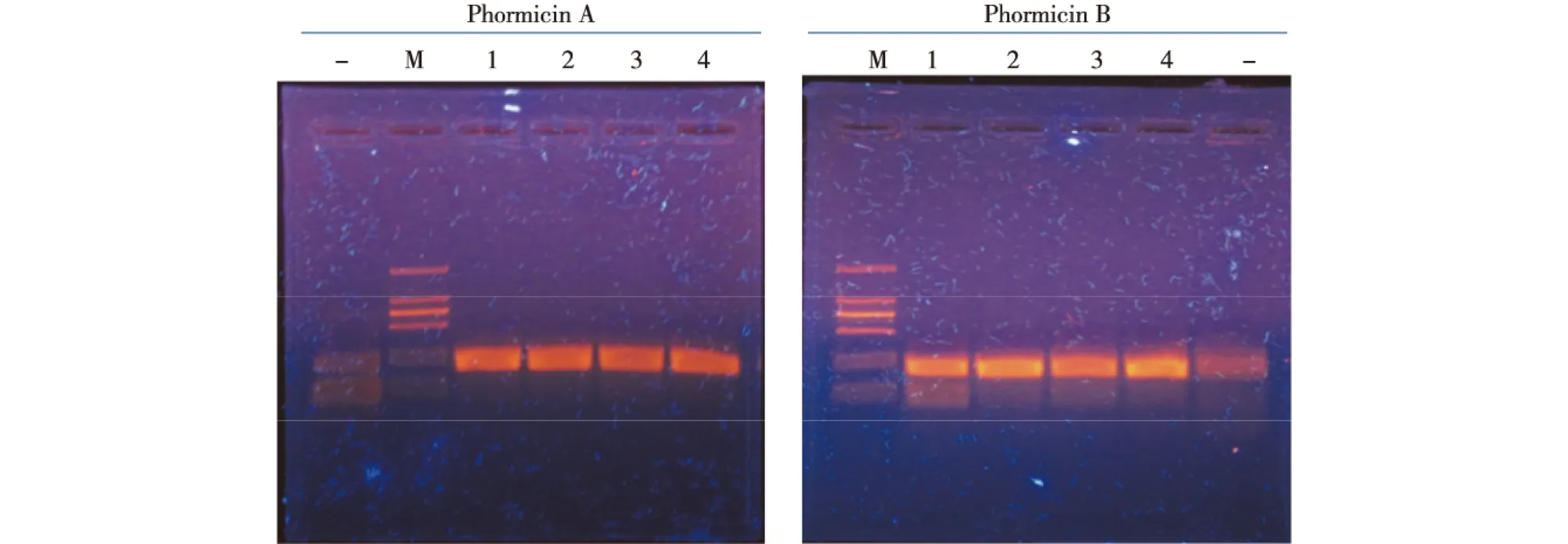
M代表标准DNA,从上至下条带分别为2 000、1 000、750、500、250和100 bp;1、2、3、4泳道为PCR扩增的目的片段,约为270 bp;-代表阴性对照图1 PCR筛选单克隆菌种DNA电泳Fig.1 The DNA agrose map of Phormicin A and B prokaryotic expression monoclone bacteria seeds by PCR screen method
此外,对家蝇Phormicin A、B基因编码的氨基酸序列进行了比对分析,并采用N-J法构建了系统进化树(图2)。由图1和2可知:家蝇Phormicin 属于防御素家族,因翻译成中文是绿蝇肽,家蝇绿蝇肽,不太通顺,因此选用英文原称表述。最后构建了二者去掉信号肽之后蛋白对应序列的原核表达载体,为下一步原核表达实验提供了基础。

图2 家蝇Phormicin A、B氨基酸序列比对及进化树Fig.2 The multisequence alignment map and phylogenetic tree of housefly Phormicin A and B
2.2 家蝇Phormicin A、B蛋白的原核表达及亲和纯化
采用IPTG诱导法,表达并纯化了家蝇Phormicin A、B的原核表达蛋白。然后通过Tricine-SDS-PAGE小分子蛋白电泳,检测目的蛋白的表达情况。由图3可知:家蝇Phormicin A蛋白在上清和沉淀中都有表达,而B蛋白则在上清中表达稍多,沉淀中也有少量表达。二者在去掉信号肽后剩余70和69个氨基酸,但构建到原核表达载体pET28a中时,在片段的N段和C端都带上了His标签,还有载体上部分表达的氨基酸,综合来说约有90个氨基酸,因此根据估算,蛋白大小约为(9~10)×103。IPTG小规模诱导后进行小分子蛋白电泳实验。由图3还可知:成功诱导了家蝇Phormicin A、B蛋白的原核表达。另外,在构建表达载体时用的是大肠杆菌DH5α克隆菌株,原核表达用的是大肠杆菌BL21(DE3)表达菌株,还有后面实验用的大肠杆菌标准株,三者为大肠杆菌不同的株系,因为发挥作用及用途不同而分别命名。此3株大肠杆菌为分子生物学实验中比较常用的菌株。
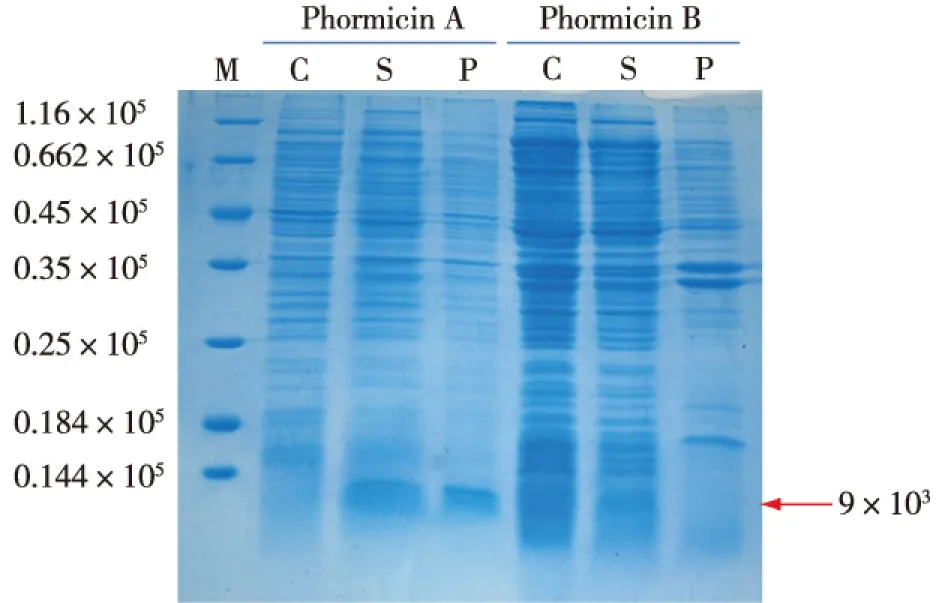
C代表control 未诱导对照组;S代表上清样品;P代表沉淀样品;M代表Mark图3 Tricine-SDS-PAGE检测 Phormicin A、B原核表达蛋白Fig.3 The Tricine-SDS-PAGE map of prokaryotic expression Phormicin A and B protein
在成功进行二者目的蛋白的原核表达后,采用Ni-NTA His.Bind蛋白纯化试剂盒纯化制备目的蛋白。大规模诱导后,发现家蝇Phormicin A、B蛋白在沉淀中远远多于在上清中的表达,这可能暗示着其对宿主大肠杆菌的生长可能有影响,而大部分都以包涵体的形式被包裹起来。于是采用尿素溶解,透析袋梯度透析复性法,制备二者的蛋白悬液[19-21]。
接下来采用Ni-NTA His.Bind蛋白纯化试剂盒纯化制备目的蛋白。在纯化上柱子前,先用过滤器将杂质进行初步排除,否则亲和纯化柱容易被堵。纯化的基本原理是通过活化的亲和树脂柱将带有His标签的目的蛋白吸附到树脂上,然后用洗脱缓冲液进行冲洗,将非特异结合的多余杂蛋白洗脱下来。最后用合适浓度和体积的咪唑将目的蛋白洗脱下来,收集起来。因为His组蛋白含有咪唑基团,咪唑洗脱时,是与树脂发生亲和置换反应,此方法也是在蛋白表达纯化中,用的较多的一种。除此之前,还有谷胱甘肽疏基转移酶GST标签,麦芽糖蛋白标签等的标签和蛋白纯化方法。但是,GST标签等大概约27×103相对较大,如果要做后续的活性功能实验,还需要用特定的酶将标签切除,然后通过超滤离心等方法再收集目的蛋白。这样目的蛋白相对损失较多,得率不高,程序复杂一些,成本相对高一些,但大部分都是可溶性表达,有利于活性检测。如果不切除标签,可能对目的蛋白活性有干扰,而Phormicin A、B蛋白相对又较小,因此,综合考虑用His标签,用Ni-NTA His.Bind法纯化目的蛋白。
2.3 家蝇Phormicin A、B原核表达蛋白作用于大肠杆菌标准株的活性分析
在制得目的蛋白悬液后,采用微量液体稀释法,来检测目的蛋白对大肠杆菌标准株生长的影响。由图4可知:家蝇Phormicin A、B对大肠杆菌的生长具有一定的抑制效果。图4(a)是微量液体稀释法测得的结果,由图4(a)可知:前面4~5孔相对清澈,表明菌体生长较少或者不长菌,到最后4~5孔发现相对浑浊,表明已经长了很多菌。从第1~10孔是按照表1表格中的浓度依次倍比稀释过来,浓度逐渐降低。为了更进一步测量,又用酶标仪测量了每个孔OD600,图4(b)。由图4和表1可知:从第6孔往后,OD明显增大,表明菌体明显增多。而前面1~5孔则OD相对较小,说明加的药物组相对自然生长组是抑菌活性,但是由于是在3 h左右就测了,OD过小,不能够很好的说明问题,存在一定的误差。于是,又将一些孔通过平板涂布法,进一步确定具有抑菌效果最低浓度孔。卡那为第7孔,最小抑菌浓度(MIC)是4 mmol/L;咪唑为第6孔,MIC为15.63 mmol/L; A蛋白是第3孔,MIC为20 mmol/L;B蛋白是第4孔,MIC为7.5 mmol/L。由于Phormicin A、B原核表达蛋白是用咪唑洗脱下来的,是蛋白与咪唑的混合物,从分析表格中浓度发现:A、B蛋白中咪唑浓度12.5和6.25 mmol/L要小于咪唑本身的最小抑菌浓度15.63 mmol/L。

图4 Phormicin A、B、咪唑、Kna+对大肠杆菌影响的MIC检测Fig.4 Inhibition activity analysis of Phormicin A and B,imidazole,Kna+ to E. coli by MIC method
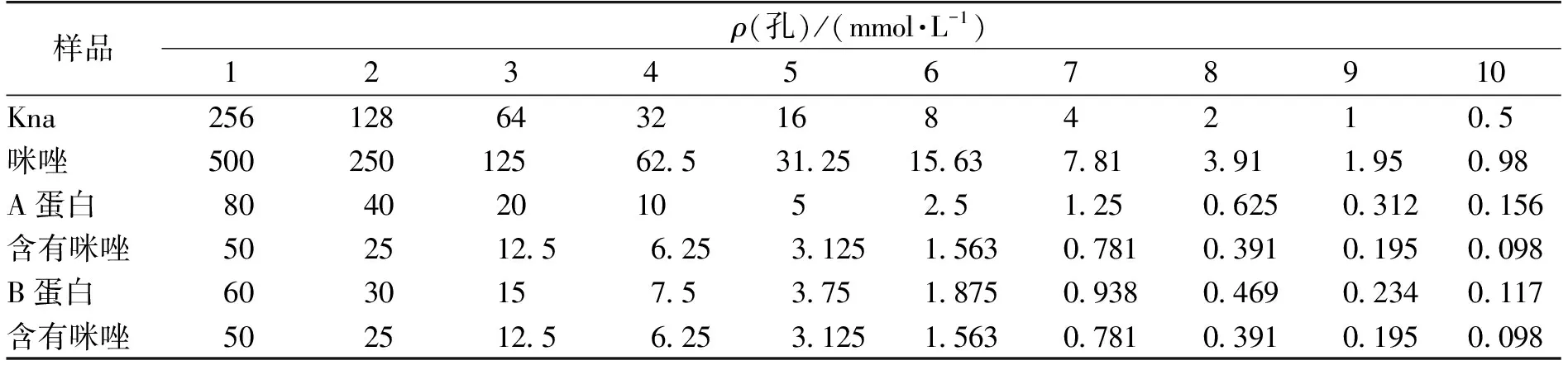
样品ρ(孔)/(mmol·L-1)12345678910Kna25612864321684210.5咪唑50025012562.531.2515.637.813.911.950.98A蛋白8040201052.51.250.6250.3120.156含有咪唑502512.56.253.1251.5630.7810.3910.1950.098B蛋白6030157.53.751.8750.9380.4690.2340.117含有咪唑502512.56.253.1251.5630.7810.3910.1950.098
2.4 家蝇Phormicin A、B蛋白作用大肠杆菌标准株的时间生长曲线
为了更进一步追踪家蝇Phormicin A、B蛋白对大肠杆菌标准株的影响,同时为了观察在不同时间段内,二者对于大肠杆菌标准株生长变化的作用,选取从第1 h,直到第30 h,用酶标仪测定OD600表征大肠杆菌标准株的浓度。由图5和6可知:在前3~4 h内,药物组OD偏小,随着时间的推移,OD逐渐增大,差异也更明显。根据测得的结果绘制了大肠杆菌的时间生长曲线,其中黑色方形代表自然生长对照组,红色代表卡那阳性对照组,蓝色代表咪唑组,绿色代表A蛋白组,紫色代表B蛋白组。2 MIC代表杀菌浓度即MBC是最小抑菌浓度的2倍,最初基本不长菌,或者只长很少的菌。1 MIC即最小抑菌浓度,0.5 MIC则是最小抑菌浓度的一半,抑菌效果更差一些。

图5 家蝇Phormicin A、咪唑、Kna+对大肠杆菌 标准株的时间生长曲线Fig.5 The time growth curve of the standard E. colistrain affect by housefly Phormicin A,imidazole and Kna+
由图5可知:A蛋白2倍,1倍,0.5倍MIC相对其他对照组(natural group),都具有一定的抑菌效果,在10~12 h期间更为明显,且随着浓度的减小,抑菌效果减小。由图6可知:B蛋白也是如此。但相对而言,B蛋白抑菌效果要稍好于A蛋白。综合分析,虽然二者都具有一定的抑菌效果,但距离临床应用其效果仍然不够理想。目前研究报道的抗菌肽多为体外合成,受合成条件和技术的限制,合成的多为40个氨基酸以内的小分子,最多不超过100个氨基酸,而且合成的多肽往往只具有简单的一级和二级结构,无法获得更高级的三级或四级结构。因此,合成的抗菌肽可能与昆虫等生物体内本来的构象差别较大,很多难以达到理想的效果。根据抗菌肽研究的相关报道[22],目前想要获得功能活性较好的抗菌肽,往往构建基因工程载体,找到合适的表达条件,尝试采用更好的表达方法,实现可溶性表达,直接纯化出来,可能具有更为理想的作用效果,这也是抗菌肽研究的一个难点。而采用原核表达方法,虽然可以获得较大量的蛋白,但很多抗菌肽作为包涵体往往在沉淀中。可能一定程度上也影响了其功能,不能够达到体内构象所具有的效果。如果从天然样本中直接分离纯化,则需要的样本量又较大。采用昆虫细胞或者酵母等表达系统,获得的蛋白量又相对较少,成本相对较高。总体说来,找到一种合适的表达或生产抗菌肽的方法,对于精确研究其功能具有重要的意义,也是后续进行相关研究进一步努力的方向。

图6 家蝇Phormicin B、咪唑、Kna+对大肠杆菌标准株的时间生长曲线Fig.6 The time growth curve of the standard E. colistrain affect by housefly Phormicin B,imidazole and Kna+
3 结论
采用原核表达法制备了其融合蛋白,并作用于大肠杆菌标准株。通过微量液体稀释法测定其最小抑菌浓度分别为20 和7.5 mmol/L,并绘制了二者作用于大肠杆菌标准株的时间生长曲线。发现二者对大肠杆菌标准株的生长具有一定的抑制作用。本研究为临床大肠杆菌感染抗菌肽类药物的研发,提供了新的思路和一定的参考。
