金属有机骨架材料在药学中的研究进展
2019-12-30任佳姝单莲云陈金龙
任佳姝,单莲云,陈金龙
(中国药科大学 药学院 药物分析系,江苏 南京 210009)
金属有机骨架材料(metal-organic frameworks,MOFs) 是一类结构独特的新型有机-无机杂化的晶态多孔材料,也被称为多孔配位聚合物(porous coordination polymers,PCPs)[1]。1995年,Yaghi等[2]通过溶剂热法制备了由Zn2+与苯二甲酸构建而成的三维结构多孔材料,首次提出了MOFs的概念。MOFs的立体网络结构是由金属离子或金属簇作为节点,含氮、氧的有机配体作为桥梁,两者通过配位作用自组装形成配位聚合物。与其他传统多孔材料如沸石、活性炭等相比,MOFs具有制备方法简单、内部孔道有序可调、孔隙率较高(约占自由体积的90%)、比表面积较大(高于6×103m2/g)和含有不饱和的金属配位位点等优点[3],因而已被广泛应用于气体的吸附与分离[4]、储能[5]、催化[6]和化学传感[7]等领域。笔者主要就MOFs在生物医学和药学[8]中的应用进行综述。
1 MOFs可用于确证药物的绝对构型
有机化合物的绝对构型分析在药物的合成研究中起着很重要的作用,但常用的结构表征手段如核磁、质谱,并不能得到化合物的绝对构型[9]。为了得到化合物的绝对构型,X线晶体衍射是较为常用的分析方法,但此方法具有一定的局限性,要求制备高质量的单晶,具有样品制备繁琐、用样量大以及对纯度要求高等缺点[10]。
2013年,Inokuma等[11]为了解决化合物绝对构型确证繁琐复杂的问题,提出一种新兴的无需样品结晶的X线衍射技术,称为“结晶海绵(crystalline sponges,CS)法”。该法将被分析物吸附在MOFs的孔隙结构中,利用柔性MOFs在客体分子吸附和解析过程中仍保持晶态的性质,使用X线单晶衍射技术把吸附在MOFs孔道中的客体分子可视化,从而实现了分子结构和绝对构型辨别。2017年,Yan等[12]通过预装结构已知的手性参照物合成手性结晶海绵CS1(图1),将分析物作为客体分子吸附在结晶海绵孔隙中,只须同时观察晶体结构中参照物与分析物的手性分子,即可在不结晶的情况下通过X线衍射确定分析物的绝对构型,并将此手性CS分析法成功用于薄荷醇以及糖衍生物的绝对构型分析。此外,Wada等[13]将此手性CS法还应用于天然产物红藻提取物的结构分析,发现仅需要10 mg红藻粗提取物,即可完成混合物的结构确证,简化了复杂样品中天然产物的结构确证与开发。因此,手性CS法有望成为测定药物绝对构型的最佳工具之一。

图1 手性晶体海绵CS1的合成以及客体分子的X线衍射的晶体结构[12]Fig.1 Synthesis of chiral CS1 and structure of the guest by X-ray crystal analysis[12]
2 MOFs可用于拆分手性药物
手性化合物尤其是手性药物的2个对映体通常具有不同的药物活性、作用机制和毒理作用,因此手性对映体的分离对手性药物开发和临床应用具有十分重要的意义[14]。目前,手性MOFs已经作为高效液相色谱、高效气相色谱的新型手性固定相,被广泛应用于醇、酮、黄酮、苯酚、碱和酰胺等外消旋体的分离[15-16]。
Xie等[16]合成了以Co为金属离子的MOFs,用作气相色谱手性固定相,被用于包覆开管色谱柱,随后将其用于香茅醛对映体的识别与分离,检出限与定量限分别为0.125 和0.417 ng,实验结果显示:经过MOFs包覆的色谱柱对手性化合物具有良好的识别与分离能力。此外,毛细管电色谱同时具有毛细管电泳的高效、高分辨性能以及高效液相色谱的高选择性性能,在手性化合物的分离中也被广泛使用[17]。Fei等[18]将手性有机配体合成的MOFs作为涂层用于制备新型涂层毛细管,结果显示:该方法提高了毛细管电泳对手性化合物的分离能力,并将其成功地用于硝基酚与紫罗酮同分异构体的分离。2015年,Pan等[19]在室温条件下,通过层层自组装的方法制备了手性MOFs(AlaZnCl)用于涂层毛细管(图2),并将其用于分离特布他林和卡维地络外消旋药物以及肾上腺素、去甲肾上腺素、异丙肾上腺素和脱氧肾上腺素外消旋药物。该研究表明:手性MOFs对各种手性化合物具有很好的识别能力,可实现手性化合物的完全分离,在药物的手性分离领域具有很好的应用前景。

图2 AlaZnCl涂层毛细管的制备过程[19]Fig.2 Schematic diagram for the preparation of AlaZnCl coated capillary column[19]
3 MOFs可用于促进药物递送
靶向给药是目前较为热门的一种药物递送方式,通过选择适宜的药物载体,可以优化药物在人体内的释放、吸收、代谢和排泄过程,从而提高药物的利用率,降低药物毒副作用。MOFs由于具有可包封药物的高比表面积以及大孔径,且可以通过调整被包封物质的大小和性质,从而改变MOFs内部结构特性。金属与有机配体间配位键的不稳定,导致其具有生物可降解性,故MOFs已经成为药物靶向递送载体材料的研究热点,对其进行修饰不仅可实现药物的高载药量,而且可以控制适宜的释放速率[20-22]。此外,MOFs作为药物控释载体合成方法简便、稳定性好且靶向性较强,已经成为目前性能优良的新型药物控释载体材料之一[23]。2010年,Miller等[24]以无毒的Fe为金属离子中心,生物活性物质烟酸为配体制备了生物可降解的MOFs(BioMIL-1),并研究了其载药性能,结果显示:其负载的烟酸质量分数达到75%,故此开发出了一种药物递送的新方法。
5-氟尿嘧啶是一种广为使用的抗肿瘤药物,但由于缺乏适合的药物载体,在化学治疗中的使用受到限制[25]。Sun等[26]合成了以Zn为金属离子的MOFs用于负载5-氟尿嘧啶,但载药量仅达33.3%。2016年,Bag等[27]用溶剂热法合成了一种以Zn为金属离子的高度稳定的新型MOFs(代号1,图3),由于其内部结构包含N—H空位点,有利于药物分子的包封,该课题组将其用于室温下装载抗癌药物5-氟尿嘧啶,并研究了其载药以及释放性能,发现其载药量高达53.3%,缓释时间长达3 d,且安全无毒,表明该MOFs有望被用于负载药物。
多柔比星为蒽环类抗肿瘤药物,其体内半衰期短且具有心脏毒性。2014年,Kundu等[28]合成了基于钆(Gd)的多孔金属有机骨架Gd-pDBI(图4)。随后通过机械研磨,将Gd-pDBI转化为纳米尺寸(约140 nm),得到具有优异水分散性的MG-Gd-pDBI,发现其热稳定性好,孔隙率高且具有低毒性,对抗癌药物多柔比星的载药量达到12%。

图3 负载5-氟尿嘧啶的金属有机骨架材料1的结构[27]Fig.3 Construction of the framework of 1 for loading 5-FU[27]

图4 负载多柔比星的金属有机骨架Gd-pDBI[28]Fig.4 Gd-pDBI for loading doxorubicin[28]
4 MOFs可用于催化药物合成
化学反应是药物合成与开发过程中必不可少的部分,随着对MOFs研究的深入,研究人员发现其对很多化学反应有很好的催化效果,如:克莱森-施密特酯缩合反应、交叉羟醛缩合反应、环氧化物的开环聚合反应以及酸催化的选择性氢化反应等[29-30]。
2015年,Manna等[31]合成了3种基于联吡啶与邻二氮菲的具有UiO拓扑结构的MOFs,发现其具有很好的催化活性。为了得到更高活性的单位点固体催化剂,该课题组对其进行金属化的后修饰,得到了铱(Ir)功能化的MOFs,结果显示:Ir功能化的MOFs对芳香酮与醛的氢化硅烷化反应以及芳烃的硼化反应具有很好的催化活性,且催化活性是未修饰的MOFs的95倍,可反复使用超过15次(图5)。2016年,Sarkar等[32]合成了一系列基于Mn的MOFs,结果显示其对腈化反应具有很好的催化效果。Lin等[33]通过原位金属化反应合成了以Co为金属离子的基于卟啉的MOFs,并将其用作末端炔烃水合反应的催化剂,结果显示其催化活性高达对照的38倍。由此可见:MOFs对有机合成反应具有很好的催化效果,其催化效率高、选择性好、可循环使用,为药物的合成与开发提供了良好的工具。
5 MOFs在抗菌药物中的应用
病原体对传统抗生素耐药性增强已经成为目前人类健康领域一个亟待解决的问题,因此,开发新的具有抗菌性能的材料势在必行[34]。Mckinlay等[35]发现以Mg、Cu、Fe、Mn、Co、Ni和Zn作为金属离子,2,5-二羟基对苯二甲酸酯作为有机配体的一类MOFs(M-CPO-27)具有抗菌活性,且以Ni和Zn为金属离子的MOFs抗菌活性最为明显。1997年,Nomiya等[36]首次证明由Ag离子与咪唑构成的配位复合物对细菌、酵母菌和霉菌都具有抗菌活性。Tăbăcaru等[37]发现以Ag为金属离子,以4,4’-双吡唑基为配体的MOFs,对大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌均有很好的抗性。2014年,Lu等[38]使用芳香羧酸,合成了2种新的以Ag为基础的MOFs(图6),并对其抗菌性能进行研究,结果显示其对大肠杆菌以及金黄色葡萄球菌均具有很好的抗性。此外,该MOFs生物相容性好,同时具有很好的热稳定性以及光稳定性,在抗菌领域有很好的应用前景。有研究显示其抗菌性能主要源于内部的金属离子可内化入细菌细胞壁,可干扰细菌的蛋白质合成[39],可见MOFs除了能通过负载具有抗菌活性的物质发挥抗菌性能之外,其本身也显现出很好的抗菌活性,有望被应用于抗菌药物的设计与开发。
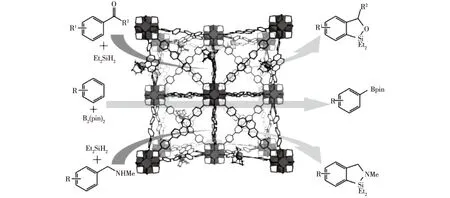
图5 用于化学催化的具有UiO拓扑结构的MOFs[31]Fig.5 UiO-type MOFs for highly efficient catalysts[31]

图6 基于Ag的MOFs杀菌机制图[38]Fig.6 Schematic representation of the bactericidal mechanism for Ag-based MOFs[38]
6 MOFs作为光敏剂可用于肿瘤光动力学治疗
光动力学疗法(photodynamic therapy,PDT)是一种非侵入性的肿瘤治疗方法,将光敏剂、光和氧分子三者结合,利用光动力学反应,从而实现了对恶性肿瘤的选择性治疗[40]。该方法的治疗机制是将光敏剂特异性的富集在肿瘤组织中,在特定波长的光激发后,产生大量的活性氧导致细胞毒性,从而杀伤肿瘤细胞。光动力学疗法具有毒性小、无耐药性、不损伤其他组织以及治疗彻底等优点,已成为治疗晚期肿瘤的新手段[41]。但传统的敏化剂对肿瘤部位的特异性低、不易代谢且毒性大,因此,研究者们仍致力于寻找出性能优异的光敏剂,用以改善治疗效果[42]。
2014年,Lu等[43]报道了一种基于氟化氢-卟啉的纳米MOFs(DBP-UiO),结果显示其极大地增强了光动力学效果,根除了半数大鼠的肿瘤病灶。此后,该课题组对该MOFs进行改良(图7),设计合成了基于Cl的MOFs(DBC-UiO)。结果显示:相比于DBP-UiO,DBC-UiO具有更优的光物理学性质,在大鼠结肠癌的光动力学治疗中,可通过促进细胞凋亡以及免疫细胞坏死,从而杀灭癌细胞[44]。此外,Wang等[45]通过配体交换的方法合成了氟硼二吡咯功能化的基于锆的纳米MOFs(UiO-PDT),也发现其可以产生对癌细胞有杀伤作用的活性氧,且细胞毒性较低。故MOFs具有优良的光动力学性能,有望作为光敏剂用于癌症的光动力学治疗,以减轻毒性,提高疗效,现已经逐渐成为近年来的研究热点。

图7 DBC-UiO光敏化产生纯态氧的原理[44]Fig.7 Schematic description of singlet oxygen generation by DBC-UiO[44]
7 总结与展望
与传统的多孔材料相比,MOFs在比表面积、孔隙率和稳定性等方面均具有绝对优势,不仅结构组成可灵活变换,而且可通过合成前后的设计与修饰得到具有不同物理化学性质以及不同功能的MOFs。随着对MOFs研究的不断深入,其在药学领域中显现出巨大的应用前景,但相比其他成熟的多孔材料如:活性炭、沸石,有关MOFs材料的报道与研究仍处于初级阶段,存在很大的研究和挖掘空间,需要研究人员进一步探索。
关于MOFs在药学中的应用前景,笔者认为以下几个方面值得进一步探索: 1)将MOFs材料与不同的分离技术相结合,实现难分离药物的完全分离;2)对不同的靶向位点,研究MOFs材料与目标位点的作用机制,从而更好地提升其靶向效果;3)研究MOFs与不同药物的作用机制,从而提高载药量与控释效果;4)进一步研究MOFs的抗菌性能,从而开发出新的抗菌药物;5)推进MOFs在肿瘤治疗中的实际应用。
