NIN1结合蛋白1激活人Src原癌基因调控前列腺癌细胞生物学特性的研究
2019-12-30张向明王军凯
房 晓 王 健 张向明 鲍 一 王军凯
前列腺癌是男性生殖系统最常见的恶性肿瘤,据报道其发病率仅次于肺癌,居男性癌症病死率的第2位,近年来前列腺癌的发病率呈逐年增高趋势。早中期前列腺癌患者预后较好,5年生存率可达到95%以上,中晚期前列腺、转移性前列腺癌患者的临床预后最差,5年生存率不超过30%[1],故前列腺癌的早期诊断格外重要。需要寻找新型有效的诊断前列腺癌和判断其预后的生物学标志物,可预防无症状前列腺癌的过度治疗,以及确保恶性进行性肿瘤在早期检测阶段能得到及时治疗。
NIN1结合蛋白1(NOB1)由NOB1基因编码,是26S蛋白酶体一个亚基,在蛋白降解途径中发挥关键作用。NOB1蛋白包括1个PIN区域和1个碳端锌带域,具有转录调控因子的作用。多数研究报道,NOB1在肾癌、结直肠癌、非小细胞肺癌、骨肉瘤、口腔鳞状细胞癌等肿瘤组织中高表达[2-7];NOB1可能参与多种肿瘤的发生,也可能是致癌因素[8-10]。本研究团队的前期研究[11]中,通过Western印迹法和免疫组织化学技术证实NOB1在前列腺癌组织中高表达;预后分析、绘制生存曲线等统计学分析结果显示,高表达NOB1的前列腺癌患者预后较差,表明NOB1在前列腺癌的发生和发展过程中起作用,可能是潜在的癌基因。目前,NOB1对前列腺癌生物学特性的影响及其作用机制尚未明确。本研究通过构建NOB1敲低的前列腺癌细胞系,观察前列腺癌细胞的增殖、周期和侵袭能力,初步探讨NOB1对前列腺癌细胞生物学特性的作用机制。
1 材料与方法
1.1 实验材料 前列腺癌细胞PC-3、DU145、22RV1和LNCaP均购自中科院上海细胞库,细胞培养液RPMI-1640培养基购自美国Corning公司,FBS购自美国Invitrogen公司,1%青霉素、1%链霉素试剂购自上海博光生物公司,蛋白酶抑制剂和磷酸酶抑制剂购自美国ApexBio公司。实时定量PCR所用反转录酶、SYBR酶购自日本TaKaRa公司,引物由上海生工生物工程公司合成。NOB1、β-actin、人Src原癌基因(c-Src)、c-Src磷酸化(p-c-Src)抗体购自美国Abcam公司。MTT购自美国Sigma公司。
1.2 实验方法
1.2.1 细胞培养 将常见的前列腺癌细胞22RV1、PC-3、LNCaP和DU145培养于含10% FBS、1%青霉素、1%链霉素的RPMI-1640培养液中,在37 ℃、体积分数为0.05 CO2孵育箱中培养,每2 d更换1次培养基,取对数生长期细胞用于实验。
1.2.2 慢病毒转染和筛选 转染慢病毒由上海汉恒生物公司提供,包括对照组病毒(Lv-shCtr1)和NOB1干扰病毒(Lv-shNOB1)。将细胞接种于6孔板内,待其贴壁后,换液为基础培养基,根据感染复数计算的量,分别加入适量空白对照慢病毒(Lv-shCtrl,阴性对照组)和NOB1干扰慢病毒(Lv-shNOB1,敲低组),混匀后置入37 ℃恒温孵箱培养48 h。
1.2.3 实时定量PCR检测 采用TRIzol法提取细胞总RNA,PC-3、DU145、22RV1、LNCaP 4种细胞取等量RNA按反转录试剂盒说明书进行反转录获得互补DNA。反应条件:预变性95 ℃ 60 s、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s并采集荧光信号,进行40个循环。实验重复3次。所用引物序列:NOB1正向引物5’-GAC ATA GGA GCC GGC GCA A-3’,反向引物5’-CGT ATT CCG GTA AGG GCT CC-3’。同法检测PC-3和DU145细胞空白对照组(不转染病毒)、阴性对照组、敲低组中NOB1的表达量。
1.2.4 Western印迹杂交 于放射免疫沉淀测定裂解液(RIPA裂解液)中加入蛋白酶抑制剂和磷酸酶抑制剂,置于冰上裂解细胞30 min,4 ℃、12 000×g离心10 min。采用二辛可宁酸(BCA)法测定蛋白质浓度,取等量总蛋白与5×十二烷基硫酸钠(SDS)上样缓冲液混合,100 ℃变性10 min。SDS-PAGE电泳,转膜至硝酸纤维素膜上,以5%脱脂奶粉室温下封闭2 h,磷酸盐吐温缓冲液(PBST)洗膜3次,在4 ℃摇床上孵育一抗过夜。PBST洗膜3次,将相应二抗于室温孵育2 h,应用Odessey红外荧光扫描成像系统检测蛋白质荧光强度。
1.2.5 MTT法检测敲低NOB1后前列腺癌细胞PC-3、DU145的增殖活性 采用MTT法检测敲低NOB1对前列腺癌PC-3和DU145细胞生成的影响。取对数生长期的细胞,经胰蛋白酶消化后于含血清的完全培养基中终止消化,以1 500×g离心3 min,去上清液,制成细胞悬液。细胞计数后,在96孔板中分为空白对照组、阴性对照组、敲低组3组,分别培养5 d,每天设置5个复孔。每天采用MTT法检测细胞活性:加入MTT母液,反应2 h后,加入MTT B液终止反应,应用酶标仪检测波长为595 nm 处的吸光度(A595)值。
1.2.6 流式细胞仪检测敲低NOB1后前列腺癌细胞PC-3、DU145的细胞周期 将3组细胞用不含EDTA的胰酶消化后收集,冰冷PBS清洗2次,预冷70%乙醇固定,于4 ℃过夜;离心去除乙醇,PBS清洗3次,碘化丙啶(PI)染色,应用流式细胞仪检测各组细胞DNA含量,并计算细胞周期。
1.2.7 Transwell实验检测敲低NOB1后前列腺癌细胞PC-3、DU145细胞的侵袭能力 取上述3组细胞,使用无血清培养基在预先铺有基质胶的Transwell小室的上室中培养,下室中加入含10% FBS的RPMI-1640培养液,置于培养箱中培养24 h,0.5%结晶紫染色,于倒置显微镜下随机选取6个视野摄片、计数,计算每个视野中的细胞平均数。
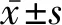
2 结 果
2.1 4种常见的前列腺癌细胞中NOB1的表达量比较 恶性程度较高的前列腺癌细胞22RV1、PC-3、DU145的NOB1 mRNA相对表达量分别为1.000±0.157、1.576±0.150、2.404±0.513,均显著高于恶性程度较低的前列腺癌细胞LNCaP的0.559±0.081 (P值均<0.05)。Western印迹法检测前列腺癌细胞22RV1、PC-3、LNCaP、DU145的NOB1蛋白质相对表达量分别为1.00±0.00、3.39±1.05、0.33±0.07、1.89±0.34,22RV1、PC-3、DU145细胞的NOB1蛋白质相对表达量均显著低于LNCaP细胞(P值均<0.05)。见图1。

1 22RV1细胞 2 PC-3细胞 3 LNCaP细胞 4 DU145细胞
2.2 慢病毒转染PC-3和DU145并验证敲低效率 为进一步研究NOB1基因在前列腺癌细胞中的生物学功能,本实验选择NOB1表达量较高的前列腺癌细胞PC-3和DU145构建NOB1基因的shRNA的干扰载体。PC-3细胞的空白对照组、阴性对照组和敲低组的NOB1 mRNA相对表达量分别为1.000±0.178、0.864±0.065、0.489±0.074,敲低组显著低于空白对照组和阴性对照组(P值均<0.05);DU145细胞的空白对照组、阴性对照组和敲低组NOB1 mRNA相对表达量分别为1.000±0.248、1.036±0.155、0.101±0.016,敲低组显著低于空白对照组和阴性对照组(P值均<0.05),表明构建慢病毒介导NOB1稳定敲低前列腺癌细胞PC-3和DU145。PC-3细胞的空白对照组、阴性对照组和敲低组NOB1蛋白质相对表达量分别为1.00±0.00,1.12±0.45、0.34±0.07;DU145细胞的空白对照组、阴性对照组和敲低组NOB1蛋白质相对表达量分别为1.00±0.00、0.96±0.13、0.13±0.04,两种细胞敲低组的NOB1蛋白质相对表达量均显著低于空白对照组和阴性对照组(P值均<0.05),见图2。上述实验表明成功建立了稳定敲低NOB1的前列腺癌细胞株。

A PC-3细胞 B DU145细胞 1 空白对照组 2 阴性对照组 3 敲低组
2.3 敲低NOB1后前列腺癌细胞PC-3、DU145细胞增殖活性变化 实验第3、4、5天,PC-3、DU145细胞敲低组A595值均显著低于各自阴性对照组同时间(P值均<0.05),细胞增殖率被抑制70%以上。见表1。


组别时间PC-3DU145空白对照第1天0.133±0.0210.111±0.010第2天0.258±0.0170.171±0.021第3天0.641±0.0490.266±0.014第4天0.961±0.0740.849±0.004第5天1.216±0.1110.968±0.018阴性对照第1天0.141±0.0140.114±0.011第2天0.261±0.0070.171±0.013第3天0.721±0.048①0.274±0.014①第4天0.915±0.088①0.832±0.434①第5天1.117±0.094①1.105±0.061①敲低第1天0.118±0.0150.108±0.007第2天0.202±0.0300.140±0.001第3天0.444±0.0410.183±0.018第4天0.658±0.0600.549±0.016第5天0.784±0.0680.662±0.047
与同细胞敲低组同时间比较:①P<0.01
2.4 敲低NOB1后前列腺癌细胞PC-3、DU145细胞周期变化 PC-3和DU145细胞阴性对照组的G0/G1期细胞百分比均显著低于敲低组(P值均<0.05),S期细胞百分比均显著高于敲低组(P值均<0.05)。见表2。
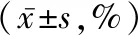

组别细胞周期PC-3DU145空白对照G0/G161.05±1.1747.11±1.90S21.66±1.0735.31±1.69G2/M18.81±0.3219.14±2.22阴性对照G0/G161.30±0.99①43.87±1.23①S20.68±1.09①36.12±1.33①G2/M18.87±0.6021.25±3.15敲低G0/G166.26±1.7951.14±1.49S17.50±0.6132.77±1.07G2/M17.86±1.4218.05±0.67
与同细胞敲低组同细胞周期比较:①P<0.05
2.5 敲低NOB1后前列腺癌细胞PC-3和DU145的侵袭能力变化 PC-3细胞空白对照组、阴性对照组和敲低组迁移细胞数分别为(634±41)、(630±48)、(113±17)个/高倍视野,DU145细胞空白对照组、阴性对照组和敲低组迁移细胞数分别为(350±23)、(351±12)、(85±10)个/高倍视野,两种细胞敲低组的迁移细胞数均显著低于阴性对照组和空白对照组(P值均<0.01)。见图3。

A PC-3细胞空白对照组 B PC-3细胞阴性对照组 C PC-3细胞敲低组 D DU145细胞空白对照组 E DU145细胞阴性对照组 F DU145细胞敲低组
2.6 敲低NOB1可以抑制c-Src磷酸化 为进一步研究NOB1 的功能,本实验在前列腺癌细胞株PC-3和DU145中敲低NOB1,发现前列腺癌细胞在感染了NOB1 干扰慢病毒后,细胞形态变得狭长,呈梭状或纺锤状。随后采用Western印迹法检测NOB1下游可能的信号通路变化情况,PC-3 细胞阴性对照组和敲低组c-Src(tyr416位点)的磷酸化半定量结果分别为1.000±0.000、0.347±0.07,DU145细胞阴性对照组和敲低组c-Src(tyr416位点)的磷酸化半定量结果分别为1、0.439±0.073,两种细胞敲低组c-Src(tyr416位点)的磷酸化半定量均显著低于各自阴性对照组(P值均< 0.01)。见图4。

A PC-3细胞 B DU145细胞 1 阴性对照组 2 敲低组
3 讨 论
由于前列腺癌发病隐匿,早期难以发现,故临床上以中晚期患者为多,我国中晚期前列腺癌患者占总发病人群的60%[12]。前列腺癌的转移常见,尤其是骨转移,超过90%的前列腺癌转移患者会发生骨转移[13]。肿瘤细胞的转移是导致前列腺癌术后复发的主要原因。因此,对前列腺癌转移分子机制的研究,为进一步开发有效的治疗手段提供重要依据,对提高患者生存率具有重要的临床意义。
本研究团队在前期工作中比较了前列腺癌与癌旁组织中NOB1的表达水平,并分析患者预后;结果显示,NOB1在前列腺癌组织中高表达,且与前列腺癌的恶性程度相关[11],提示NOB1可能参与调控前列腺癌细胞的恶性增殖和侵袭性转移。本研究构建了靶向敲低NOB1基因的shRNA慢病毒,检测NOB1敲低后的前列腺癌细胞功能表型的改变。MTT实验结果显示,实验第3、4、5天PC-3、DU145细胞敲低组A595值均显著低于阴性对照组同时间,细胞增殖率被抑制70%以上,提示NOB1基因被沉默后,前列腺癌细胞PC-3、DU145的增殖能力降低;流式细胞仪检测细胞周期结果显示,PC-3、DU145细胞阴性对照组的G0/G1期细胞百分比均显著低于敲低组,S期细胞百分比均显著高于敲低组,提示NOB1被敲低后,前列腺癌细胞PC-3、DU145细胞周期停滞于G0/G1期;Transwell实验结果显示,PC-3、DU145细胞敲低组的迁移细胞数均显著低于阴性对照组和空白对照组,提示敲低NOB1后可使前列腺癌细胞PC-3、DU145的侵袭能力降低;Western印迹法检测结果显示,PC-3、DU145细胞敲低组c-Src(tyr416位点)的磷酸化半定量均显著低于阴性对照组,提示敲低NOB1后可使前列腺癌细胞PC-3、DU145中c-Src的tyr416位点磷酸化水平显著降低。上述实验结果表明,NOB1被敲低后,前列腺癌细胞的增殖和侵袭能力均被抑制,这种细胞表型的变化可能与c-Src(tyr416位点)磷酸化被抑制有关。
c-Src是非受体酪氨酸激酶家族的重要成员[14],是细胞运动能力调控中的一个关键性酪氨酸蛋白激酶,其通过肌动蛋白应力纤维的拆卸、丝足体的组装和黏着斑的动态平衡调控细胞的运动能力[15]。c-Src活性通过蛋白相互作用和磷酸化进行调控,c-Src上有2个重要的磷酸化位点Y416和Y530,前者的磷酸化通过c-Src 的构象改变激活其激酶活性,后者的磷酸化可通过c-Src 内部折叠来抑制其激酶活性的发挥[16]。活化的c-Src通过磷酸化下游底物如雄激素受体、磷脂酰肌醇3-激酶信号通路发挥提高前列腺癌细胞增殖能力的作用;通过磷酸化激活Ezrin、Contractin、Paxilin和Rho鸟苷三磷酸酶等促进肿瘤细胞的迁移和侵袭能力;通过磷酸化激活丝裂原活化蛋白激酶、信号转导和转录激活因子3等发挥促血管生成作用[17-18]。c-Src是肿瘤细胞获得转移潜能的核心分子[19-20]。本研究发现,敲低NOB1可以明显抑制c-Src的tyr146位点磷酸化,该位点是激活c-Src激酶活性所必需的,可以推测NOB1很可能是通过促进c-Src磷酸化促进前列腺癌的转移。
综上所述,NOB1在前列腺癌细胞中的高表达可能通过上调c-Src激酶活性促进肿瘤细胞的迁移和侵袭能力,进而促进肿瘤发生远处转移。但其具体的作用机制和信号通路仍有待进一步研究阐明。
